Tricellulin在结直肠癌中表达的临床意义及其与血管生成的关系*
2022-05-24李梦诗张金秀覃蒙斌廖存孙娟吴晴茹黄杰安
李梦诗,张金秀,覃蒙斌,廖存,孙娟,吴晴茹,黄杰安△
1 广西医科大学第二附属医院消化内科 广西南宁 530007
2 广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021
国际癌症研究中心2020年的研究数据显示,结直肠癌是全球第三大癌症,其死亡人数占所有癌症死亡人数的9.4%,成为癌症死亡的第二大原因[1]。由于大部分患者确诊时已为癌症晚期,因此结直肠癌患者5年生存率较低[2]。血管生成是导致结直肠癌高死亡率和不良预后的主要原因之一,而血管内皮生长因子 (vascular endothelial growth factor,VEGF)是刺激肿瘤血管生成的关键因子[3-4]。VEGF促进血管生成的过程涉及许多蛋白和信号通路,如PI3K-AKT和MAPK信号通路等[5-6]。目前靶向VEGF的抗血管生成治疗可使更多的结直肠癌患者获益,但仍然有一部分患者对药物产生耐药性[7],因此血管生成的其他可能机制仍需进一步探索。三细胞紧密连接蛋白(tricellulin)作为紧密连接相关MARVEL蛋白家族中的一员,主要分布在三个细胞连接处[8],在调控细胞膜的通透性以及大分子物质转运中发挥重要作用[9]。有研究表明tricellulin的异常表达与扁桃体鳞状细胞癌[10]、肝癌[11]、胆管癌[12]、胰腺癌[13]等的进展及预后密切相关。李思漫等[14]研究表明,tricellulin在结直肠癌中高表达,提示tricellulin与结直肠癌的发生发展相关。紧密连接蛋白家族中的其他成员如ZO-1、occludin和claudin-5等与血管生成密切相关[15-16],但tricellulin与结直肠癌血管生成的关系尚不清楚。本研究通过分析人结直肠癌组织中tricellulin、VEGF的表达情况及其与微血管密度(microvascular density,MVD)的相关性,探索tricellulin在结直肠癌中表达的临床意义及其与血管生成的关系。
1 资料与方法
1.1 一般资料
选择2013年3月至2013年12月广西医科大学第一附属医院结直肠肛门外科收治的21例结直肠癌患者为研究对象,收集外科手术切除的结直肠癌组织及对应的癌旁正常组织(距离癌组织大于10 cm)标本各21例。患者年龄25~76岁,平均(56.0±14.0)岁;男性12例,女性9例;TNM分期Ⅰ+Ⅱ期9例,Ⅲ+Ⅳ期12例;有淋巴结转移者11例;有远处转移者10例。本研究经广西医科大学第一附属医院伦理委员会审核通过。
1.2 纳入与排除标准
纳入标准:(1)年龄>18岁,性别不限;(2)经组织病理学确诊为结直肠癌。排除标准:(1)术前接受抗肿瘤治疗(放疗、化疗、免疫治疗或靶向治疗);(2)患者临床病理资料不完整;(3)合并有其他恶性肿瘤;(4)伴有其他肠道器质性疾病。
1.3 免疫组化实验
组织标本经10%福尔马林固定,石蜡包埋,连续切片(厚度约为4 μm),并将切片贴附于载玻片上。将制好的玻片置于65℃恒温烘箱中烘烤2 h,再浸泡于二甲苯中脱蜡,然后依次置于100%、95%、85%、75%梯度乙醇中水化,用0.01 mol/L柠檬酸钠缓冲液高压修复10 min,接着用3% H2O2室温孵育15 min去除内源性过氧化物酶活性,再用磷酸盐缓冲液(PBS)洗3次,每次5 min。滴加山羊血清室温封闭15 min后,加入一抗(tricellulin浓度为1:100,VEGF浓度为1:100,CD34浓度为1:200)4℃恒温孵育过夜。阴性对照组用PBS代替一抗。第二天室温复温1 h,用PBS洗涤3次后加入二抗于37℃恒温孵育15 min。然后,用PBS洗涤3次后滴加辣根过氧化物酶标记的链霉素卵白素孵育15 min,洗涤3次后加入DAB显色2 min,清水冲洗干净后再用苏木精复染细胞核5 min,最后,中性树胶封片。通过显微镜观察细胞染色情况,并进行MVD计数。实验使用的主要试剂有:tricellulin多克隆抗体(Sigma-Aldrich,美囯),VEGF多克隆抗体(Proteintech Group,美国),CD34抗体(北京傲锐东源生物公司,中国),免疫组化SP试剂(北京中杉金桥公司,中国),DAB显色试剂盒、柠檬酸钠抗原修复液和苏木精(北京索莱宝生物公司,中国)。
1.4 观察指标
(1)tricellulin以细胞膜、细胞质或细胞核染色呈棕黄色为阳性细胞,VEGF以细胞质染色呈黄色或棕色为阳性细胞。采用半定量法结合细胞染色强度和阳性细胞数比例判定表达结果[17]。根据细胞染色强度计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。根据阳性细胞百分比计分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将上述两项得分结果相乘:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++),以(-)和(+)定义为阴性表达,以(++)和(+++)定义为阳性表达。(2)MVD计数采用Weidner法[18],计数标准:任何可被CD34染成棕黄色的血管内皮细胞或内皮细胞簇,与邻近血管、肿瘤细胞或其他组织之间存在明显分隔的视为1个微血管。于显微镜低倍镜下(×100)在找到微血管密集区域,然后在高倍镜下(×400)计数5个视野的微血管数,取平均值。所有切片均采用双盲法阅片。
1.5 统计学方法
应用SPSS 20.0统计软件对数据进行统计分析。计量资料以()表示,比较采用独立样本t检验。计数资料用[n(%)]或(n)表示,比较采用χ2检验或Fisher确切概率法。等级资料采用Spearman秩相关进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组织和癌旁正常组织中tricellulin、VEGF表达情况及MVD比较
Tricellulin主要在细胞核和细胞质中表达,细胞膜上有少量表达,VEGF在细胞质中表达,CD34在内皮细胞中表达,且这三者在结直肠癌组织中的表达高于癌旁正常组织。见图1。

图1 免疫组化实验结果图
结直肠癌组织中tricellulin、VEGF阳性表达比例均高于癌旁正常组织,MVD大于癌旁正常组织,差异有统计学意义(均P<0.05)。见表1。

表1 结直肠癌组织与癌旁正常组织中tricellulin、VEGF表达情况及MVD比较
2.2 结直肠癌组织中tricellulin与VEGF表达情况的相关性分析
结直肠癌组织中tricellulin与VEGF的表达呈正相关(r=0.79,P<0.05)。见表2。

表2 结直肠癌组织中tricellulin与VEGF表达情况的相关性分析
2.3 结直肠癌组织中tricellulin、VEGF的表达情况与MVD的关系
Tricellulin阳性表达、VEGF阳性表达的结直肠癌组织中的MVD分别大于tricellulin阴性表达、VEGF阴性表达的结直肠癌组织,差异均有统计学意义(均P<0.05)。见表3。
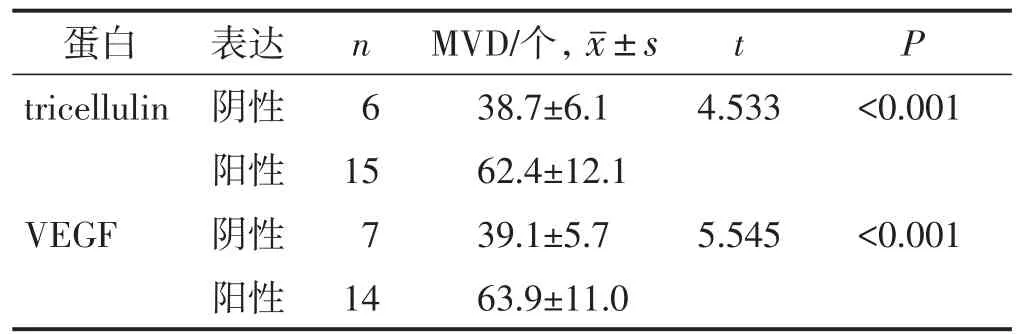
表3 结直肠癌组织中tricellulin和VEGF的表达情况与MVD的关系
2.4 Tricellulin、VEGF的表达情况与结直肠癌临床病理特征的关系
Tricellulin、VEGF的表达与患者年龄、性别无关(均P>0.05);tricellulin、VEGF的表达与结直肠癌患者的淋巴结转移、远处转移、TNM分期有关(均P<0.05)。见表4。

表4 Tricellulin、VEGF的表达情况与结直肠癌临床病理特征的关系n
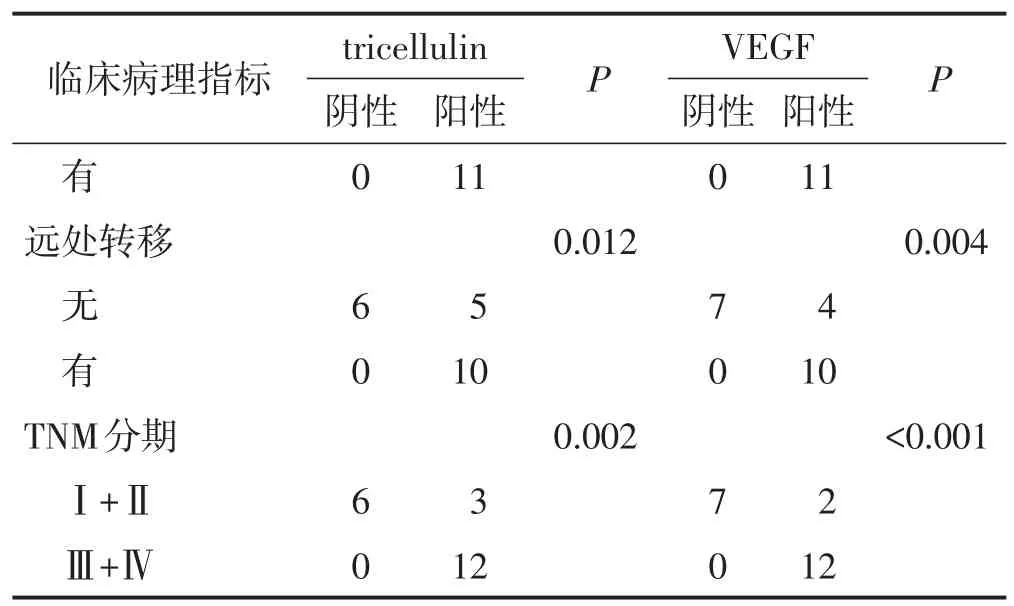
表4(续)
2.5 不同结直肠癌临床病理特征的MVD比较
不同性别、年龄的结直肠癌患者的MVD比较差异无统计学意义(均P>0.05);有淋巴结转移、远处转移的结直肠癌患者的MVD大于无淋巴结转移、远处转移的结直肠癌患者,差异均有统计学意义(均P<0.05),TNM分期为Ⅲ+Ⅳ期的结直肠癌患者的MVD大于TNM分期为Ⅰ+Ⅱ期的结直肠癌患者,差异有统计学意义(P<0.05)。见表5。

表5 不同结直肠癌临床病理特征的MVD比较
3 讨论
Tricellulin是首个被发现的紧密连接跨膜蛋白,主要分布在三个相邻细胞连接处[8]。既往研究显示,tricellulin在扁桃体鳞状细胞癌[10]和肝癌[11]中低表达;此外tricellulin的表达还与肿瘤的分化程度呈正相关,在低分化的胰腺导管癌中tricellulin表达更低[13]。这些研究表明,tricellulin的低表达与肿瘤进展相关,可能是由于tricellulin的减少导致细胞间的连接不够紧密,破坏细胞屏障,影响细胞极性和细胞粘附,从而影响肿瘤进展。此外,Takasawa等[19]研究发现,在低分化的胰腺癌组织中,tricellulin主要分布在胰腺癌细胞的细胞核中,且tricellulin的核定位能够促进细胞增殖和侵袭。Kyuno等[20]的体外细胞实验发现,tricellulin主要分布在低分化的胰腺癌细胞PANC-1的细胞核内,促进胰腺癌细胞的侵袭转移。Masuda等[21]的研究显示,tricellulin分布在胃正常组织的三细胞紧密连接处,而在胃癌组织中,tricellulin则分布于细胞质中。本研究结果显示,tricellulin在结直肠癌组织中表达较癌旁正常组织高,且主要在细胞质和细胞核中表达,这与Takasawa、Kyuno和Masuda等的研究结果相一致。
血管生成是肿瘤细胞的生存机制之一,肿瘤细胞的转移在很大程度上依赖于血管生成[22]。血管生成的特征主要是活化的血管扩张,血管通透性增加,周围基质降解,从而促进内皮细胞增殖和迁移[22-24]。有研究表明,细胞缺氧会诱导一氧化氮、VEGF和血管紧张素等血管活性物质的产生,血管活性物质与细胞外基质蛋白酶相互作用增加毛细血管壁的通透性,引起内皮细胞增殖、迁移,从而促进血管生成以及肿瘤的发生发展[23-24]。VEGF表达于人体各类细胞中,在促进血管内皮细胞生长、诱导新生血管的形成方面起着重要作用[25]。Simonetti等[26]的研究发现,VEGF在肿瘤组织中过表达可促进肿瘤微血管的形成,并在肿瘤细胞的生长、侵袭和迁移中发挥重要作用。MVD作为评估肿瘤血管形成的良好指标,一定程度上反映肿瘤血供丰富程度,肿瘤组织中MVD越丰富,肿瘤生长越快,间接预示患者预后较差。本研究结果显示,结直肠癌组织中tricellulin的表达与VEGF呈正相关,且tricellulin和VEGF阳性表达的结直肠癌组织中的MVD大于tricellulin和VEGF阴性表达的结直肠癌组织,提示结直肠癌中tricellulin的表达与血管生成相关。Erickson等[27]的研究表明,视网膜中VEGF的改变会影响紧密连接蛋白相关蛋白occludin磷酸化水平以及血管的通透性,具体的作用机制尚不清楚,但紧密连接蛋白很有可能通过激活或抑制相关信号通路改变血管通透性,从而影响血管生成。而tricellulin作为紧密连接蛋白的家族成员之一,其与血管生成的关系尚不明确,也鲜少有关于tricellulin与肿瘤血管生成的研究报道。Shimada等[28]的研究发现敲除脂解刺激蛋白受体(LSR)可诱导tricellulin从三细胞紧密连接处移位至双细胞紧密连接处,从而促进子宫内膜癌细胞增殖、迁移和侵袭。Cording等[29]的研究发现在缺血或缺氧条件下,tricellulin也可发生由三细胞间向双细胞间的重分布。我们推测tricellulin分布的改变可能与血管代偿性生成有关,以满足肿瘤生长所需的氧气和营养物质。
在不同肿瘤中,tricellulin与疾病预后的关系也不完全一致。Schlachter等[30]的研究发现,tricellulin过表达的肝母细胞瘤患者的预后较好。tricellulin低表达与胆管癌不良预后相关,而肝细胞癌的不良预后却与tricellulin过表达相关[12]。此外,tricellulin过表达与胰腺癌患者的淋巴结转移、较短的生存期有关[19]。本研究结果与上述研究一致,我们发现tricellulin表达与患者年龄、性别无关,而与结直肠癌患者淋巴结转移、远处转移及TNM分期有关。此外,研究表明MVD与结直肠癌患者的无复发生存时间(RFS)和总生存期(OS)呈负相关,VEGF高表达预示着较差的RFS[31]。Carvalho等[32]发现,MVD越大,乳腺癌患者远处转移和术后复发的风险就越高。随着MVD数量的增加,肿瘤形成、侵袭和转移的可能性增加[33-34]。本研究结果显示,有淋巴结转移、远处转移和TNM分期为Ⅲ+Ⅳ期的结直肠癌患者的VEGF阳性表达比例分别高于无淋巴结转移、远处转移和TNM分期为Ⅰ+Ⅱ期的结直肠癌患者;有淋巴结转移、远处转移和TNM分期为Ⅲ+Ⅳ期的结直肠癌患者的MVD分别大于无淋巴结转移、远处转移和TNM分期为Ⅰ+Ⅱ期的结直肠癌患者。
综上所述,tricellulin可能参与调节结直肠癌血管生成,影响肿瘤转移和发展。然而,本研究仅局限于临床样本的检测,未来还需要开展细胞分子实验、动物实验以探究tricellulin参与调节血管生成及其影响肿瘤转移和发展的相关分子机制。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。
