Gd-EOB-DTPA 增强MRI 对肝肿瘤术前肝储备功能评估的临床价值
2022-05-24胡景卉王笑笑黄京城罗先富
胡景卉,王笑笑,黄京城,杨 鑫,叶 靖,罗先富
(1.扬州大学临床医学院,江苏 扬州 225001;2.江苏省苏北人民医院医学影像科,江苏 扬州 225001;3.大连医科大学扬州临床医学院,辽宁 大连 116031)
手术切除是肝肿瘤重要的治疗手段,术前肝储备功能的准确定量评估将大大降低围手术期的死亡率,改善患者预后[1]。吲哚菁绿(indocyanine green,ICG)清除试验是肝储备功能及肝切除范围评估的金标准[2]。但ICG 仅通过胆汁排泄,当胆道系统发生梗阻时,血清胆红素的升高会竞争性地抑制ICG 在体内的运输过程,使滞留率存在偏差。钆塞酸二钠(Gd-EOB-DTPA)是一种肝细胞特异性对比剂,其通过肝细胞膜表面的有机阴离子转运多肽(OATP)被正常肝细胞特异性摄取;MRI 肝胆特异期成像不仅有利于肝肿瘤的定性诊断,理论上还可反映肝功能情况[3]。本研究收集行Gd-EOB-DTPA 增强MRI 的肝肿瘤患者,以期定量测定术前肝储备功能,为临床肝肿瘤切除术提供重要依据。
1 资料与方法
1.1 一般资料 回顾性分析2020 年9 月至2021 年12 月就诊于江苏省苏北人民医院行术前ICG 清除试验及Gd-EOB-DTPA 增强MRI 检查的肝肿瘤患者74 例。收集患者在行ICG 清除试验前后1 周内的实验室检查指标,即血小板(PLT)、凝血酶原时间(PT)、总胆红素(TBIL)、血清白蛋白(ALB)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)。
纳入标准:①肝脏肿瘤病变且病灶大小不超过2 个肝段;②术前均行ICG 清除试验及Gd-EOB-DTPA增强MRI,且间隔时间≤1 周;③MRI 图像质量满足定量、定性分析;④临床及实验室资料完整。排除标准:①肝内多发肿瘤病灶;②病灶范围过大或肝内弥漫性非肿瘤性病变影响定量测量者;③有肝肿瘤切除病史或介入栓塞治疗病史;④肝门区胆道系统梗阻;⑤Child-Pugh 分级C 级[4]。本研究经医院伦理委员会批准(批准文号:2021ky219),免除受试者知情同意。
74 例患者排除肝内多发转移瘤3 例、肝肿瘤术后复发6 例、介入栓塞手术史7 例、肝门区胆道梗阻5 例,最终纳入研究53 例,包括肝细胞癌42 例、周围型胆管细胞癌8 例、单发肝转移瘤2 例和上皮样血管平滑肌脂肪瘤1 例。
1.2 ICG 清除试验 清晨患者安静、空腹(禁食6~8 h、禁饮4 h),按剂量0.5 mg/kg 体质量配置ICG 溶液,以无菌注射用水5 mL 溶解稀释ICG 25 mg,于肘正中静脉一次性快速注入;15 min 后,将从对侧肘静脉抽出的血液进行分光光度计比色,测定并计算此时血液中的ICG 滞留率,即ICG 15 min 滞留率(ICG R15)。根据《肝切除术前肝脏储备功能评估的专家共识(2011 版)》[5]及以往文献中肝切除安全限量的评估标准[6],滞留率<10%认为肝脏储备功能基本正常,患者可耐受大范围的肝切除;滞留率>20%则认为超过2 个肝段的大范围肝切除后,肝功能衰竭风险较大;滞留率越高,说明肝储备功能越差。
1.3 MRI 检查 采用GE Discovery 750 3.0 T MRI 扫描仪,扫描前患者空腹6~8 h。采用呼吸门控技术,扫描范围从膈顶至双肾下缘。扫描序列及参数:T1WI及增强扫描采用肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)序列,TR 3.7 ms,TE1.7 ms,层厚5.0 mm,层距2.5 mm,矩阵256×224,视野40 cm×40 cm;T2WI 采用轴位呼吸门控脂肪抑制序列,TR 6 600.0 ms,TE 64.0 ms,层厚5.0 mm,层距6.5 mm,矩阵320×320,视野38 cm×38 cm;DWI采用轴位呼吸门控脂肪抑制序列,TR 6 300.0 ms,TE 52.0 ms,层厚5.0 mm,层距6.0 mm,矩阵160×160,视野38 cm×38 cm,b=0、800 s/mm2。对比剂采用Gd-EOB-DTPA(德国拜耳),剂量0.025 mmol/kg 体质量,注射流率2.0 mL/s,后以相同流率注射20 mL生理盐水进行冲洗,分别于注射对比剂后20 s、60 s、3 min 及20 min 行动脉期、门静脉期、移行期及肝胆特异期扫描。
1.4 图像分析 由2 名分别有3、5 年腹部影像诊断经验的放射科医师采用双盲法在T1WI 及增强扫描肝胆期图像上,分别在增强扫描前后对应层面的肝脏尾状叶、左叶、右前叶、右后叶及右侧竖脊肌手动勾画圆形ROI(50~100 mm2)(图1)。避开肿瘤实质部分、血管、胆管、呼吸和/或心脏搏动所致的运动伪影区。肝脏4 个叶T1WI 信号值的平均值记为SL0,肝胆期记为SL1;右侧竖脊肌T1WI 平扫信号值记为SM0,肝胆期记为SM1。计算肝胆期经竖脊肌校正后的肝实质相对强化程度(relative enhancement,RE),公式为RE=(SL1/SM1-SL0/SM0)/(SL0/SM0)×100%[7]。

图1 女,68 岁,肝右叶占位性病变,手术病理为肝细胞癌,MRI 示肝硬化征象图1a T1WI 平扫轴位图像上勾画肝脏5 个ROI(尾状叶、左叶、右前叶、右后叶及右侧竖脊肌)(箭头)图1b Gd-EOB-DTPA 增强扫描肝胆特异期对应的5 个ROI。肝实质相对强化程度(RE)为19.1%。T1WI平扫示肿瘤边界部分显示不清,肝胆特异期清楚显示肿瘤假包膜(箭头)图2 男,49 岁,肝右叶包膜下占位性病变,手术病理为肝细胞癌,图2a~图2c均为肝胆特异期图像图2a 病灶未见对比剂摄取(箭头)图2b 肝实质信号强度高于右肾,记2 分图2c 门静脉信号强度低于肝实质,记2 分(粗箭);胆总管内见对比剂,记2 分(细箭)。功能性肝脏影像评分(FLIS)6 分图3,4 分别为吲哚菁绿15 min 滞留率(ICG R15)与RE、FLIS 评分之间的相关线性图,r 值分别为-0.660、-0.506图5 ICG R15 以20%为界分组的影像学及临床定量数据的ROC 曲线,RE 联合血小板(PLT)的AUC 最高,为0.928
由上述2 名医师采用双盲法分别对肝胆期图像进行功能性肝脏影像评分(functional liver imaging score,FLIS)标准[8]:①肝实质增强得分,肝胆期肝实质信号强度低于右肾实质为0 分,等于为1 分,高于为2 分;②肝胆期门静脉信号得分,肝胆期门静脉信号强度高于肝实质为0 分,等于为1 分,低于为2 分;③胆道对比剂排泄速率得分,注射对比剂20 min 后胆道无对比剂为0 分,对比剂排泄至外周肝内胆管或左/右肝管为1 分,排泄至肝总管、胆总管或十二指肠为2 分。2 名医师分别对3 个征象进行视觉评估。FLIS 评分为3 项得分之和,总分为6 分,分值越低,表示患者肝功能受损越严重(图2)[9]。
1.5 统计学方法 采用SPSS 23.0 软件进行数据分析。采用组内相关系数(ICC)分析,检验2 名医师对RE 的测定及FLIS 评分之间的一致性,如一致性良好(ICC>0.75),则使用测量的平均水平进一步分析。ICG R15 与影像学定量参数、实验室指标之间的相关性行Spearman 相关分析。分别以ICG R15 10%及20%为界限分组,2 组间影像学与临床实验室定量参数之间的比较行非参数秩和检验或χ2检验;连续性定量数据以M(IQR)或表示。对差异有统计学意义的连续性定量数据绘制ROC 曲线并分析其诊断效能,采用MedCalc 19.5.6 软件Z 检验对AUC进行两两比较。以P<0.05 为差异有统计学意义,P<0.001 为差异有显著统计学意义。
2 结果
2.1 患者的临床特征 53 例中,男35 例,女18 例;年龄27~81 岁,中位年龄65(15.5)岁。经实验室检查、病理和/或影像学判定,乙型肝炎51 例,丙型肝炎1 例,肝硬化31 例。Child-Pugh 评分及分级:A 级39 例,B 级14 例。
2.2 影像及实验室定量指标与ICG R15 的相关性2 名医师对RE 的测定和FLIS 评分的评估一致性良好,ICC 分别为0.889、0.921(均P<0.001)。ICG R15与RE、FLIS 评分及Child-Pugh 评分之间r 值分别为-0.660、-0.506、0.510(均P<0.001)(图3,4),均有较强的正或负相关性,且其中RE 具有最强负相关 性;ICG R15 与实验室指标PLT、ALT、AST 的r 值分别为-0.421(P=0.002)、-0.064(P=0.651)、0.080(P=0.570)。
2.3 不同分组间影像、临床及实验室定量参数比较以ICG R15 10%分组后,24 例<10%,29 例≥10%;以ICG R15 20%分组后,38 例<20%,15 例≥20%。分别以10%及20%分组的RE、FLIS 评分、Child-Pugh评分、PLT 比较,差异均有统计学意义(均P<0.05);ICG R15<10%组与ICG R15≥10%组及ICG R15<20%组与ICG R15≥20%组患者的性别、年龄和临床常用肝功能实验室指标ALT、AST 差异均无统计学意义(均P>0.05,表1、2)。
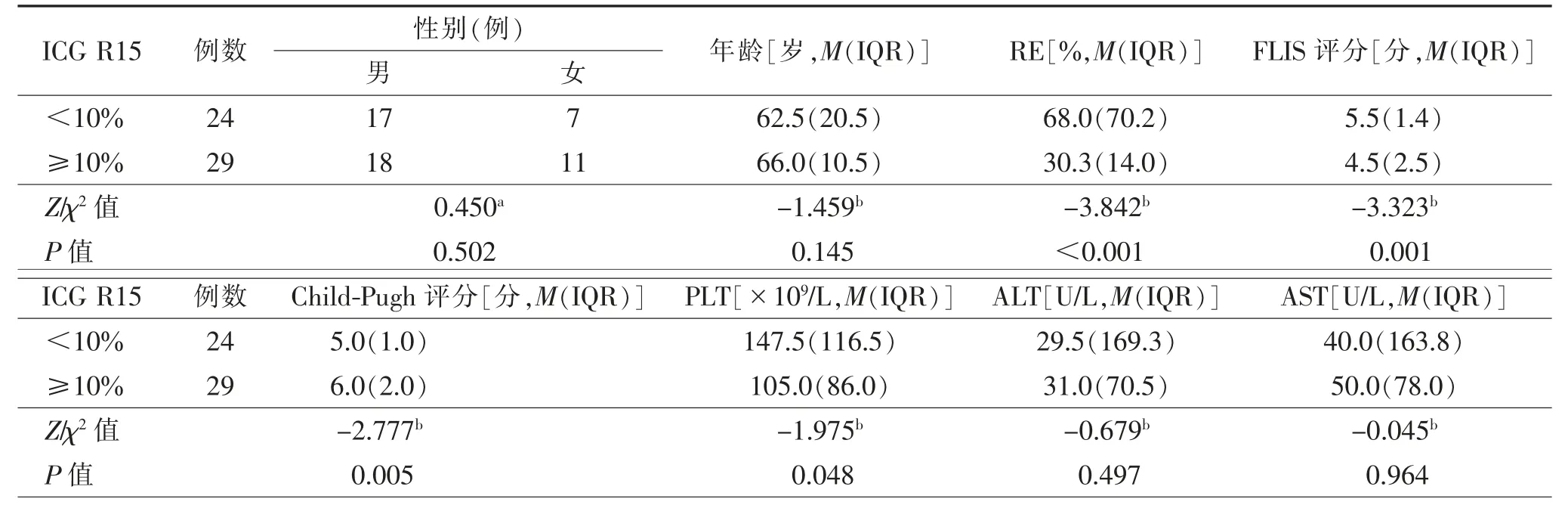
表1 以ICG R15 10%为界分组肝肿瘤患者的临床及影像特征比较
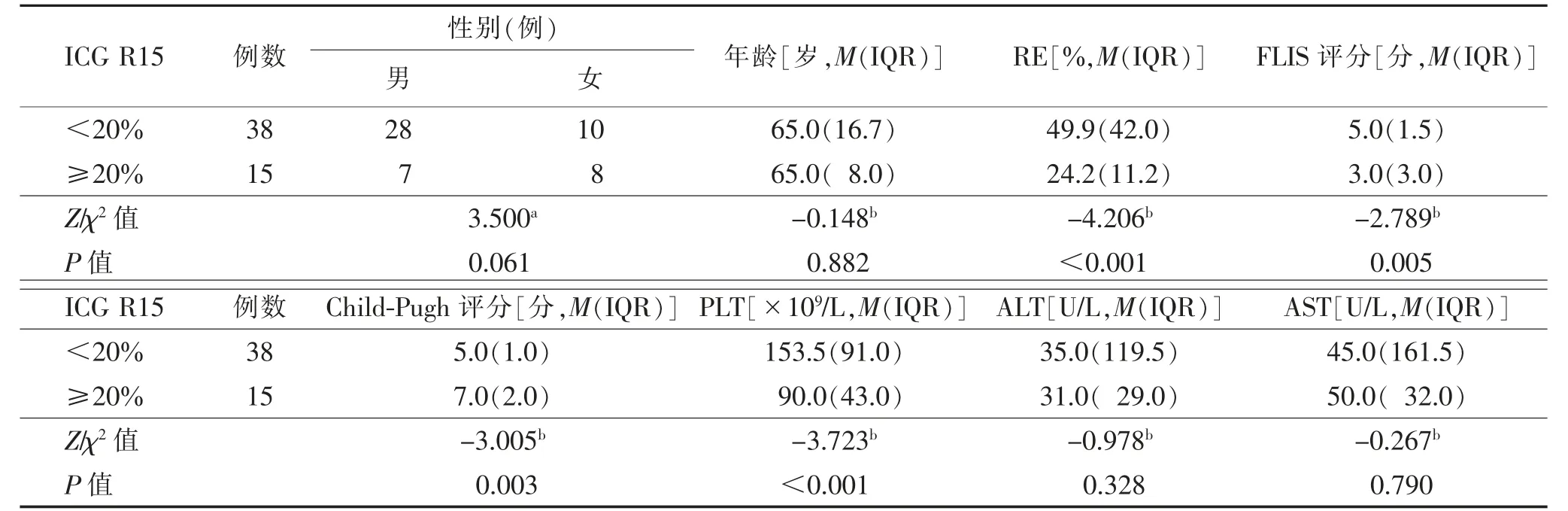
表2 以ICG R15 20%为界分组肝肿瘤患者的临床及影像特征比较
2.4 影像及临床定量指标对肝储备功能的诊断效能以ICG R15 10%为界分组时,RE 的AUC 为0.809,对应的最佳截断值为36.1%;以ICG R15 20%为界分组时,RE 的AUC 为0.874,对应最佳截断值为32.2%。2 组的其余单因素定量指标的AUC 均小于RE(以10%为界分组FLIS 评分、Child-Pugh 评分及PLT 的AUC 值分别为0.763、0.707、0.659;以20%为界分组见表3)。以20%为界分组时,RE 联合PLT 的AUC 为0.928,具有最佳诊断效能(图5);RE 联合Child-Pugh评分与Child-Pugh 评分、FLIS 评分的诊断效能比较,差异均有统计学意义(均P<0.001),RE 联合PLT 与Child-Pugh 评分之间差异有统计学意义(Z=2.157,P<0.05),其余差异均无统计学意义(均P>0.05)。
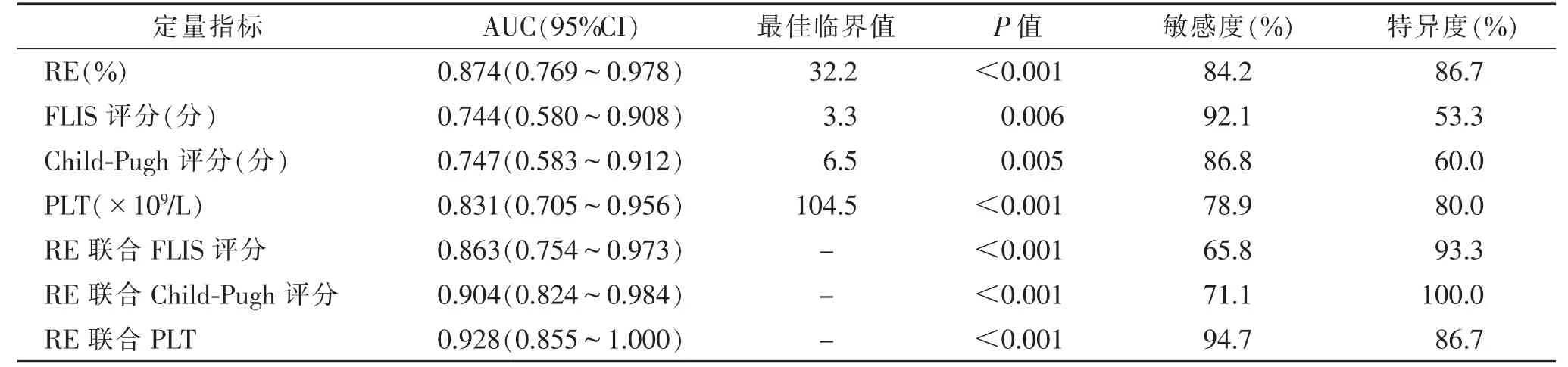
表3 影像学及临床定量指标的诊断效能(ICG R15 以20%为界分组)
3 讨论
本研究分析了ICG R15 与RE、FLIS 评分、Child-Pugh 评分、PLT、ALT 及AST 之间的相关性。结果显示,RE 与ICG R15 相关性最高,与文献[10]报道一致,较其他定量指标评估肝功能储备的意义更大,而与临床常用的肝功能实验室指标ALT、AST 并无相关性。相关线性图显示,肝胆期RE 较高患者ICG R15较低,表明有正常功能的肝细胞数量越多,肝储备功能越好。本研究以ICG R15 10%与20%分组时,对应的肝胆期RE 截断值分别为36.1%、32.2%,这为术前定量评估肝储备功能提供了定量参考指标。
Gd-EOB-DTPA 是肝细胞特异性对比剂,其中的乙氧基苯甲基(EOB)基团可被肝细胞特异性地摄取,约50%通过肝细胞窦间隙膜上的OATP 1B1 和OATP 1B3 从细胞外间隙转运至正常肝细胞,以胆汁的形式排出,约50%经肾脏排泄[11]。肝功能障碍不仅影响肝细胞对对比剂的摄取,还影响其在胆道系统的排泄。Bastati 等研究出了一种简易快捷评估肝功能的方法——FLIS 评分,包括3 个肝胆期特征征象:肝实质对比肾增强、胆道对比剂排泄和门静脉征[12]。文献证实,FLIS 评分及其3 个评分参数与临床Child-Pugh 评分之间均有很强的相关性,并有助于预测首次肝失代偿的发生,与其他评估肝储备功能的方法相比,通过这3 个参数可更简单、更直观地对肝功能进行分级[13]。由于其评分标准涉及胆道排泄,因此针对胆系扩张疾病的评估存在一定的局限性。而肝胆期肝实质RE 可更详细、准确地对肝储备功能作出量化评估,具有更大的临床价值。有文献指出,Gd-EOB-DTPA 增强扫描前及肝胆期的T1mapping图像甚至可对乙型病毒性肝炎各期肝纤维化进行评估[14]。
研究表明,PLT 与肝再生关系密切,输注PLT 有助于慢性肝病患者的肝功能恢复及肝再生[15]。因此,有学者认为术前PLT 的数值可在一定程度上预测患者术后发生肝功能不全的概率[16]。有学者认为,PLT单因素确实对肝癌患者肝功能的预测有一定意义,联合ICG R15 后预测价值进一步提高[17]。本研究显示,RE 联合PLT 后诊断评估效能达0.928,较RE、PLT 单因素的AUC 值高,进一步说明肝胆期RE 在评估肝肿瘤患者术前肝储备功能方面,具有和ICG R15 相似的作用。
本研究存在的局限性:①仅对肝癌患者肝切除术前的肝储备功能评估,通过Gd-EOB-DTPA 增强MRI 进行定量分析,而能否适用于所有肝肿瘤患者尚未可知[18];本研究除肝细胞癌外的肝肿瘤患者例数较少,RE 是否适用于其他肝肿瘤患者,还需进一步研究。②未能纳入肝肿瘤的大小及肿瘤切除术后的残余体积,仅限制了肝脏肿瘤病变的多少及范围。③RE 为手动勾画肝脏4 个叶ROI 信号值的平均值,为肝肿瘤患者总体的肝储备功能评估;而文献指出肝肿瘤患者肝功能的分布是不均匀的[19],需据此进行更详细的肝功能的分段或分叶研究。
综上所述,Gd-EOB-DTPA 增强MRI 的肝胆期肝实质RE 可定量测定肝肿瘤患者的肝储备功能。通过定量比较肝胆期不同患者的肝实质的RE,有利于术前筛选出肝储备功能较差的患者,通过MRI 一站式检查为肝肿瘤切除术提供重要信息,对肝肿瘤患者的诊疗具有重要的临床意义。
