腹腔镜与开腹胰十二指肠切除术的安全性和疗效对比研究
2022-05-24邓静陈焕伟
邓静,陈焕伟
胰腺癌和壶腹周围癌是消化系统中起病较为隐匿的恶性肿瘤,其发病率有逐年上升的趋势,严重危害生命健康,胰十二指肠切除术(pancreaticoduodenectomy,PD)是治疗该类疾病的标准手术[1]。PD 术式主要包括传统的开腹胰十二指肠切除术(open pancreaticoduodenectomy,OPD)和当今日益盛行的腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)。近年来,微创胰十二指肠切除术的相关研究已成为当今的热点,但是在手术安全性及疗效等方面有相当多的观点远未达成共识。本研究通过回顾性对比分析佛山市第一人民医院肝脏胰腺外科5 年余来实施的LPD 和OPD 患者的临床资料,探讨LPD 的安全性及疗效,为更加安全有效地开展PD 提供客观有力的理论依据和技术参考。
1 资料与方法
1.1 临床资料
经医院医学伦理委员会批准,收集该院肝脏胰腺外科2016 年1 月~2021 年8 月成功实施PD的患者,按以下标准将筛选后的49 例PD 术后患者分成LPD 组(n=23)和OPD 组(n=26)。两组患者性别、年龄、BMI、CA19-9、白蛋白、总胆红素、基础疾病(高血压、糖尿病和冠心病)例数、麻醉风险ASA 分级例数等术前一般资料的比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:选择由同一组完成的PD 患者;患者一般情况良好,无明显器官障碍病变,术前影像学检查肿瘤无远处转移,术前未接受新辅助放化疗,术后病理诊断为胰腺癌或壶腹周围癌。排除标准:既往有腹部手术史致腹腔严重粘连者,术中腹腔探查后无法行根治术仅行姑息性手术治疗者,术中联合其它脏器切除者,依从性差、不能坚持治疗或随访者。
1.2 方法
LPD 组和OPD 组分别在腹腔镜和开腹状态下完成胰十二指肠切除术。术后根据病情必要时转ICU 重症监护,密切监测生命体征、胃肠减压、禁食水、抗感染、护胃制酸、抑制胰液分泌、护肝、营养支持、防止离子紊乱、换药等治疗。
1.3 观察指标
1.3.1 手术安全性 手术时间、术中出血量、术中输血例数等术中情况;胰瘘、胆瘘、出血、胃排空延迟、腹腔感染例数及术后并发症Clavien-Dindo 分级[2]。
1.3.2 手术疗效 包括术后入住ICU 人数、术后首次下床活动时间、术后首次肛门排气时间、非计划再次手术例数、术后住院日、术后VAS 疼痛评分、术后基本日常生活活动能力(BADL)评分[3]等术后恢复情况;标本肿瘤长径、术中淋巴结清扫数目、淋巴结阳性患者例数、R0 切除率、肿瘤分化程度、病理分期、肿瘤来源例数等术后肿瘤学结果;出院30 d 内再次入院率(化疗除外)、术后复发率、术后90 d 死亡率和术后1 年、2 年、3 年生存率等术后随访情况。
1.4 随访
采用电话沟通、门诊定期复诊、查询入院记录等方式进行随访,随访时间截止至2021 年12 月。
1.5 统计分析
采用SPSS 25.0 软件进行统计学分析处理。经Shapiro-Wilk 检验符合正态分布的计量资料,以均数±标准差()表示,经方差齐性检验证实方差齐后,组间比较采用两独立样本的t检验;不符合正态分布的计量资料以中位数(四分位数)即M(Q1,Q3)表示,组间比较采用两独立样本的Mann-WhitneyU检验。计数资料以例数和百分比[n(%)]表示,组间比较采用χ2检验或Fisher 精确检验。运用Kaplan-Meier 法计算生存率并绘制生存曲线,采用Log-rank 检验进行生存分析。以0.05 为检验水准,当P<0.05时,表示差异具有统计学意义。
2 结 果
2.1 LPD 组和OPD 组的手术安全性对比
2.1.1 术中情况 LPD 组比OPD 组手术时间长(P<0.01),术中出血量少(P<0.05),差异有统计学意义;两组术中输血率相近(P>0.05),差异无统计学意义。详见表1。
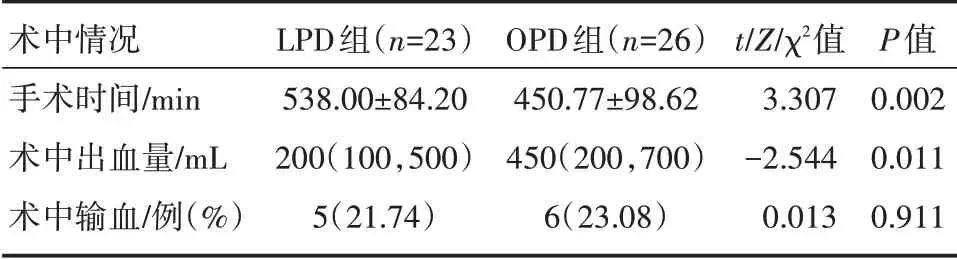
表1 LPD 组和OPD 组患者术中情况的比较
2.1.2 术后并发症 两组所有术后并发症的比较,差异均无统计学意义(P>0.05),详见表2。
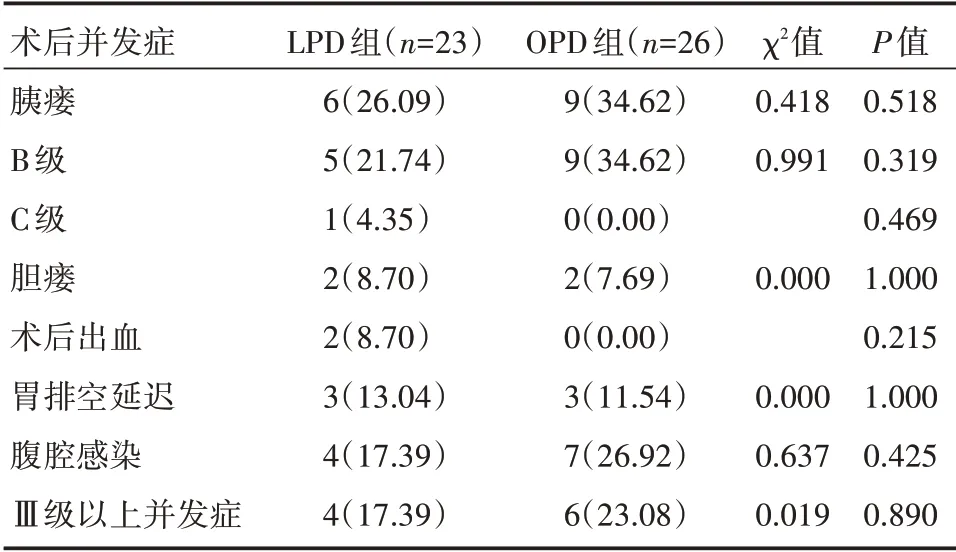
表2 LPD 组和OPD 组患者术后并发症的比较[例(%)]
2.2 LPD 组和OPD 组的手术疗效对比
2.2.1 术后恢复情况 LPD 组术后患者入住ICU 率和非计划再次手术人数与OPD 组相当(P>0.05),差异无统计学意义;LPD 组术后首次下床活动时间和首次肛门排气时间比OPD 组早(P<0.01),术后住院日比OPD 组短(P<0.05),差异均具有统计学意义。详见表3。
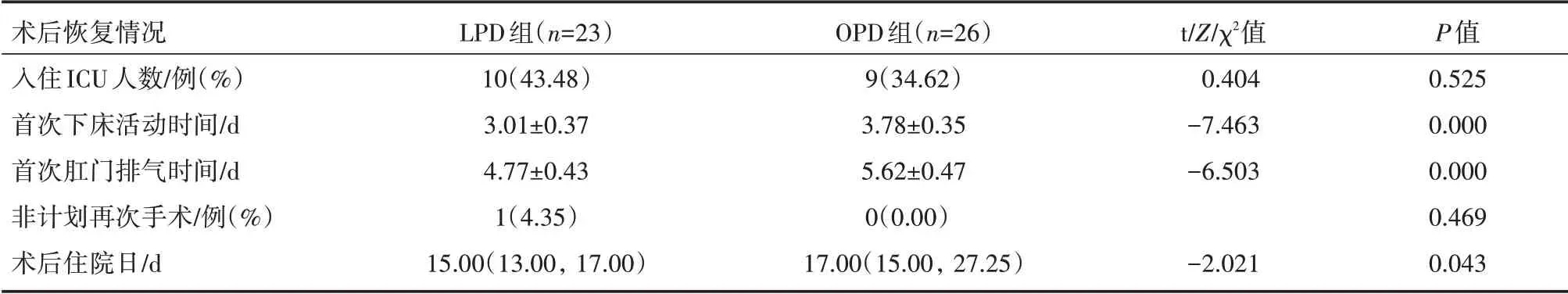
表3 LPD 组和OPD 组患者术后恢复情况的比较
LPD 组术前VAS 疼痛评分与OPD 组相当(P>0.05),差异无统计学意义;LPD 组比OPD 组患者的术后第3 d、6 d VAS 疼痛评分低(P<0.01),差异均具有统计学意义。详见表4。
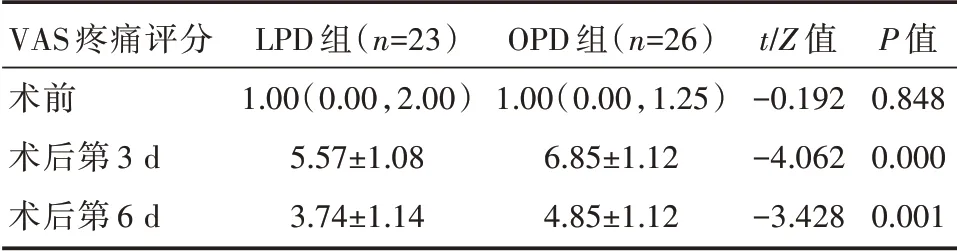
表4 LPD 组和OPD 组患者VAS 疼痛评分的比较
LPD 组患者术前BADL 量表评分与OPD 组相当(P>0.05),差异无统计学意义;LPD 组比OPD 组患者的术后第3 d、6 d BADL 量表评分高(P<0.01),差异均具有统计学意义。详见表5。
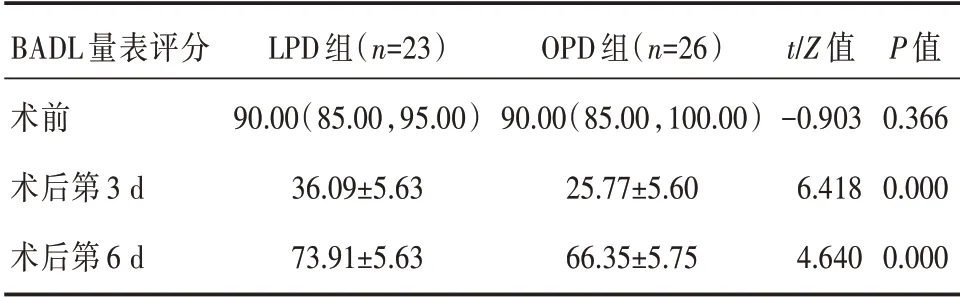
表5 LPD 组和OPD 组患者基本日常生活活动能力(BADL)评分的比较
2.2.2 术后肿瘤学结果 两组的术后肿瘤学结果相近(P>0.05),差异无统计学意义。详见表6。
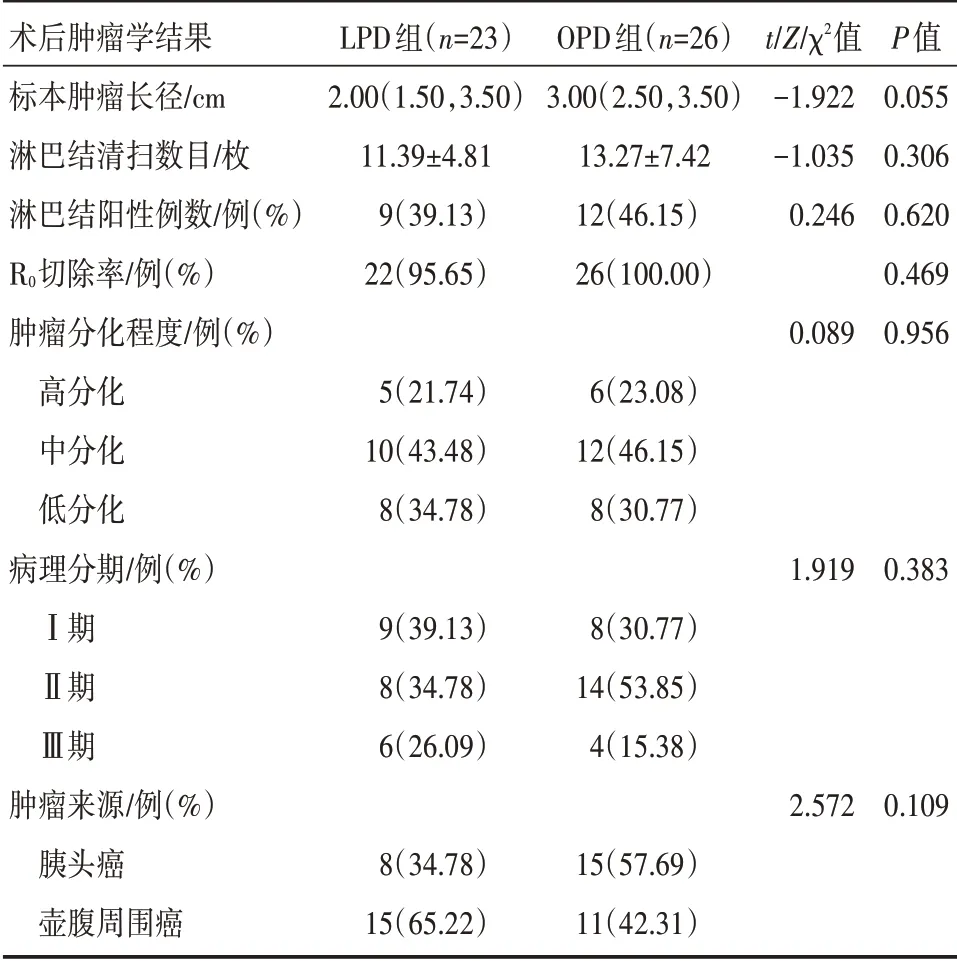
表6 LPD 组和OPD 组患者术后肿瘤学结果的比较
2.2.3 术后随访情况
两组的术后随访情况,差异均无统计学意义(P>0.05)。详见表7。
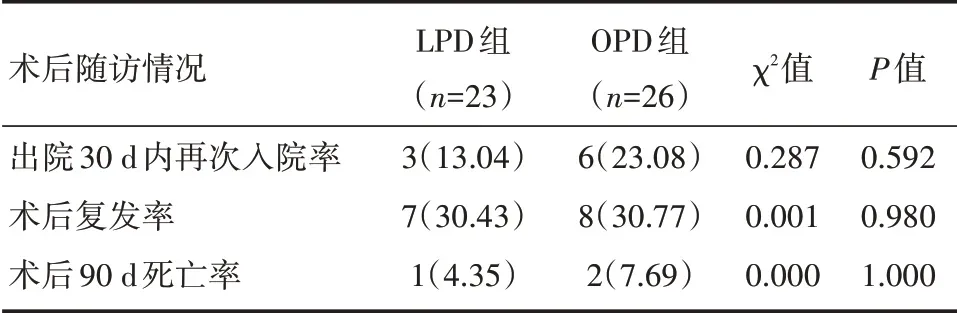
表7 LPD组和OPD组患者术后随访情况的比较[例(%)]
LPD 组和OPD 组术后随访时间1~71 个月,中位随访时间22 个月。两组术后1 年生存率分别为81.7%和72.4%,术后2 年生存率分别为76.6%和61.1%,术后3 年生存率分别为67.0%和52.4%;两组患者整体生存率的比较,差异无统计学意义(χ2=0.557,P=0.456),生存曲线见图1。
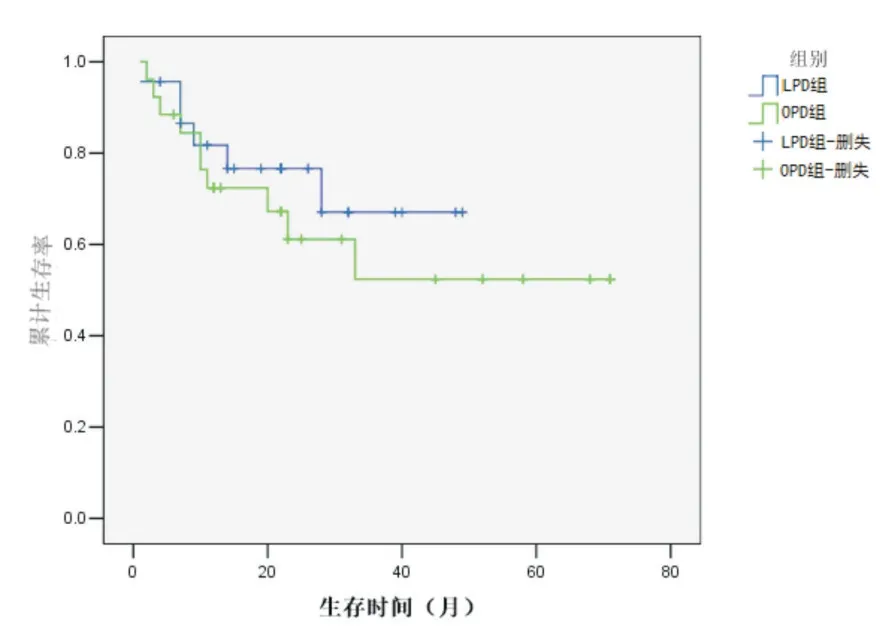
图1 LPD 组和OPD 组患者的生存曲线图
3 讨 论
胰腺癌和壶腹周围癌是恶性程度非常高的消化道肿瘤,预后差,而根治性PD 是现阶段该类疾病获得长期疗效的最有效方式[4],目前运用最多的术式是OPD 和LPD。
与OPD 相比,LPD 具有创伤小、恢复快等优势。但由于LPD 是普外科中最为复杂和技术难度最大的腹腔镜手术[5],其安全性及疗效一直颇受争议。美国国家癌症中心的一项数据显示,LPD与OPD 的近期、远期疗效以及中位生存时间相似[6];甚至LPD 在美国的Mayo Clinic 等医疗中心已是常规术式[7]。但是依旧有研究不支持上述观点。Dokmak[8]的研究显示,与OPD 相比,LPD 的术后并发症发生率高,不支持其作为常规术式开展。2019 年 荷 兰 的van Hilst 团 队[9]开 展 了 一 项 关 于LPD 和OPD 安全性和术后疗效的多中心随机对照研究,由于LPD 组术后90 d 死亡率高达10%,而OPD 组为2%,出于对患者安全性方面的考虑,这项研究遗憾地被提前终止。此事引发了医疗界对开展LPD 的必要性和安全性进行了重新思考。LPD 有无操作上的优势,对于学习曲线相对较短的中心和手术医师而言,可能耗时更长的LPD 在安全性方面有无优势,LPD 的肿瘤学结果和长期疗效怎样,LPD 术中气腹是否会引起肿瘤细胞的种植转移,这些问题都值得我们深思和探讨。
手术时间的长短与学习曲线密切相关。国内有学者[10]将LPD 的学习曲线划分为三个时期:1~11 例为初始学习期,12~38 例为技术胜任期,39~57 例为挑战期。初期时LPD 的手术时间长,一方面是由于腔镜手术的自由度和灵活度不如开腹手术,另一方面是由于PD 本身的复杂度和难度所决定。对于LPD 初学者而言,在处理胰腺钩突的分离和切除、腹腔深部淋巴结的清扫、消化道重建特别是胰肠吻合这些操作难点时,将消耗术者较多的时间。本研究中LPD 组的手术时间比OPD 组长,跟以上原因密切相关,相信随着手术量的积累,当度过第三阶段挑战期的学习曲线后,手术时间将会明显缩短并接近OPD。
胰瘘作为PD 术后最常见的并发症,也是PD术后患者死亡的重要原因。Pedrazzoli[11]对近25 年54 232 篇文献的荟萃分析显示,PD 术后总体的胰瘘发生率为21.3%,由此而导致的相关病死率为0.97%,但C 级胰瘘的病死率则高达25.7%。胰瘘常与胰腺的质地、胰管直径、胰肠吻合的方式和技巧有关。本研究中术后胰瘘的人数LPD 组为6 例(26.09%),OPD 组为9 例(34.62%),两种术式对胰瘘的影响差异并无统计学意义。两组胰瘘患者经充分引流、抗感染、抑制胰液分泌、加强营养等保守治疗的方式多逐渐治愈。对于术后胰瘘患者,不可盲目地再次手术,否则二次手术的创伤打击会明显增加患者的器官功能衰竭和死亡率[12]。
在术后恢复方面,本研究中LPD 组得益于腹腔镜的微创优势,相对于OPD 组而言,术后疼痛评分更低,而基本日常生活活动能力评分更高,有着更好的术后生活质量,因此术后LPD 组可以更早地下床活动,促进胃肠功能尽早恢复,从而有利于早日康复,缩短住院时间。Croome 等[13]研究显示,LPD 组住院日的缩短有利于术后较早地接受辅助治疗,肿瘤局部复发的概率明显降低,最终可能使患者获益。
在肿瘤学方面,有研究表明[13],患者术后的生存情况与肿瘤大小、淋巴结的阳性数目、手术边缘状况以及肿瘤的分化程度密切相关。Chen 等[14]的研究报道,LPD 组的R0 切除率优于OPD 组;这可能得益于在腔镜的放大视野下,可以更加清晰地全方位观察肿瘤,有利于肿瘤更加完整彻底地切除。Croome 等[13]对322 例患者的肿瘤学资料进行比较显示,LPD 组和OPD 组的肿瘤直径、淋巴结清扫率、淋巴结阳性率、R0 切除率及肿瘤分期均无显著性差异。本研究中的肿瘤学结果与Croome等的报道相似,LPD 组获得了与OPD 组同样的肿瘤学结果。
在术后随访方面,美国国家肿瘤数据库对22 013 例相关患者的资料研究显示,微创PD 组患者的30 d 再入院率要低于开放PD 组,但差异无统计学意义[15];本研究中剔除化疗患者,LPD 组出院后30 d 内再次入院率低于OPD 组(13.04%vs.23.08%),略显优势,但无显著差异,结果与上述报道相似。由于本研究中两组患者术后相近的肿瘤学结果,故在术后肿瘤复发方面,LPD 组和OPD 组并未显示出明显差异(30.43%vs.30.77%)。美国Kantor 等[6]的一项关于8213 名PD 患者的回顾 性研究显示,LPD 组和OPD 组的术后90 d 死亡率无显著差异。本研究中LPD 组与OPD 组的术后90 d死亡率相近,围手术期死亡率无明显差异。
在远期生存方面,关于LPD 的部分研究显示出让人欣慰的结果。Chapman 等[16]的研究报道,LPD 组的中位生存期要长于OPD 组(P=0.022)。Chen 等最近的一项Meta 分析[17]显示,LPD 具有与OPD 相似的术后肿瘤学结果,而且LPD 在术后远期生存方面显示出一定的优势:LPD 组及OPD 组的生存率在术后第1 年、第2 年无显著性差异;但在术后第3 年、第4 年及第5 年LPD 组的生存率高于OPD 组(P<0.05),差异具有统计学意义。这项研究似乎揭示了LPD 在长期生存率方面占有一定的优势,但这些研究都不是随机对照试验,可能存在一些局限性和选择偏倚,而且对于可能影响到患者预后的因素如术者的学习曲线、术后肿瘤分化程度、肿瘤分期以及是否接受了辅助治疗等临床资料的完整性等都没有全面而清晰的记录。本研究发现,随访期内LPD 组和OPD 组术后死亡患者死亡时间多发生在术后1 年内,结合术后肿瘤学结果及随访结果分析发现,原因可能如下:大部分术后死亡患者并不是死于围手术期术后并发症,而是死于术后复发转移,提示PD 术后肿瘤复发转移及死亡的高峰期可能在术后1 年;肿瘤直径较大或手术切缘为R1 切除的患者预后差,术后很快复发转移;术后并发症可能会导致机体抵抗力下降,术后较早地出现肿瘤复发;传统的影像学术前检查并不能完全发现所有的肿瘤微小转移灶,这类患者虽然行了PD 治疗,且为R0 切除,但是手术时尚未发现的微小转移灶事实上可能早已存在,在手术的创伤应激下,导致机体的微小转移灶快速增大,较早地出现肿瘤复发;本研究中LPD组术后1 年内死亡患者中大多数送检淋巴结阳性,而OPD 组却无这种现象,可能是由于LPD 术式在清扫腹腔深部淋巴结时难度较大,术中部分阳性淋巴结破损后,在气腹压的作用下导致肿瘤细胞的扩散或种植转移,术后较早地出现复发。此外,本研究随访期间两组患者整体生存率的比较虽无显著性差异,但LPD 组术后1 年生存率81.7%、术后2 年生存率76.6%、术后3 年生存率67.0%,分别高于OPD 组术后1 年生存率72.4%、术后2 年生存率61.1%、术后3 年生存率52.4%,在术后生存率方面LPD 组显示出一定的优势。如果能完全保证本研究在术前根据患者全身的综合状况入组时不存在任何的选择偏畸且术后所有存活患者的随访期都达到5 年,则该研究中的结论将会更加有说服力。
综上,LPD 术式技术难度大,极具风险和挑战性。与OPD 相比,LPD 具有同样的安全性,可达到与OPD 类似的手术疗效,而且在术后快速康复方面有一定的优势,在设备条件完善的单位,手术经验丰富和学习曲线成熟的普外科医师可逐步开展LPD。但本研究为单中心回顾性研究,随访时间不长,没有统计出术后5 年生存率,可能会影响到部分患者术后肿瘤学远期疗效的准确评估。该研究的相关结论,可能需要前瞻性、大样本、多中心的随机对照研究并保证有足够长的随访时间来提供更有说服力的高质量证据以进一步证实,这也是我们今后研究和前进的方向。
