木果楝属柠檬苦素类似物及其生物活性的研究进展
2022-05-24李韶静汤建华
李韶静,汤建华
·综 述·
木果楝属柠檬苦素类似物及其生物活性的研究进展
李韶静,汤建华*
河北北方学院附属第一医院,河北 张家口 075061
木果楝属植物中包含丰富的萜类、生物碱类、多酚类、黄酮类、甾体类等化学成分,其中具有广泛生物活性和多环体系的柠檬苦素类化合物是其最主要的次生代谢产物。柠檬苦素是一类具有独特结构的高度氧化的四降三萜类化合物,葛杜宁、andirobin、墨西哥内酯、phragmalin等多种结构类型的柠檬苦素及其类似物在木果楝属植物中普遍存在,具有抗肿瘤、抗病毒、抗氧化、镇痛、抗炎、抗焦虑、镇静、保护神经、改善睡眠等药理作用,还具有昆虫拒食、杀虫等生物活性。对2010—2021年报道的木果楝属216个柠檬苦素类化合物及其生物活性的研究进展进行综述,为丰富该类资源的新药开发提供思路。
木果楝属;柠檬苦素类似物;葛杜宁;andirobin;墨西哥内酯;phragmalin;抗肿瘤;抗病毒;拒虫
楝科木果楝属Koenig迄今发现有3种植物木果楝J.Koenig、(Lam.) M.Roem.以及(Kostel.) Mabb.,其根、种子、果实和皮均可药用,有着广泛的药用价值。3种木果楝属植物中,目前只有木果楝在中国海南岛有所分布,和则主要分布在印度中南部的2个最大的红树林沼泽地[1]。木果楝属植物特殊的生长环境,使其化学成分和生物活性广泛而特殊。这种植物的根、果实和皮均可药用,在抗菌、消炎、止血方面有较好的疗效,且其在民间有着悠久的用药历史,在东南亚和印度民间被广泛用于治疗腹泻、胸胀、霍乱及疟疾引起的发热,在中国海南民间其种皮被用于治疗赤痢,种仁用作滋补品[2-5]。近年来,研究发现木果楝还具有抗肿瘤、抗抑郁等新型生物活性。木果楝属植物中化学成分种类也很丰富,包括萜类、生物碱类、多酚类、黄酮类、甾体类等[6]。柠檬苦素又名黄柏内酯、吴茱萸内酯,具有中等极性,不溶于水,可溶于有机溶剂,如醇类和酮类[7]。在芸香科、楝科、苦木科和叶柄花科等植物中均有分布,但在楝科植物中具有特别丰富的结构多样性,仅从楝科植物中分离得到的柠檬苦素就有1000多个,从木果楝属植物的不同部位分离得到的柠檬苦素多达300多个,主要分布在其种子和果实中。
在完整三萜(一般C30)基础上,降4个碳的三萜即四降三萜(一般C26),柠檬苦素是一类具有独特结构的高度氧化的四降三萜类化合物。其母核碳骨架一般由A、B、C、D 4个环系组成,由大戟烷、甘遂烷等生源前体的17位侧链降掉4个碳,大都形成特征性的呋喃环,从而形成了含有4,4,8-trimethyl-17-呋喃甾体的基本骨架结构,而A、B、C、D环会通过各种各样的裂环、环氧化、重排、迁移从而形成多种多样的具有高生物活性的柠檬苦素[8]。葛杜宁是从木果楝属分离得到的第1个柠檬苦素类化合物[9]。azadirone、葛杜宁、andirobin、墨西哥内酯、phragmalin、khayanolide、含氮衍生物、生物合成前体等多种结构类型的柠檬苦素及其类似物在木果楝属植物中普遍存在,其中具有C1--C29氧桥连接的墨西哥内酯和具有Δ8,14或Δ8,9和Δ14,15共轭双键以及C30羰基的phragmalin是木果楝属植物中主要分布的柠檬苦素类似物。各种类型柠檬苦素类似物的化学结构见图1,取代基见图2,柠檬苦素类似物具有抗肿瘤、抗病毒、抗氧化、镇痛、抗炎、抗焦虑、镇静等药理作用,还具有昆虫拒食、杀虫等生物活性[10]。国内外对柠檬苦素及其类似物的生物活性进行大量研究,发现其不仅具有很高的药用价值,在食品和农业也大有开发前景。基于2010年之前木果楝属柠檬苦素的报道[1],本文对2010—2021年报道的木果楝属216个柠檬苦素类化合物(表1)及其生物活性进行综述,以加强柠檬苦素类化合物的研究,丰富该类资源的新药开发思路。
1 环系完整的柠檬苦素类似物
1.1 azadirone型柠檬苦素类似物
azadirone型柠檬苦素具有特征性的的C3-氧代-Δ1,2双键和C7氧合结构。2015年,Wu等[10]从木果楝种子中分离出1种新的azadirone型柠檬苦素类似物,命名为7-hydroxy-21β-methoxy-3-oxo-24,25, 26,27-tetranortirucalla-1,14-diene-23(21)-lactone(1)。2018年,Zhang等[11]从的种子中分离得到xylomolin M(2)。2020年,Zhang等[12]从木果楝的枝叶中分离得到3种类似物hainanxylogranins V、W、X(3~5)。
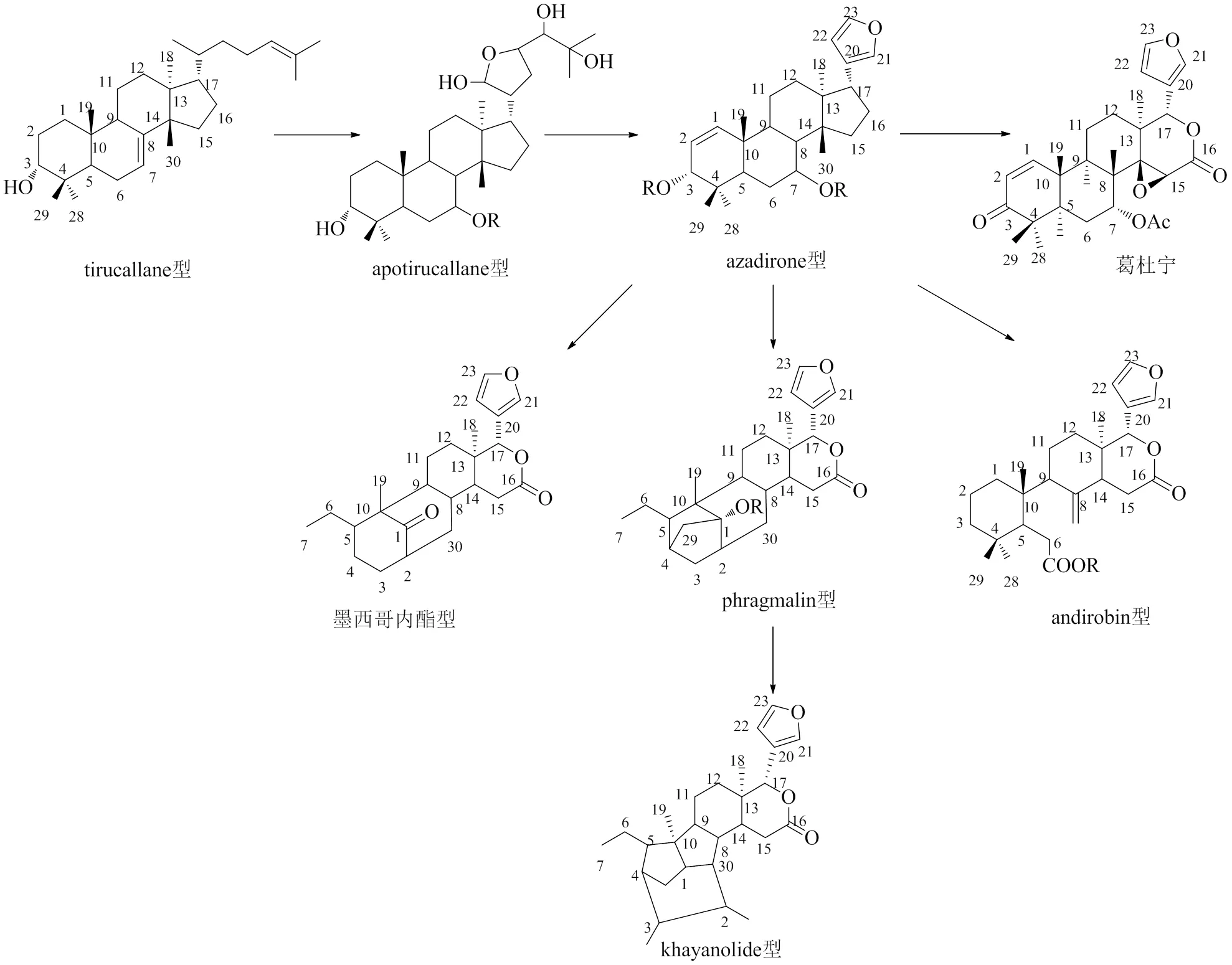
图1 柠檬苦素类化合物的主要骨架结构
Fig.1 Main skeleton structures of limonoids
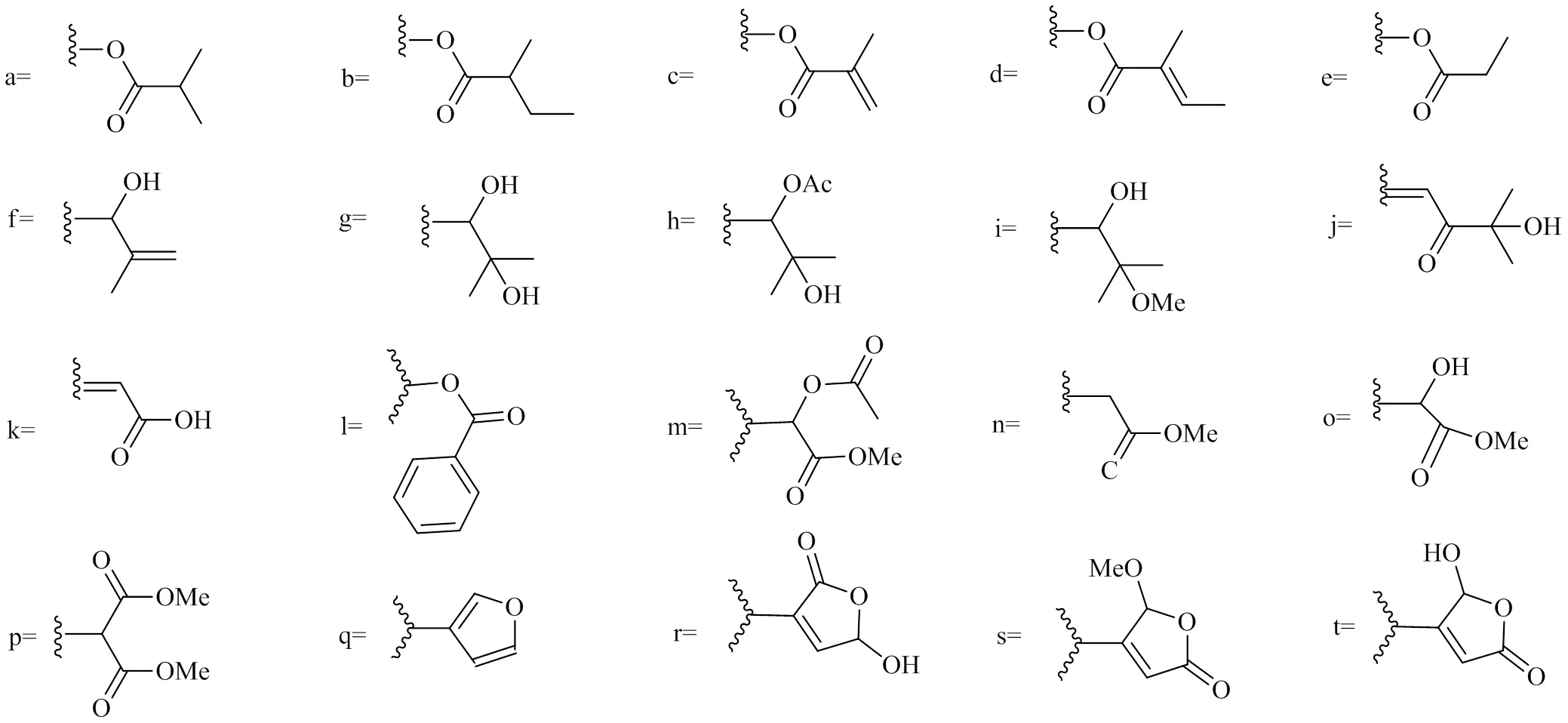
图2 柠檬苦素类化合物的取代基
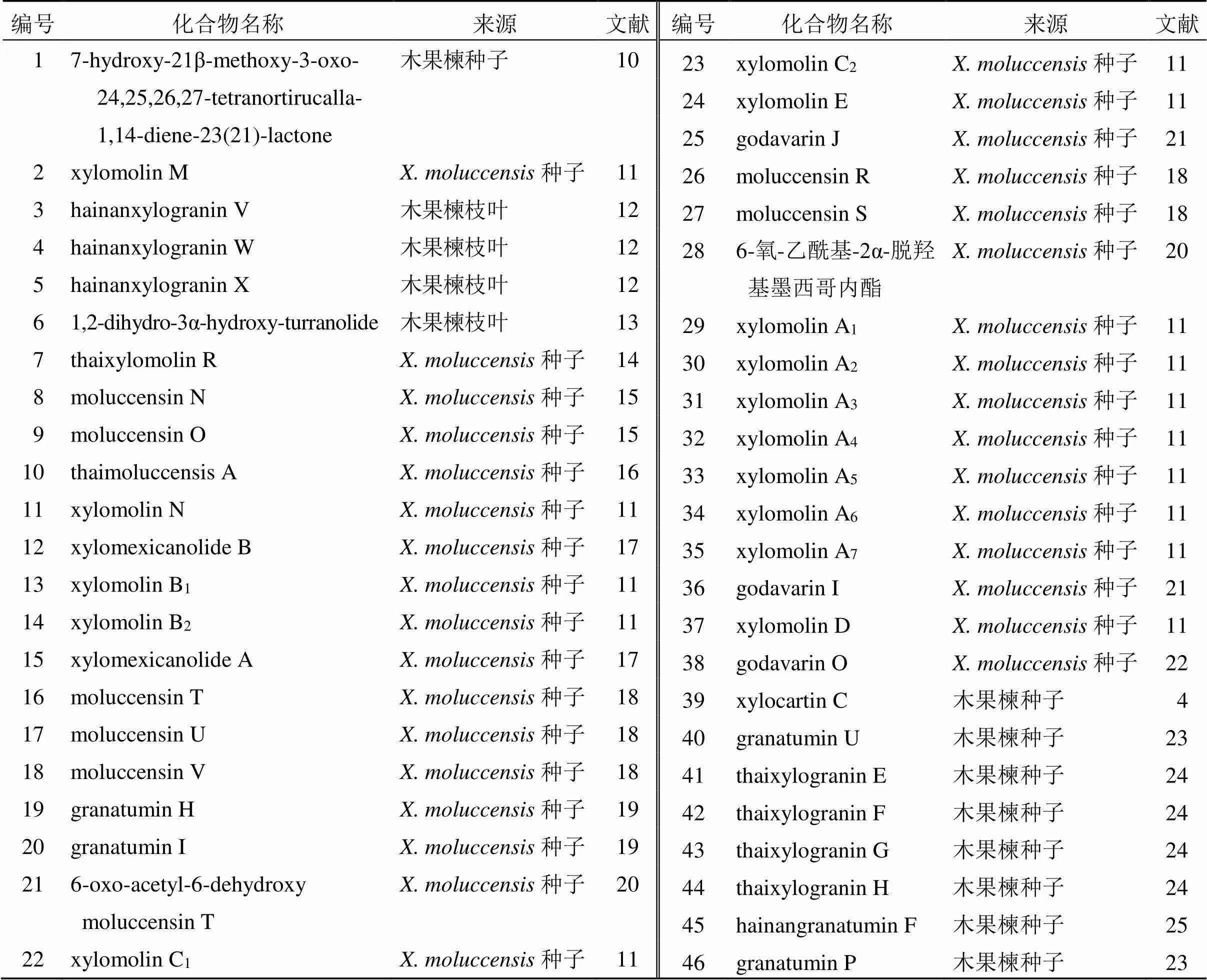
表1 木果楝属的柠檬苦素类化合物
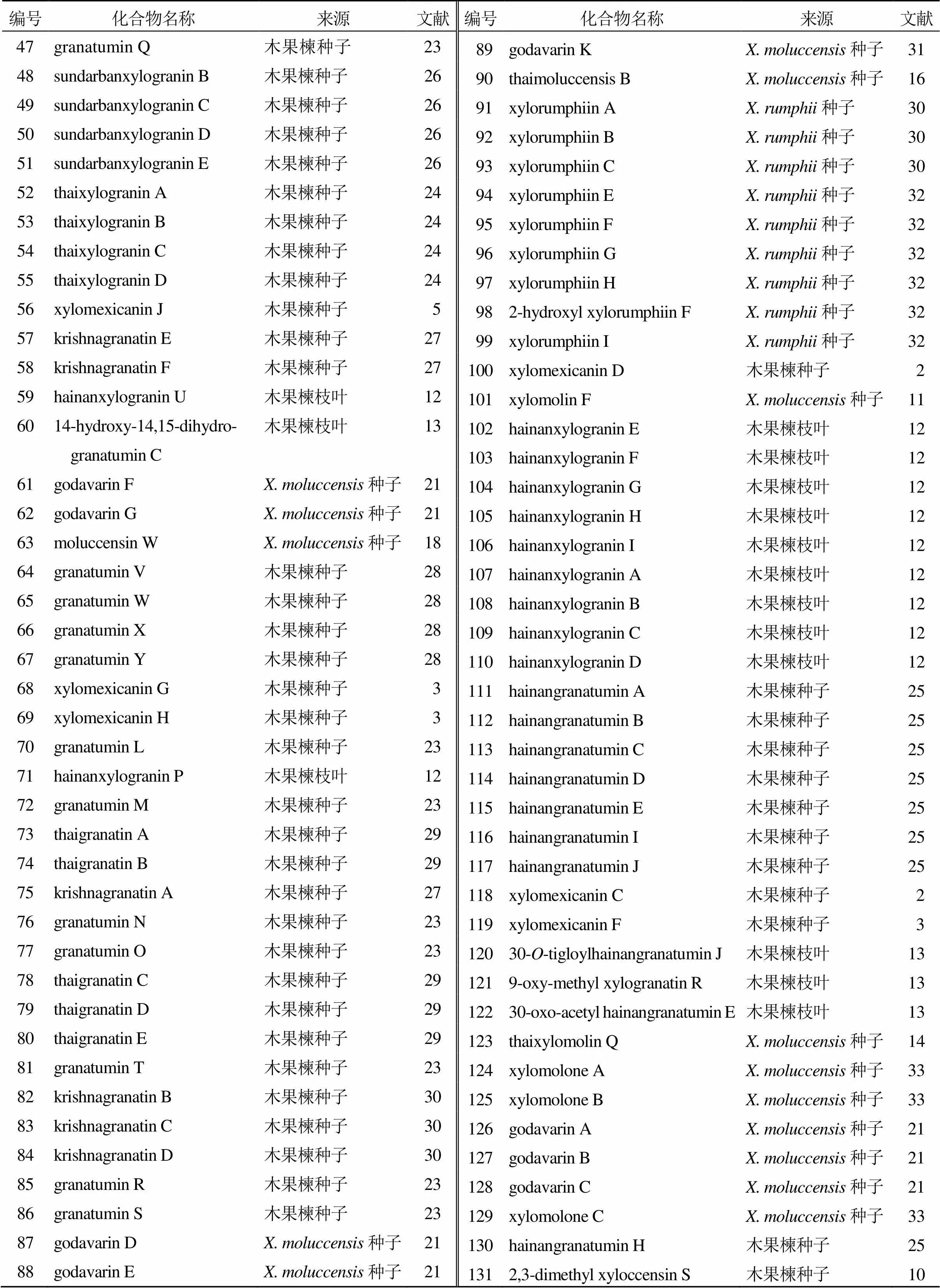
续表1
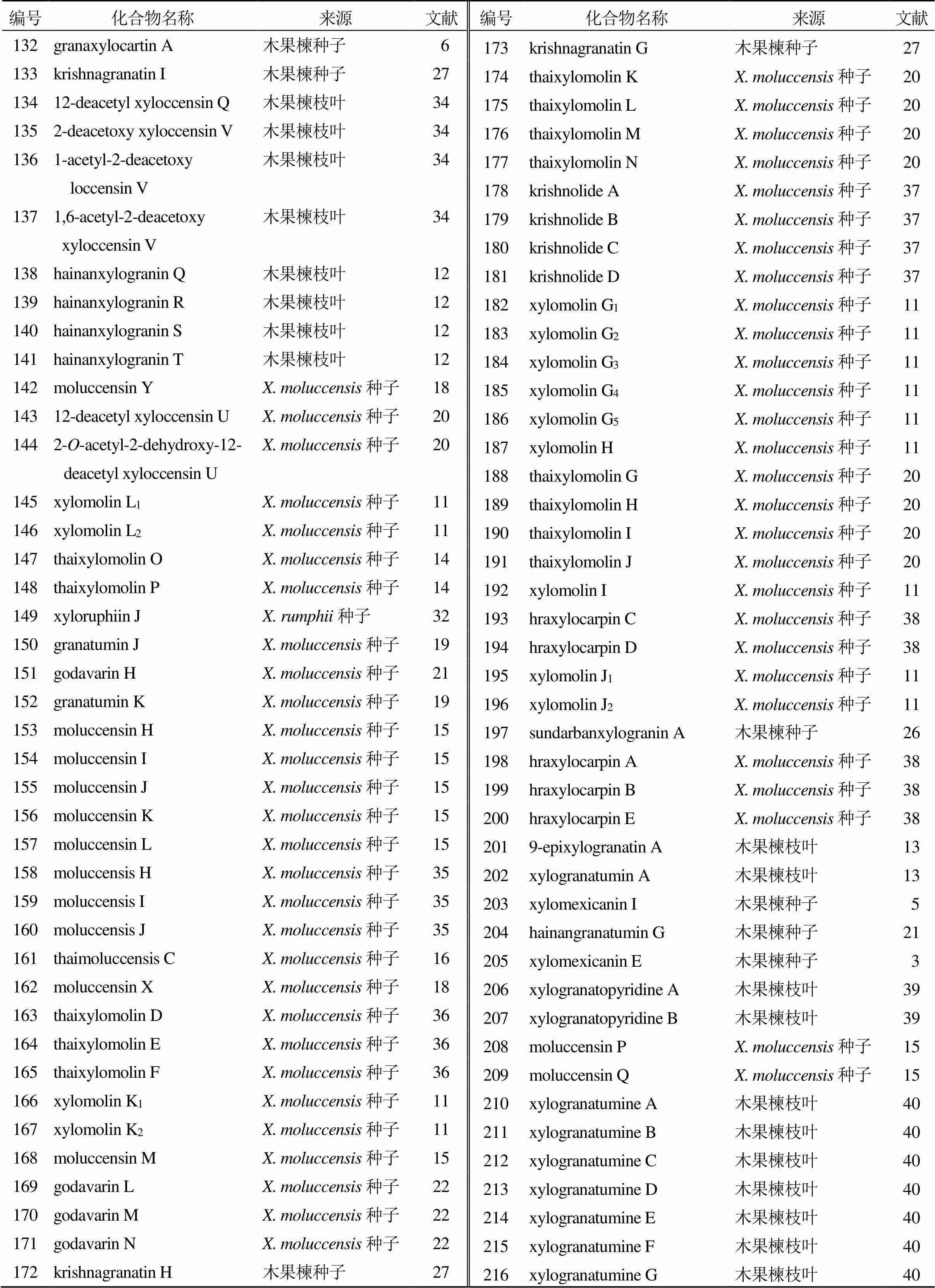
续表1
1.2 其他环系完整的柠檬苦素类似物
2016年,Zhou等[13]从木果楝的枝叶中分离出化合物1,2-dihydro-3α-hydroxy-turranolide(6),为1种新的环系完整的柠檬苦素类似物。
化合物1~6的化学结构见图3。
2 环系不完整的柠檬苦素类似物
2.1 环B-seco型柠檬苦素类似物
2016年,Dai等[14]从种子中得到1种化合物,命名为thaixylomolin R(7)。这个化合物是被发现的第1个具有6-氧杂双环[3.2.1]辛-3-酮基的seco-mahoganin型柠檬苦素类似物。
2.2 环B, D-seco型(andirobin型)柠檬苦素类似物
共有4种新的andirobin型类柠檬苦素从种子中分离鉴定出来,分别命名为moluccensin N(8)[15]、moluccensin O(9)[15]、thaimoluccensis A(10)[16]、xylomolin N(11)[11]。其中化合物8、9、11还具有C1-C14氧桥连接结构。
化合物7~11的化学结构见图4。
3 结构重排型柠檬苦素类似物
3.1 墨西哥内酯型柠檬苦素类似物
有27种墨西哥内酯型柠檬苦素类似物(12~38)从种子中分离鉴定出来[11,17-23],化合物39从木果楝种子中分离鉴定出来,命名为xylocartin C,在C28位具有羟基取代基[4]。从木果楝种子中分离鉴定出来11种具有罕见的9-氧杂-三环-[3.3.2.1]十一烷-2-烯结构基团的柠檬苦素类似物(40~50)[23-27];有14种同时具有C8-C30环氧环和C1-C29氧桥连接结构的柠檬苦素类似物(51~64)从木果楝及种子、枝叶等部位中分离鉴定出来[5,12,13,18,21,24,27-29]。化合物65~71具有C8-C30环氧环,从木果楝的种子、枝叶中分离鉴定出来[3,23,29,34];化合物72~97具有C1-C29氧桥连接结构[16,21,23,28,30-33];化合物98~106具有C1-C8半缩酮结构[2,11,33,34];化合物107~110具有C3-C8半缩酮结构[34]。
有15个具有C9-C10-开环结构的墨西哥内酯型柠檬苦素类似物(111~117)[25];其中化合物118~121具有罕见的C9-C30连接结构,同时具有Δ14,15双键。化合物115、120具有Δ2-3双键;化合物123同时具有Δ8-9和Δ14-15双键,还具有独特的环己烷-1,3-二酮结构,C5位的氢和C19位的甲基取代还是不寻常的反式构象。
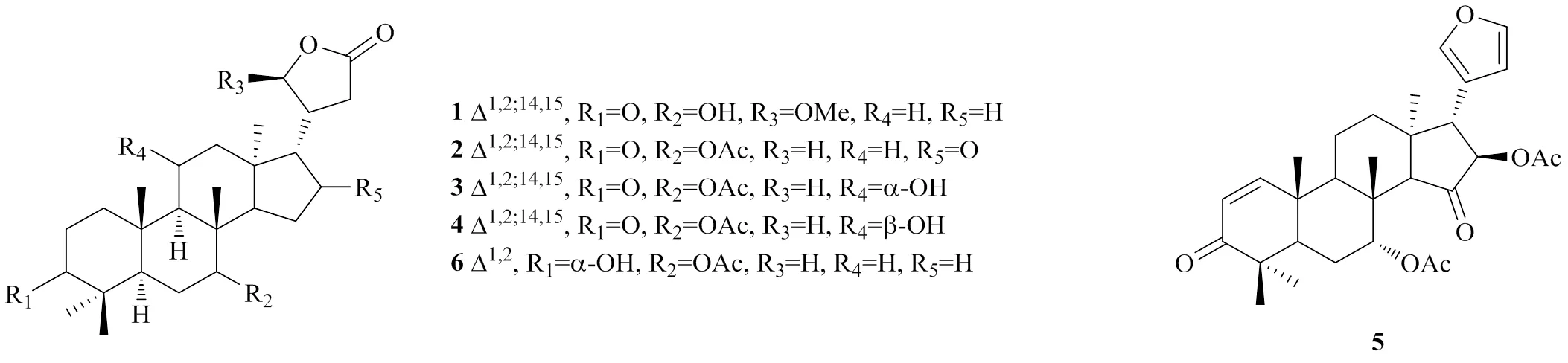
图3 化合物1~6的化学结构
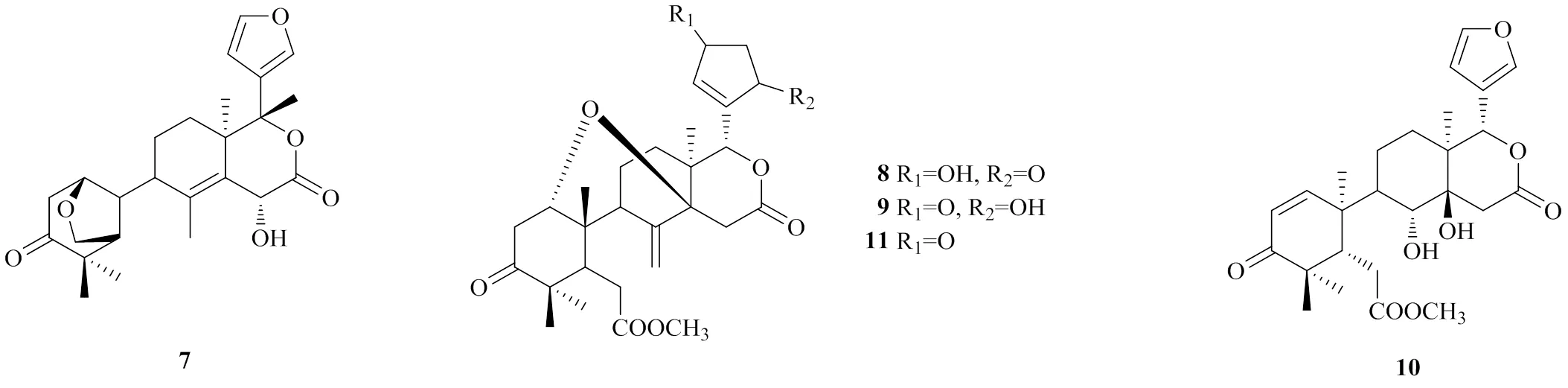
图4 化合物7~11的化学结构
有3个具有C7-C28-内酯环的墨西哥内酯型柠檬苦素类似物(126~128)从种子中分离鉴定出来[21],这3个化合物是第1次在木果楝属中报道的具有类似结构的衍生物,它们还同时具有Δ8,30双键。有1个具有C1-C2-开环结构的柠檬苦素类似物从种子中分离鉴定出来,命名为xylomolone C(129)[33]。
墨西哥内酯型柠檬苦素类似物的化学结构见图5。
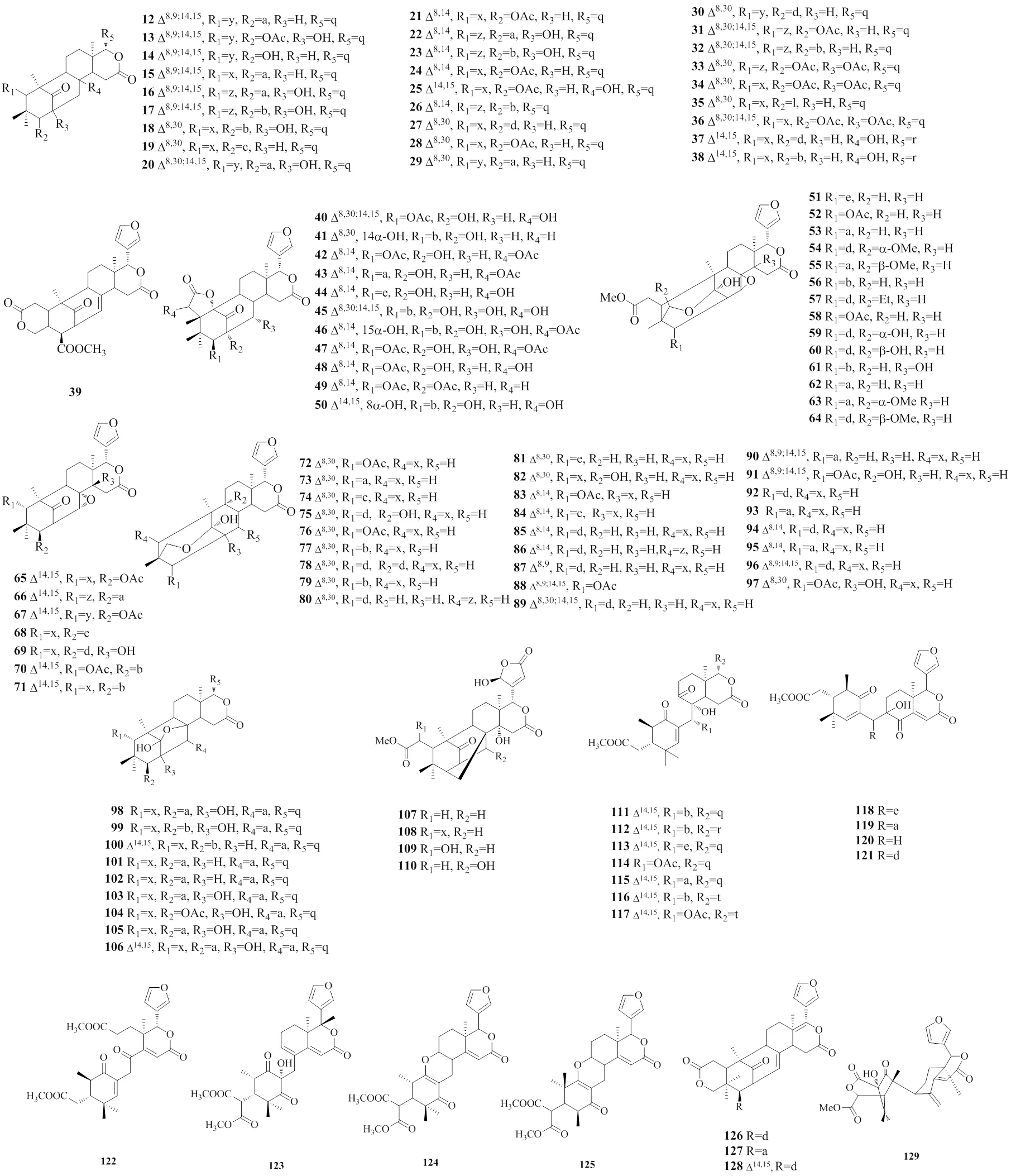
图5 化合物12~129的化学结构
3.2 Phragmalin型柠檬苦素类似物
3.2.1 Phragmalin-原酸酯亚型 2010—2020年,有4个原酸酯亚型的柠檬苦素类似物(130~133)从木果楝种子中分离鉴定出来[6,10,25,27];有8个原酸酯亚型的柠檬苦素类似物(134~140)从木果楝枝叶中分离鉴定出来[12,34];有7个原酸酯亚型的柠檬苦素类似物(142~148)从种子中分离鉴定出来[11,14,18,20];有1个原酸酯亚型的柠檬苦素类似物(149)从种子中分离鉴定出来[32]。其中化合物131~139、142~146是8,9,30-原酸酯亚型,同时具有C14-C15双键;化合物130、140~141、149是1,8,9-原酸酯亚型;化合物147~148是8,9,12-原酸酯亚型。化合物130~149的化学结构见图6。
3.2.2 聚氧乙烯-phragmalin型 有22个新的聚氧乙烯型的柠檬苦素类似物(150~171)从种子中分离鉴定出来[11,15-19,21-22,35-36];有2个新的phragmalin型的柠檬苦素类似物(172~173)从种子中分离鉴定出来[27]。其中化合物150~151具有5个乙酰氧基的高度氧化结构,化合物151还具有Δ14,15双键;化合物152是木果楝属中发现的第1个同时具有Δ8,30及Δ14,15双键结构的聚氧乙烯型的柠檬苦素类似物;化合物153~167全都具有C30位的羰基不饱和基团,其中化合物153~161具有Δ14,15双键,化合物157~159、161、163~164具有Δ8,14双键,化合物160、162、165~167同时具有Δ8,9及Δ14,15双键结构;化合物168同时具有Δ8,14双键及C15-C30五元内酯环。化合物150~173的化学结构见图7。
3.3 khayanolides型
khayanolides型是phragmalin型柠檬苦素类似物经C1-C2裂解,C1-C30环化形成的一类化合物。分为2个亚型:(1)C2-羰基,C3-β-乙酰氧基;(2)C3-羰基,C2-β-乙酰氧基。2010—2021年,共有19个新的khayanolides型柠檬苦素类似物(174~192)从种子中分离鉴定出来[11,20,37]。其中化合物174~187属于第1种亚型,化合物188~192属于第2种亚型;化合物182~186具有Δ8,14双键,化合物187具有Δ14,15双键,化合物192同时具有Δ8,9和Δ14,15双键[11];化合物174~177以及化合物188~191是木果楝属中首次被发现报道的khayanolides型柠檬苦素类似物[20];化合物178~181在C30或C3位上具有大的含有4个或5个碳原子的酯取代基,化合物178同时还具有罕见的C8-C14环氧基[37]。化合物174~192的化学结构见图8。
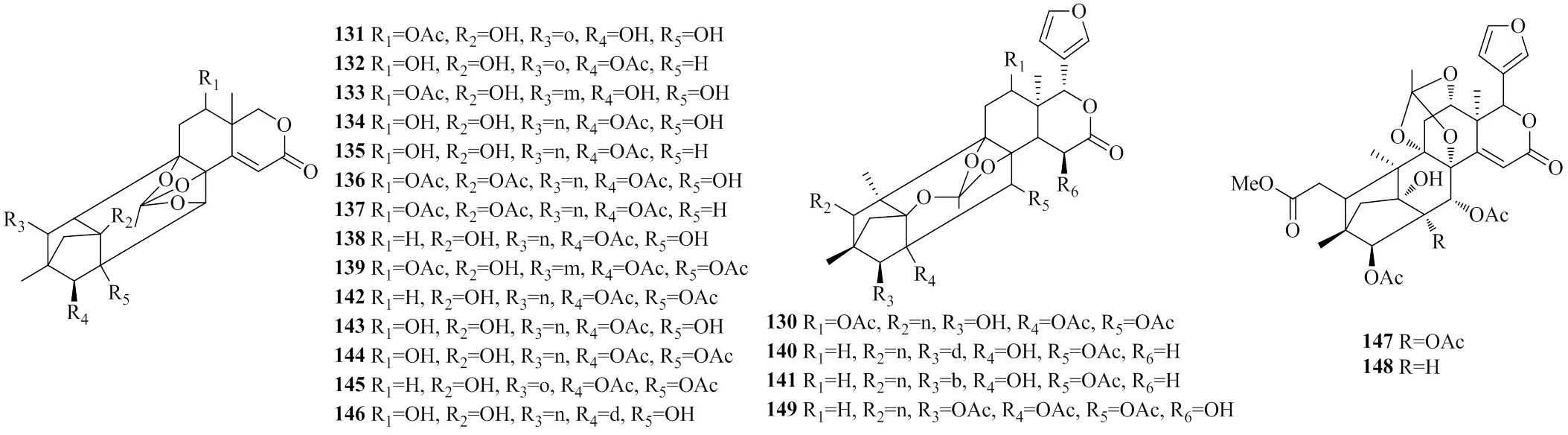
图6 化合物130~149的化学结构

图7 化合物150~173的化学结构
Fig.7 Chemical structures of compounds 150—173

图8 化合物174~192的化学结构
3.4 其他衍生物
从种子中分别分离鉴定出来4个具有罕见的()-双环[5.2.1]癸-3-烯-8-酮结构基团的化合物193~196[11,38],具有类似结构的化合物197[26]也从木果楝种子中分离鉴定出来。
从种子中分离鉴定出来2个具有罕见的9-氧杂-三环-[3.3.2.1]十一烷-2-烯结构基团的化合物(198~199)[38];同时,一个具有不寻常的三环[3.3.1.1]癸烷-9-酮结构基团的化合物200也从种子中分离鉴定出来[38]。9-epixylogranatin A(201)是从木果楝枝叶中分离鉴定出来的,同时分离出来的化合物xylogranatumin A(202)是独特的在B环中带有C1-C8氧桥连接结构的C9-C10-开环柠檬苦素类似物[13]。从木果楝种子中分离鉴定出来的化合物xylomexicanin I(203)也在B环和C环之间拥有独特的桥式结构,与其他在A环与B环之间具有桥式结构的化合物形成鲜明对比[5]。化合物193~203的化学结构见图9。
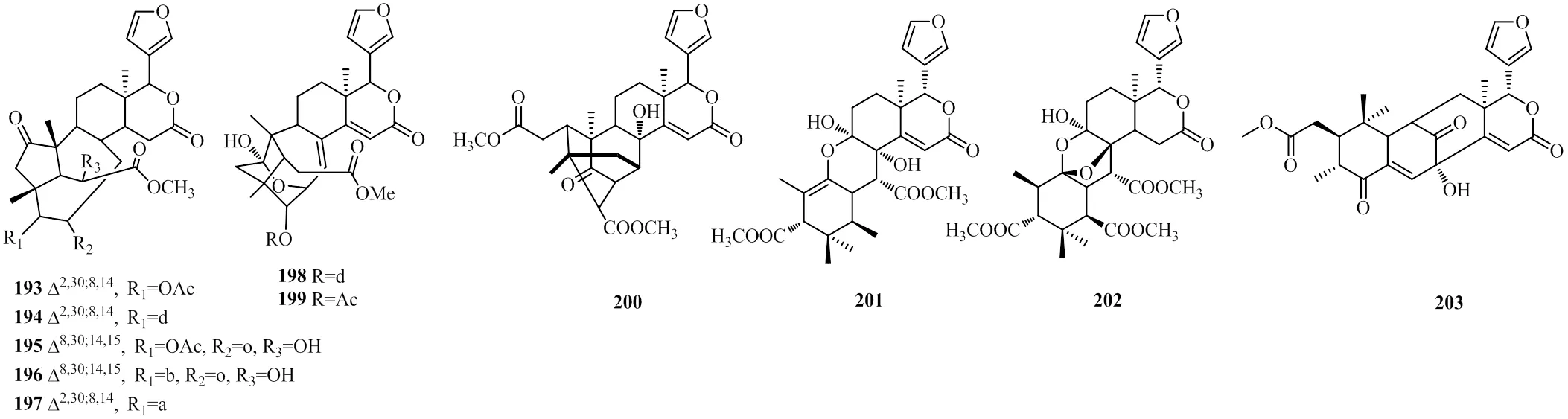
图9 化合物193~203的化学结构
4 含氮衍生物
Pan等[17]从木果楝种子中分离出1个新的具有中心吡啶环类型的化合物hainangranatumin G(204)[21]。Wu等[3]也从木果楝种子中分离出1个新的具有中心吡啶环类型的化合物xylomexicanin E(205),这是第1个被发现的在B环和C环之间有吡咯烷氮杂螺旋骨架的柠檬苦素类似物。Zhou等[39]从木果楝枝叶中分离出2个新的具有中心吡啶环类型的化合物xylogranatopyridines A、B(206、207)。化合物204~207的化学结构见图10。
5 生物合成前体
柠檬苦素类化合物的生物合成前体一般都具有euphane或tirucallane骨架结构。其中apotirucallane型生物前体的结构特点为具有Δ14,15双键;tirucallane型生物前体结构特点为为C14-C15不为双键,且C20为S型构象;euphane型生物前体结构特点为为C14-C15不为双键,且C20为R型构象。Wu等[15]从种子中分离出2个tirucallane型柠檬苦素生物前体moluccensins P、Q(208、209);Zhou等[40]从木果楝枝叶中分离出7个新的apotirucallane型柠檬苦素生物前体xylogranatumines A~G(210~216),化合物208~216的化学结构见图11。
6 生物活性
由于柠檬苦素具有丰富多样的生物活性,它在农业生产以及生物医学领域都有高度的认可和广泛的应用价值。在农业生产领域,利用生态学的方法把化学农药逐渐转变为天然产物来有效的对抗昆虫的攻击已经在全球范围内被广泛接受,许多柠檬苦素都具有昆虫拒食的活性,而且在具有强大且针对性广泛的杀虫活性的同时并不会对哺乳动物有机体产生危害,还能有效的调节昆虫生长,从而引起了研究者极大的科研兴趣;在生物医学领域,柠檬苦素具有抗肿瘤、抗病毒、抗氧化、镇痛、抗炎、抗菌、抗疟、抗焦虑、抗抑郁、保护神经改善睡眠等药理作用,使其成为国内外药物研发的重要领域和研究热点。
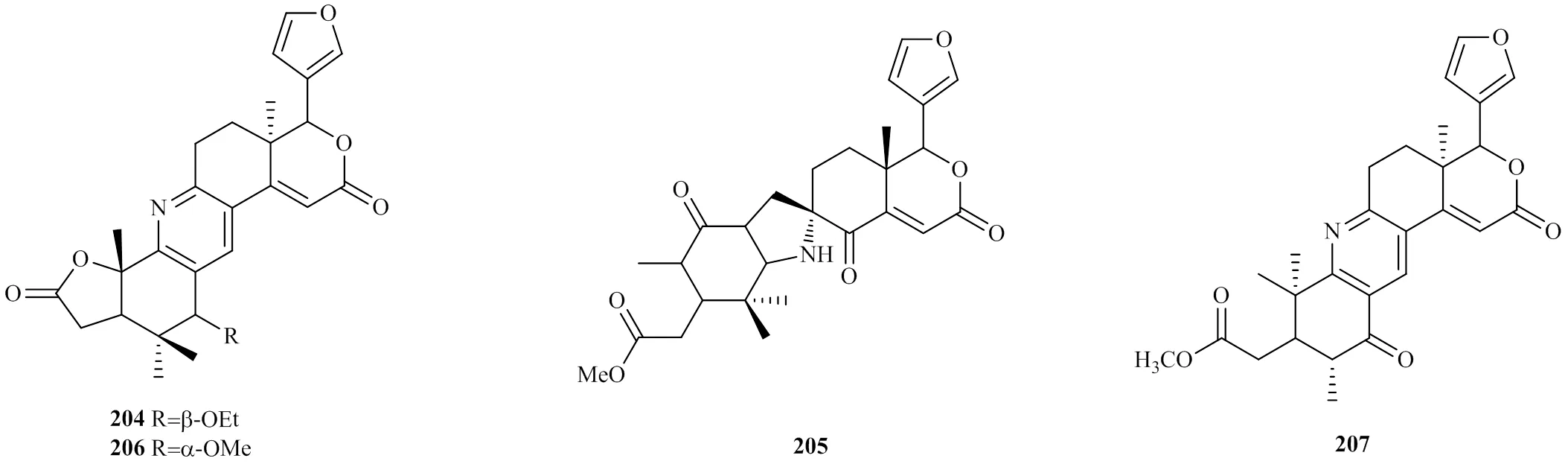
图10 化合物204~207的化学结构
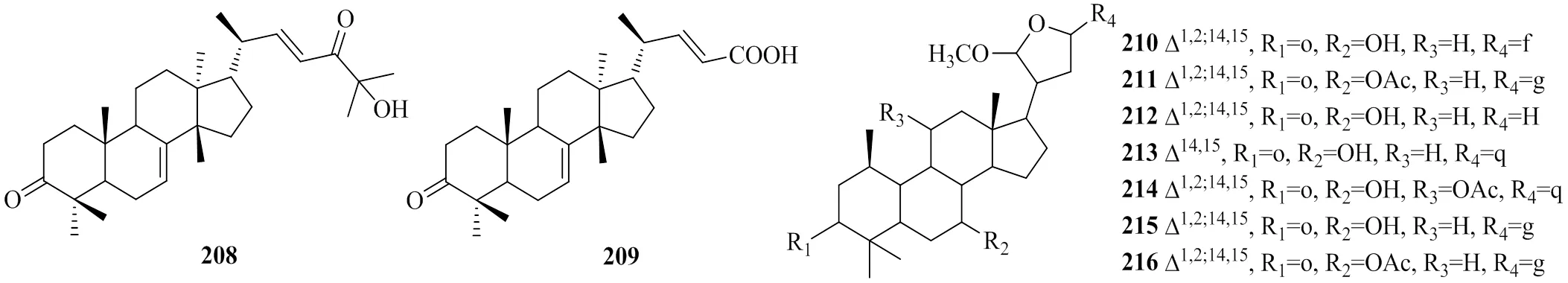
图11 化合物208~216的化学结构
6.1 抗虫
为了研发具有抗虫活性的新化合物,科研人员正逐步将兴趣转向一些对人体毒性低,易于降解,不易产生昆虫抗药性的天然抗虫剂。昆虫拒食活性是柠檬苦素类化合物最独特且普遍存在的生物活性,已经针对多种昆虫进行了广泛的研究。研究表明,多种杂类昆虫对浓度很低的印度楝子素就能表现出明显的拒食和驱避行为。研究发现柠檬苦素、诺米林、印楝素等可有效干扰幼虫生长,其还有抑制昆虫产卵的特性[41-42];研究还发现柠檬苦素类似物结构的多样性对不同种类的昆虫也具有不同程度的抗虫性,可作为蛾幼虫的拒食剂;柠檬苦素及其类似物也具有通过调节昆虫的蜕皮活动来调节昆虫生长的活性[43-44]。
6.2 抗肿瘤
研究发现,抗肿瘤药物发挥抗肿瘤活性一般都是通过控制干扰癌细胞生长发育及凋零死亡的过程。柠檬苦素及其类似物也具有抗癌活性,能够对抗多种致癌物质引发的癌症。研究表明,柠檬苦素和诺米林等都具有明显的抗癌活性,这暗示了柠檬苦素结构中的某些核心基团发挥着重要的抗肿瘤作用,后经研究发现完整的D环是柠檬苦素发挥抗癌作用必不可少的因素,且改造A环可能会导致柠檬苦素活性降低甚至丧失,而修饰B环则会显著提高其抗癌活性。柠檬苦素及其类似物相关的抗癌机制也是许多科研人员致力的研究方向,研究表明,柠檬苦素和诺米林可诱导激发大鼠肝脏和小肠中的谷胱甘肽-转移酶的活性来发挥抗癌作用[45];Priyadarsini等[46]发现印楝素及其类似物可通过抑制调节外源代谢酶、损伤DNA等途径来防止仓鼠颊囊癌发生。研究发现,印楝素及其类似物可以通过抑制细胞增殖并诱导细胞凋亡来治疗口腔肿瘤[47];Patil等[48]证实了柠檬苦素类似物可以通过诱导抑癌基因、的表达而实现诱导胰腺癌细胞凋亡。研究表明柠檬苦素能够逆转化疗药物的耐药性,抑制表达P糖蛋白,改善化疗疗效[49];Murthy等[50]提出了柠檬苦素及其糖苷化合物诱导结肠腺癌细胞内源性凋亡的2种潜在机制,一方面通过介导B细胞淋巴瘤-2基因家族蛋白和细胞色素导致细胞凋亡,另一方面通过增加细胞内Ca2+的浓度来促进癌细胞的死亡;Kim等[51]研究发现柠檬苦素及其类似物可能通过激活胱天蛋白酶和抗芳香酶的特性来抑制人乳腺癌细胞的增殖。Das等[52]通过研究发现柠檬苦素能够抑制Wnt/β连环蛋白通路,进而增强糖原合酶激酶3β的磷酸化状态,从而诱导人脑膜瘤细胞凋亡,具有作为治疗恶性脑膜瘤的潜力。研究发现化合物葛杜宁能够通过介导氧化应激反应来抑制卵巢癌细胞的增殖[53]。Jing等[54]发现xylogranatin C能够强烈抑制食管癌Eca109细胞的增殖,其抑制作用与众所周知的化疗药物顺铂相当,可用来治疗食管癌。这些研究从多个抑制肿瘤细胞增长或诱导肿瘤细胞凋亡的途径来广泛深入地探讨了各种抗癌的可能机制,这些抗癌诱导机制也是相互影响、相互作用,为柠檬苦素及其类似物发挥深入复杂的抗肿瘤作用提供了理论研究思路。
6.3 抗病毒
研究表明,很多三萜类化合物都具有抗病毒的活性,如抗抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)病毒。Battinelli等[55]研究发现,柠檬苦素和诺米林可以产生呈现一定量效关系的药效作用来抑制HIV-1细胞的逆转录复制,并且可以在被HIV病毒感染的宿主细胞中继续发挥疗效,其机制可能与抑制HIV-1蛋白酶活性相关。Chansriniyom等[56]研究表明2~10 ng/kg柠檬苦素能有效抑制孢疹病毒的活性。研究发现3.5~8.5 ng/kg柠檬苦素就能够对受感染细胞中的人嗜T-淋巴病毒1型逆转录酶的表达产生抑制作用[57];Yan等[58]通过一系列研究发现,C17位上的呋喃环是柠檬苦素类化合物发挥抗病毒活性的核心基团,进一步研究其构效关系表明C1、C2位的双键基团也对发挥药效至关重要,且若把C14-C15位的氧桥环替换为碳碳双键,会增强其抗病毒活性。柠檬苦素及其类似物的抗病毒活性还有待进一步研究以更深入系统地来阐述其相关机制。
6.4 抗炎和镇痛
早在20世纪90年代末,国外就有关于柠檬苦素有良好抗炎、镇痛活性的相关报道,并且提出其镇痛机制可能与抑制相关炎症反应有关[59-60];相关研究在国内也陆续报道,研究人员通过观察发现,从柑橘果实中提取的柠檬苦素能显著提高小鼠的痛阈,降低其在福尔马林实验中的疼痛效果,明显减少扭体次数,能显著抑制二甲苯导致的小鼠的类似耳廓和足肿胀的炎症症状[61];关于柠檬苦素及其类似物抗炎镇痛的相关机制也有进展,Kim等[62]提出柠檬苦素可能是通过抑制CD4+T细胞的增殖和白细胞介素-2的产生,从而进一步调节炎症反应;研究还发现,柠檬苦素通过抑制人主动脉平滑肌细胞p38丝裂原活化蛋白激酶的活性,从而参与炎症反应,产生镇痛抗炎作用,并由分析结果推测,诺米林中存在的具有乙酰氧基的七元A环似乎对其抑制p38丝裂原活化蛋白激酶的活性至关重要[63]。Yang等[64]通过研究测定一系列柠檬苦素肟醚衍生物的抗炎、镇痛活性,并研究其构效关系表明,C14-C15位的氧桥是化合物发挥镇痛、抗炎作用的必需基团,若替换为双键,则会降低其相关活性,且C7位肟醚化引入叔胺基团能显著提高化合物的抗炎镇痛活性。研究发现,F018(果实的醋酸乙酯提取物,主要包括化合物xyloccensins A、E、X、Y)可影响树突状细胞和Th17细胞的活化,以及成纤维样滑膜细胞的增殖,该项研究表明F018可能是关节炎的潜在治疗药物[65]。
6.5 抗氧化
采用天然抗氧化剂代替化学合成氧化剂有很多好处,如不良反应少、营养保健、可持续获得等,虽然其抗氧化作用相比起来较弱,但是能够有效地改变氧化反应过程,研究开发天然抗氧化剂已经成为趋势。一些天然产物可以通过发挥抗氧化作用从而干扰和清除一些与肿瘤相关的自由基,其中有些物质的抗氧化能力甚至超过了抗坏血酸。因此,国内外很多学者都致力于研究开发柠檬苦素及其类似物的抗氧化活性。Anh等[66]通过对柑橘中提取出的多种柠檬苦素类似物进行抗氧化活性实验研究发现,在较低浓度下,对自由基的抑制作用不大,还证明了柠檬苦素能够防止低密度脂蛋白的氧化。Poulose等[67]检测发现柠檬苦素能够诱导人神经母细胞瘤凋亡具有明显的清除自由基活性。研究还发现,柠檬苦素类似物糖苷通过清除超氧阴离子能够抑制细胞瘤的发生;一些高度氧化的柠檬苦素类似物,若结构中羟基较少,其抗氧化活性就会稍弱[68];研究发现与等量维生素C相比,柠檬苦素具有很高的抗氧化活性,能明显降低氧化速率[69-70]。
6.6 抗菌
Govindachari等[71]研究发现,柠檬苦素、柠檬醇、柠檬苦素酸等化合物都对花生柄锈菌有一定的抑制效果,但抑制率依次降低,说明A环或B环结构的开裂或修饰都有可能导致柠檬苦素类似物的抑真菌活性降低或丧失。研究发现,呋喃环是柠檬苦素及其类似物发挥抗菌作用的必需基团[72];Abdelgaleil等[73]对10多种柠檬苦素类似物进行了抗真菌和细菌的检测研究,发现它们都具有不同程度的抗菌活性。通过抑菌实验发现柠檬苦素对枯草芽孢菌和地衣芽孢杆菌都有一定抑制作用,且呈剂量相关性[74-75]。李赤翎等[76]研究发现,柠檬苦素类似物糖苷对常见食品中含有的微生物都有不同程度的抑制作用,对真菌也有着较好的抑制作用。Vikram等[77]研究表明柠檬苦素可能通过感应依赖菌群的机制来治疗肠出血性大肠感染,同时也证实A环对柠檬苦素类似物起到抑菌作用至关重要。卢小锋等[78]研究报道了从印楝种子中提取的柠檬苦素类似物17β-hydroxynimbocinol对大肠杆菌和表皮葡萄球菌具有一定抑制活性。虽然现在与柠檬苦素及其类似物相关的抑菌研究很多,但是关于其真正的抗菌机制还有待于进一步研究。
6.7 抗疟
疟疾作为一个全球性的公共卫生问题,虽然目前通过各种医疗手段得到了控制,但接近全球一半的人口仍然生活在可能感染疟疾的地区,在近几千年的抗疟药物研发过程中,天然药物发挥着重要的作用。早在1989年,就有研究报道了柠檬苦素类化合物葛杜宁的抗疟活性。Kayser等[79]研究了多种结构类型的柠檬苦素类似物,结果表明葛杜宁抗疟效果最好,且与传统药物氯喹联合应用能产生独特且良好的治疗效果;研究发现trichirubines A、B也具有明显的抗疟效果[80]。Lee等[81]研究发现,从白卡雅楝提取出来的一种名为anthothecol的柠檬苦素类似物对疟原虫表现出良好的抗疟活性。Lakshmi等[82]通过对柠檬苦素类似物葛杜宁和xyloccensin I进行抗疟活性测试对比,发现xyloccensin I也有明显的抑制恶性疟原虫的活性,可以作为抗疟药物来开发研究。
6.8 抗抑郁
抑郁症是现代社会的一种常见疾病,影响着全球大概21%的人群,众所周知,慢性压力是造成抑郁症最主要的因素之一。尽管抗抑郁药物已在临床使用近几十年,但其中绝大多数并没有达到理想中的疗效,通常抑郁症患者只对使用的第1种抗抑郁药物反应敏感,而且还伴随着严重的不良反应,所以针对抑郁症的药物开发研究已逐渐从传统药物转向具有抗抑郁活性的天然产物,近几年的研究表明,许多天然药物被引入抑郁症的实验模型来发挥抗抑郁作用已初显成效,并且大部分药物都没有不良反应或不良反应很小[83-87]。柠檬苦素类似物由于其独特的结构构型和丰富的生物活性也吸引了许多致力于研究抗抑郁药物的科研人员的兴趣。研究发现柠檬苦素类似物能够在抑制下丘脑-垂体-肾上腺轴、炎症以及调节有关基因的表达方面起关键性抗抑郁作用。Yin等[88]报道了一种从木果楝种子中分离出的化合物xylocarpin H在抑郁症小鼠行为模型中具有抗抑郁样活性,突出了对抑郁症的潜在神经保护作用。最近Gao等[89]发现同样来源于木果楝的化合物cipadesin A在抑郁症小鼠的尾部悬吊试验(TST)和强迫游泳试验(FST)中均产生显著的抗抑郁作用,并且其抗抑郁活性与经典抗抑郁药文拉法辛相当,可有效降低由于抑郁所导致的体内皮质酮,皮质醇等糖皮质激素有所升高的水平,同时他们还阐明了其抗抑郁的潜在机制可能是通过调节相关基因的活性,调节下丘脑-垂体-肾上腺轴轴的体内平衡以增强小鼠对抗压力的能力。
6.9 调节神经系统
早期研究表明,柠檬苦素及其类似物可以延长由麻醉剂引起的小鼠睡眠时间,具有明显的镇静作用,并且抗焦虑作用甚至与地西泮相当。研究表明,柠檬苦素类似物可以通过降低氧化应激反应或恢复线粒体膜电位的途径减弱由过量的谷氨酸盐导致的神经功能障碍或神经细胞死亡等神经毒性,此外,研究还发现如果提前给予柠檬苦素干预,会通过加强保护神经蛋白而发挥更有效的治疗作用[90-92];国内学者研究发现,柠檬苦素类似物能够延缓因细胞衰老而导致的机体损伤,从而改善认知学习能力下降、记忆力退化等功能障碍[93];总之,这些化合物可能是开发预防及治疗神经退行性疾病(如阿尔茨海默病和帕金森病)的植物源性保健品及新药的良好候选药物。
6.10 其他
早期在对患高胆固醇兔子进行代谢情况监测时发现,柠檬苦素能直接明显降低胆固醇[94],另一项研究发现柠檬苦素能明显降低肝细胞中的载脂蛋白B值,反映出柠檬苦素类化合物对血脂有一定的调节作用[95]。Mahmoud等[96]研究报道,柠檬苦素能通过降低氧化应激水平来保护肝细胞变性坏死从而起到保护肝脏缺血再灌注引起的损伤的疗效,近期研究还发现,提前给予柠檬苦素干预可以减轻大鼠肝脏缺血再灌注后的肝细胞损伤,从而产生护肝作用[97]。研究还发现,诺米林能通过激活胆汁酸膜受体,而降低血糖从而减轻体质量,所以有望将其应用于治疗肥胖或2型糖尿病等代谢性疾病[98]。Das等[99]对xyloccensin I进行的生物活性测定证实了其具有抗糖尿病和抗氧化活性,这表明xyloccensin I在制药工业中具有广阔的前景。
7 结语
2010—2021年从木果楝属植物的不同部位分离得到的柠檬苦素及其类似物多达216个,在这些化合物中,还包含着很多化学骨架非常新颖的柠檬苦素类似物,thaixylomolin R(7)是被发现的第1个具有6-氧杂双环[3.2.1]辛-3-酮基的开环型柠檬苦素类化合物[14];thaixylomolin Q(129)不仅同时具有Δ8,9和Δ14,15双键结构,还具有独特的环己烷-1,3-二酮结构,C5位的氢和C19位的甲基取代还是不寻常的反式构象[14];godavarin A(132)、godavarin B(133)、godavarin C(134)这3个化合物是第1次在木果楝属中报道的具有类似结构的墨西哥内酯型衍生物,它们还同时具有Δ8,30双键结构[22];granatumin K(158)是木果楝属中发现的第1个同时具有Δ8,30及Δ14,15双键结构的phragmalin型柠檬苦素类似物[34];共有19个新khayanolides柠檬苦素类似物从种子中分离鉴定出来,其中thaixylomolins G~I(194~196)是在木果楝属中首次被发现报道的khayanolides类化合物[18];hraxylocarpin C(199)、hraxylocarpin D(200)、xylomolin J1(201)、xylomolin J2(202)具有罕见的()-双环[5.2.1]癸-3-烯-8-酮结构基团[11,38];granatumin U(40)具有罕见的9-氧杂-三环-[3.3.2.1]十一烷-2-烯结构基团[25];hraxylocarpin E(206)具有不寻常的三环[3.3.1.1]癸烷-9-酮结构基团[38];xylogranatumin A(208)是具有前所未有的在B环中带有C1-C8氧桥连接结构的C9-C10-开环型柠檬苦素类似物[13];xylomexicanin I(209)也在B环和C环之间拥有独特的桥式结构[5];xylomexicanin E(211)是第1个被发现的在B环和C环之间有吡咯烷氮杂螺旋骨架的柠檬苦素类似物[3];还有2种新的具有中心吡啶环类型的xylogranatopyridines A、B(212、213)被发现,其中化合物213的A、B环重排形成了前所未有的结构[39]。
本文中列出的新的柠檬苦素及其类似物中也有一些具有显著的生物活性。moluccensins H、I(159、160)对长臂果蝇的第5龄幼虫显示出适度的杀虫活性[15]。thaixylomolin P(154)对人体卵巢A2780细胞和其T细胞具有抗肿瘤活性[14];thaixylogranins A~H(41~44、52~55),xylomolin J2(201)分别被发现具有抗人体乳腺癌细胞的活性[11,20]。xylomexicanolide B(12)对人葡萄球菌和粪肠球菌表现出较弱的抗菌活性[16];2-羟基xylorumphiins F、I(97、98)显示出对由脂多糖活化巨噬细胞而产生的一氧化氮具有中等抑制活性,说明它们具有一定的抗炎活性[29];3种khayanolide类化合物thaixylomolins I、K、M(196、180、182),都表现出适度的抗H1N1活性。其中thaixylomolin I显示出比利巴韦林更强的抑制活性[18];krishnolide A(184)呈现中等程度的抗HIV活性,这是有关khayanolide类化合物抗HIV活性的首次报道[37]。xylogranatopyridine A(212)表现出对蛋白酪氨酸磷酸酶-1B(protein tyrosine phosphatase-1B,PTP-1B)具有显著抑制活性,这是有关柠檬苦素类似物对PTP-1B抑制活性的首次报道,为以PTP-1B作为抗2型糖尿病和肥胖症的新靶点提供了新的思路[39]。
柠檬苦素类似物主要分布在木果楝属3种植物的种子和枝叶中,其中有105个柠檬苦素类似物是从种子中分离出来的,有63个柠檬苦素类似物是从木果楝种子中分离出来的,有10个是从种子中分离出来的,有44个柠檬苦素类似物是从木果楝枝叶中分离出来的。由此可见,种子中包含很多柠檬苦素类化合物。随着柠檬苦素及其类似物化学结构的确定以及生物活性的发现,人们对这类天然产物的医疗和商业需求日益增加,目前国内外也已经开展了许多针对此类化合物的提纯分离和药理作用研究,通过对木果楝属红树植物的累积调查发现它们产生结构多样的新型柠檬苦素类似物的能力相似,且环境因素起主导作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Tan Q G, Luo X D.Meliaceous limonoids: Chemistry and biological activities [J]., 2011, 111(11): 7437-7522.
[2] Wu Y B, Ni Z Y, Huo C H,.Xylomexicanins C and D, new mexicanolide-type limonoids from[J]., 2013, 77(4): 736-740.
[3] Wu Y B, Qing X, Huo C H,.Xylomexicanins E-H, new limonoids from[J]., 2014, 70(30): 4557-4562.
[4] Wu Y B, Bai Y, Guo X H,.A new limonoid from[J]., 2014, 50(2): 314-316.
[5] Wu Y B, Wang Y Z, Ni Z Y,.Xylomexicanins I and J: Limonoids with unusual B/C rings from[J]., 2017, 80(9): 2547-2550.
[6] Wu Y B, Wang L L, Wei X,.Granaxylocartin A, new limonoid from the seeds of[J]., 2017, 53(5): 901-903.
[7] Wu J, Xiao Q, Xu J,.Natural products from true mangrove flora: Source, chemistry and bioactivities [J]., 2008, 25(5): 955-981.
[8] Shen L R, Guo D, Yu Y M,.Chemical constituents of plants from the genus[J]., 2009, 6(9): 1293-1308.
[9] Akisanya A, Bevan C W L, Halsall T G,.West african timbers.Part IV.Some reactions of gedunin [J]., 1961: 3705-3705.
[10] Wu Y B, Liu D, Liu P Y,.New limonoids from the seeds of[J]., 2015, 98(5): 691-698.
[11] Zhang J Z, Li W S, Dai Y G,.Twenty-nine new limonoids with skeletal diversity from the mangrove plant,[J]., 2018, 16(1): 38.
[12] Zhang J C, Liao Q, Shen L,.Twenty-five limonoids from the Hainan mangrove,[J]., 2020, 100: 103903.
[13] Zhou Z F, Kurtán T, Mándi A,.Novel and neuroprotective tetranortriterpenoids from Chinese mangroveKoenig [J]., 2016, 6: 33908.
[14] Dai Y G, Li W S, Pedpradab P,.Thaixylomolins O-R: Four new limonoids from the Trang mangrove,[J]., 2016, 6(89): 85978-85984.
[15] Wu J, Yang S X, Li M Y,.Limonoids and tirucallane derivatives from the seeds of a Krishna mangrove,[J]., 2010, 73(4): 644-649.
[16] Zhang J, Yang S X, Yang X B,.Mexicanolides from the seeds of a Krishna mangrove,[J]., 2010, 58(4): 552-555.
[17] Pan J Y, Chen S L, Li M Y,.Limonoids from the seeds of a Hainan mangrove,[J]., 2010, 73(10): 1672-1679.
[18] Li W S, Jiang Z P, Shen L,.Antiviral limonoids including khayanolides from the trang mangrove plant[J]., 2015, 78(7): 1570-1578.
[19] Dai Y G, Wu J, Padmakumar K P,.Sundarbanxylogranins A-E, five new limonoids from the Sundarban Mangrove,[J]., 2017, 122: 85-89.
[20] Liao M H, Pedpradab P, Wu J.Thaixylogranins A-H: Eight new limonoids from the Thai mangrove,[J]., 2017, 19: 126-131.
[21] Liu R X, Liao Q, Shen L,.Krishnagranatins A-I: New limonoids from the mangrove,, and NF-κB inhibitory activity [J]., 2018, 131: 96-104.
[22] Li J, Li M Y, Feng G,.Limonoids from the seeds of a Godavari mangrove,[J]., 2010, 71(16): 1917-1924.
[23] Li J, Li M Y, Feng G,.Moluccensins R-Y, limonoids from the seeds of a mangrove,[J]., 2012, 75(7): 1277-1283.
[24] Chen W P, Shen L, Li M Y,.Absolute configurations of new limonoids from a Krishna mangrove,[J]., 2014, 94: 108-113.
[25] Li M Y, Xiao Q, Satyanandamurty T,.Limonoids with an oxygen bridge between C(1) and C(29) from the seeds of a Krishna mangrove,[J]., 2014, 11(2): 262-275.
[26] Ren J L, Zou X P, Li W S,.Limonoids containing a C1--C29moiety: Isolation, structural modification, and antiviral activity [J]., 2018, 16(11): 434.
[27] Li J, Li M Y, Satyanandamurty T,.Godavarin K: A new limonoid with an oxygen bridge between C(1) and C(29) from the Godavari mangrove[J]., 2011, 94(9): 1651-1656.
[28] Sarigaputi C, Nuanyai T, Teerawatananond T,.Xylorumphiins A-D, mexicanolide limonoids from the seed kernels of[J]., 2010, 73(8): 1456-1459.
[29] Sarigaputi C, Sommit D, Teerawatananond T,.Weakly anti-inflammatory limonoids from the seeds of[J]., 2014, 77(9): 2037-2043.
[30] Zhou Z F, Kong L Y, Kurtán T,.Four phragmalin orthoesters from the Chinese mangrove[J]., 2014, 80(11): 949-954.
[31] Li W S, Mándi A, Liu J J,.Xylomolones A-D from the Thai mangrove: Assignment of absolute stereostructures and unveiling a convergent strategy for limonoid biosynthesis [J]., 2019, 84(5): 2596-2606.
[32] Pudhom K, Sommit D, Nuclear P,.Moluccensins H-J, 30-ketophragmalin limonoids from[J]., 2010, 73(2): 263-266.
[33] Ravangpai W, Sommit D, Teerawatananond T,.Limonoids from seeds of Thai[J]., 2011, 21(15): 4485-4489.
[34] Chen H L, Zhang J, Li M Y,.New limonoids from the seeds of a Krishna mangrove,[J]., 2013, 10(4): 612-620.
[35] Li J, Li M Y, Xiao Q,.Thaixylomolins D-F, new limonoids from the Thai true mangrove,[J]., 2013, 6(3): 482-485.
[36] Zhang M, Shi Z, Liu J J,.New 30-ketophragmalins with anti-breast cancer activity against MDA-MB-453 cells from the Godavari mangrove,(Lam.) M.Roem [J]., 2018, 26: 143-148.
[37] Zhang Q, Satyanandamurty T, Shen L,.Krishnolides A-D: New 2-ketokhayanolides from the Krishna mangrove,[J]., 2017, 15(11): 333.
[38] Li J, Li M Y, Bruhn T,.Andhraxylocarpins A-E: Structurally intriguing limonoids from the true mangrovesand[J]., 2012, 18(45): 14342-14351.
[39] Zhou Z F, Liu H L, Zhang W,.Bioactive rearranged limonoids from the Chinese mangrovekoenig [J]., 2014, 70(37): 6444-6449.
[40] Zhou Z F, Taglialatela-Scafati O, Liu H L,.Apotirucallane protolimonoids from the Chinese mangroveKoenig [J]., 2014, 97: 192-197.
[41] Klocke J A, Kubo I.limonoid by-products as insect control agents [J]., 1982, 32(3): 299-301.
[42] Hafeez F, Akram W, Shaalan E A S.Mosquito larvicidal activity oflimonoids against[J]., 2011, 109(1): 221-229.
[43] Ruberto G, Renda A, Tringali C,.limonoids and their semisynthetic derivatives as antifeedant agents againstLarvae.A structure-activity relationship study [J]., 2002, 50(23): 6766-6774.
[44] Bilal H, Akram W, Ali-Hassan S.Larvicidal activity oflimonoids againstLarvae [J]., 2012, 6(2): 104-111.
[45] Kelly C, Jewell C, O’Brien N M.The effect of dietary supplementation with thelimonoids, limonin and nomilin on xenobiotic-metabolizing enzymes in the liver and small intestine of the rat [J]., 2003, 23(5): 681-690.
[46] Priyadarsini R V, Manikandan P, Kumar G H,.The neem limonoids azadirachtin and nimbolide inhibit hamster cheek pouch carcinogenesis by modulating xenobiotic-metabolizing enzymes, DNA damage, antioxidants, invasion and angiogenesis [J]., 2009, 43(5): 492-504.
[47] Harish K G, Vidya Priyadarsini R, Vinothini G,.The neem limonoids azadirachtin and nimbolide inhibit cell proliferation and induce apoptosis in an animal model of oral oncogenesis [J]., 2010, 28(4): 392-401.
[48] Patil J R, Jayaprakasha G K, Murthy K N C,.Characterization ofaurantifolia bioactive compounds and their inhibition of human pancreatic cancer cells through apoptosis [J]., 2010, 94(2): 108-117.
[49] El-Readi M Z, Hamdan D, Farrag N,.Inhibition of P-glycoprotein activity by limonin and other secondary metabolites fromspecies in human colon and leukaemia cell lines [J]., 2010, 626(2/3): 139-145.
[50] Murthy K N C, Jayaprakasha G K, Kumar V,.limonin and its glucoside inhibit colon adenocarcinoma cell proliferation through apoptosis [J]., 2011, 59(6): 2314-2323.
[51] Kim J, Jayaprakasha G K, Patil B S.Limonoids and their anti-proliferative and anti-aromatase properties in human breast cancer cells [J]., 2013, 4(2): 258-265.
[52] Das A, Miller R, Lee P,.A novel component from, ginger, and mushroom family exhibits antitumor activity on human meningioma cells through suppressing the Wnt/β-catenin signaling pathway [J]., 2015, 36(9): 7027-7034.
[53] Sahai R, Bhattacharjee A, Shukla V N,.Gedunin isolated from the mangrove plantexerts its anti-proliferative activity in ovarian cancer cells through G2/M-phase arrest and oxidative stress-mediated intrinsic apoptosis [J]., 2020, 25(7/8): 481-499.
[54] Jing L, Feng L, Zhou Z G,.Limonoid compounds fromand their anticancer activity against esophageal cancer cells [J]., 2020, 11(7): 1817-1826.
[55] Battinelli L, Mengoni F, Lichtner M,.Effect of limonin and nomilin on HIV-1 replication on infected human mononuclear cells [J]., 2003, 69(10): 910-913.
[56] Chansriniyom C, Ruangrungsi N, Lipipun V,.Isolation of acridone alkaloids and-[(4-monoterpenyloxy) phenylethyl]-substituted sulfur-containing propanamide derivatives fromand their anti-herpes simplex virus activity [J]., 2009, 57(11): 1246-1250.
[57] Balestrieri E, Pizzimenti F, Ferlazzo A,.Antiviral activity of seed extract fromtowards human retroviruses [J]., 2011, 19(6): 2084-2089.
[58] Yan Y, Yuan C M, Di Y T,.Limonoids fromand their anti-tobacco mosaic virus activity [J]., 2015, 107: 29-35.
[59] Matsuda H, Yoshikawa M, Iinuma M,.Antinociceptive and anti-inflammatory activities of limonin isolated from the fruits ofvar.[J]., 1998, 64(4): 339-342.
[60] Zhao W, Wolfender J L, Hostettmann K,.Antifungal alkaloids and limonoid derivatives from[J]., 1998, 47(1): 7-11.
[61] 温靖, 施英, 徐玉娟, 等.柑桔果实中柠檬苦素抗炎镇痛作用的研究 [J].食品科学, 2007, 28(11): 515-518.
[62] Kim W, Fan Y Y, Smith R,.Dietary curcumin and limonin suppress CD4+T-cell proliferation and interleukin-2 production in mice [J]., 2009, 139(5): 1042-1048.
[63] Kim J, Jayaprakasha G K, Muthuchamy M,.Structure-function relationships oflimonoids on p38 MAP kinase activity in human aortic smooth muscle cells [J]., 2011, 670(1): 44-49.
[64] Yang Y, Wang X H, Zhu Q H,.Synthesis and pharmacological evaluation of novel limonin derivatives as anti-inflammatory and analgesic agents with high water solubility [J]., 2014, 24(7): 1851-1855.
[65] Gupta P, Kumar A, Pal S,.Standardizedfruit fraction mitigates collagen-induced arthritis in mice by regulating immune response [J]., 2020, 72(4): 619-632.
[66] Anh B K, Tuan D A, Sung T V,.Isolation and structure elucidation of a new limonoid from Vietnameseseeds [J]., 2004, 42(4): 520-523.
[67] Poulose S M, Harris E D, Patil B S.limonoids induce apoptosis in human neuroblastoma cells and have radical scavenging activity [J]., 2005, 135(4): 870-877.
[68] Yu J, Wang L M, Walzem R L,.Antioxidant activity oflimonoids, flavonoids, and coumarins [J]., 2005, 53(6): 2009-2014.
[69] Sun C D, Chen K S, Chen Y,.Contents and antioxidant capacity of limonin and nomilin in different tissues offruit of four cultivars during fruit growth and maturation [J]., 2005, 93(4): 599-605.
[70] Mokbel M S, Hashinaga F.Evaluation of the antioxidant activity of extracts from buntan (Osbeck) fruit tissues [J]., 2006, 94(4): 529-534.
[71] Govindachari T R, Suresh G, Gopalakrishnan G,.Antifungal activity of some tetranortriterpenoids [J]., 2000, 71(3): 317-320.
[72] 徐任生, 赵维民.基于中药有效成分的新药研究 [J].中国天然药物, 2005, 3(6): 322-327.
[73] Abdelgaleil S A M, Hashinaga F, Nakatani M.Antifungal activity of limonoids from[J]., 2005, 61(2): 186-190.
[74] 罗水忠, 潘利华, 何建军, 等.柑橘籽中柠檬苦素的提取与抑菌性研究 [J].农产品加工: 学刊, 2006(10): 105-107.
[75] 罗水忠, 潘利华, 姜绍通.柑橘类果汁中柠檬苦素的含量及其性质研究 [J].食品研究与开发, 2008, 29(12): 4-7.
[76] 李赤翎, 俞建, 蒋雪薇, 等.柠檬苦素类似物糖苷的抗菌与抗氧化作用研究 [J].食品科技, 2008, 33(5): 154-156.
[77] Vikram A, Jesudhasan P R, Jayaprakasha G K,.Grapefruit bioactive limonoids modulate.O157: H7 TTSS and biofilm [J]., 2010, 140(2/3): 109-116.
[78] 卢小锋, 林鹏程, 訾佳辰, 等.印楝种子中柠檬苦素类成分及其抗菌活性研究 [J].中国中药杂志, 2019, 44(22): 4864-4873.
[79] Kayser O, Kiderlen A F, Croft S L.Natural products as antiparasitic drugs [J]., 2003, 90(Suppl 2): S55-S62.
[80] Krief S, Martin M T, Grellier P,.Novel antimalarial compounds isolated in a survey of self-medicative behavior of wild chimpanzees in Uganda [J]., 2004, 48(8): 3196-3199.
[81] Lee S E, Kim M R, Kim J H,.Antimalarial activity of anthothecol derived from(Meliaceae) [J]., 2008, 15(6/7): 533-535.
[82] Lakshmi V, Srivastava S, Mishra S K,.Antimalarial activity in(Koen) [J]., 2012, 26(11): 1012-1015.
[83] Al-Karawi D, Al Mamoori D A, Tayyar Y.The role of curcumin administration in patients with major depressive disorder: Mini meta-analysis of clinical trials [J]., 2016, 30(2): 175-183.
[84] Pae C U.Curcumin as an add-on to antidepressive treatment [J]., 2013, 36(6): 242-243.
[85] Sanmukhani J, Satodia V, Trivedi J,.Efficacy and safety of curcumin in major depressive disorder: A randomized controlled trial [J]., 2014, 28(4): 579-585.
[86] Zhang L, Xu T Y, Wang S,.Curcumin produces antidepressant effects via activating MAPK/ERK-dependent brain-derived neurotrophic factor expression in the amygdala of mice [J]., 2012, 235(1): 67-72.
[87] Zhu W L, Shi H S, Wei Y M,.Green tea polyphenols produce antidepressant-like effects in adult mice [J]., 2012, 65(1): 74-80.
[88] Yin X, Li X, Hao Y G,.Xylocarpin H, a limonoid of, produces antidepressant-like activities in mice [J]., 2015, 5(11): 524-532.
[89] Gao Q, Gao Y, Song H,.Cipadesin A, a bioactive ingredient of, produces antidepressant-like effects in adult mice [J]., 2016, 633: 33-39.
[90] Yoon J S, Sung S H, Kim Y C.Neuroprotective limonoids of root bark of[J]., 2008, 71(2): 208-211.
[91] Yoon J S, Yang H, Kim S H,.Limonoids fromprotect against glutamate-induced toxicity in primary cultured rat cortical cells [J]., 2010, 42(1): 9-16.
[92] Sun J B, Jiang N, Lv M Y,.Limonoids from the root bark ofangustifolius: Potent neuroprotective agents with biometal chelation and halting copper redox cycling properties [J]., 2015, 5(31): 24750-24757.
[93] 李林子, 胡文敏, 唐靓, 等.柠檬苦素对自然衰老大鼠抗氧化和学习记忆能力的影响 [J].中国食品卫生杂志, 2016, 28(1): 22-27.
[94] Kurowska E M, Borradaile N M, Spence J D,.Hypocholesterolemic effects of dietaryjuices in rabbits [J]., 2000, 20(1): 121-129.
[95] Manners G D.limonoids: Analysis, bioactivity, and biomedical prospects [J]., 2007, 55(21): 8285-8294.
[96] Mahmoud M F, Hamdan D I, Wink M,.Hepatoprotective effect of limonin, a natural limonoid from the seed ofvar., on-galactosamine-induced liver injury in rats [J]., 2014, 387(3): 251-261.
[97] Mahmoud M F, Gamal S, El-Fayoumi H M.Limonin attenuates hepatocellular injury following liver ischemia and reperfusion in rats via toll-like receptor dependent pathway [J]., 2014, 740: 676-682.
[98] Ono E, Inoue J, Hashidume T,.Anti-obesity and anti-hyperglycemic effects of the dietarylimonoid nomilin in mice fed a high-fat diet [J]., 2011, 410(3): 677-681.
[99] Das S K, Samantaray D, Sahoo S K,.Bioactivity guided isolation of antidiabetic and antioxidant compound fromJ.Koenig bark [J]., 2019, 9(5):1-9.
Research progress on limonoids inand their biological activities
LI Shao-jing, TANG Jian-hua
The First Affiliated Hospital of Hebei North University, Zhangjiakou 075061, China
The plants ofare rich in terpenoids, alkaloids, polyphenols, flavonoids, steroids, etc.Limonoids with extensive bioactivities and polycyclic system are the main secondary metabolites ofplants.Limonoids are a class of highly oxidized tetranortriterpenoids with a unique structure.Various structural types of limonoids, such as gedunin, andirobin, mexicanolide, phragmalin, are prevalent in theplants.Limonoids have various pharmacological activities such as anti-tumor, anti-virus, anti-oxidation, analgesia, anti-inflammatory, anti-anxiety and sedation, nerve protection and sleep improvement.They also have biological activities such as insect anti-feeding and insecticidal activities.Research progress on 216 limonoids infrom 2010 to 2021 and their biological activities were reviewed in this paper, in order to enrich the new drug development ideas of limonoids.
s Koenig; limonoids; gedunin; andirobin; mexicanolide; phragmalin; antitumor; antiviral; anti-insect activity
R282.710.5
A
0253 - 2670(2022)10 - 3178 - 17
10.7501/j.issn.0253-2670.2022.10.029
2021-10-10
李韶静(1995—),女,硕士研究生,研究方向为药效物质基础性研究。E-mail: 632386554@qq.com
通信作者:汤建华(1975—),男,研究方向为肿瘤学、中药学和药学。E-mail: 358506651@qq.com
[责任编辑 崔艳丽]
