酒制豨莶草和生豨莶草对缺氧损伤的H9c2心肌细胞保护作用的比较研究
2022-05-24白云绮李慧高照范冬冬娄利霞吴爱明孙克寒商洪才聂波
白云绮 李慧 高照 范冬冬 娄利霞 吴爱明 孙克寒 商洪才 聂波

摘要 目的:比較酒制豨莶草和生豨莶草对大鼠心肌细胞缺氧损伤的保护作用,并探讨其作用机制,为临床用药选择提供实验依据。方法:采用H9c2细胞缺氧模型,给予不同浓度酒制豨莶草和生豨莶草干预,CCK-8法测定细胞成活率,比色法检测细胞培养上清液中乳酸脱氢酶(LDH)活性,超氧化物歧化酶(SOD)活性;荧光酶标仪检测细胞内活性氧(ROS)含量;用蛋白质印迹法(Western Blotting)检测凋亡B细胞淋巴瘤-2(Bcl-2)蛋白和Bcl-2相关X蛋白(Bax)的表达。结果:缺氧16 h成功制备H9c2心肌细胞缺氧损伤模型;筛选确定300 μg/mL是生豨莶草和酒制豨莶草最佳给药浓度;与模型组比较,酒制豨莶草和生豨莶草均可提高细胞成活率(P<0.05),改善损伤细胞形态,减轻LDH外漏(P<0.05),降低ROS的含量(P<0.05),增加SOD活性(P<0.05),上调Bcl2(P<0.05)和Bcl-2/Bax的表达。给药浓度为300 μg/mL时,生豨莶草在提高SOD活力和细胞成活率方面优于酒制豨莶草(P<0.05),酒制豨莶草在抑制LDH外漏的作用强于生豨莶草,在活性氧(ROS)含量和Bcl、Bax蛋白表达方面,差异无统计学意义(P>0.05)。结论:酒制豨莶草和生豨莶草对缺氧损伤的H9c2心肌细胞具有保护作用,其机制可能是通过抵抗氧化应激,抑制心肌细胞凋亡。
关键词 酒制豨莶草;生豨莶草;H9c2心肌细胞缺氧模型;心肌保护;氧化应激;细胞凋亡;乳酸脱氢酶;活性氧
Protective Effects of Wine-Processed and Raw Siegesbeckiae Herba on H9c2
Myocardial Cells Induced by Hypoxia:A Comparative Analysis
BAI Yunqi,LI Hui,GAO Zhao,FAN Dongdong,LOU Lixia,WU Aiming,SUN Kehan,SHANG Hongcai,NIE Bo1,2
(1 Key Laboratory of Chinese Internal Medicine of Ministry of Education and Beijing,Dongzhimen Hospital,
Beijing University of Chinese Medicine,Beijing 100700,China; 2 School of Chinese Materia Medica,
Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To compare the protective effects of wine-processed and raw Siegesbeckiae Herba on H9c2 myocardial cells induced by hypoxia and explore the underlying mechanism to provide the experimental basis for clinical drug selection.Methods:Hypoxia-induced H9c2 cells were treated by wine-processed and raw Siegesbeckiae Herba of different concentrations.Cell viability was detected by Cell Counting Kit-8(CCK-8) and the lactic dehydrogenase(LDH) activity in cell culture supernatant by colorimetry.Superoxide dismutase(SOD) activity was also detected.The fluorescence microplate reader was used to detect the content of intracellular reactive oxygen species(ROS).Western blot was used to detect the protein expression of B-cell lymphoma 2(Bcl-2) and Bcl-2-associated X protein(Bax).Results:The hypoxia model was properly induced in H9c2 myocardial cells after 16 hours of hypoxia.The screening results revealed that the optimal concentration of wine-processed and raw Siegesbeckiae Herba was 300 μg/mL.Compared with the conditions in the model group,wine-processed and raw Siegesbeckiae Herba could improve cell viability(P<0.05),improve damaged cell morphology,reduce LDH leakage(P<0.05),decrease ROS content(P<0.05),potentiate SOD activity(P<0.05),and up-regulate the expression of Bcl-2(P<0.05) and Bcl-2/Bax.In the context of administration concentration of 300 μg/mL,raw Siegesbeckiae Herba was superior to wine-processed Siegesbeckiae Herba in potentiating SOD activity and increasing cell viability(P<0.05),while wine-processed Siegesbeckiae Herba was superior to raw Siegesbeckiae Herba in inhibiting LDH leakage.No statistically significant difference in ROS content and protein expression of Bcl and Bax was observed between wine-processed and raw Siegesbeckiae Herba.Conclusion:Wine-processed and raw Siegesbeckiae Herba possessed protective effects on H9c2 myocardial cells induced by hypoxia,and the mechanism might be related to the resistance to oxidative stress and the inhibition of myocardial apoptosis.
Keywords Wine-processed Siegesbeckiae Herba; Raw Siegesbeckiae Herba; H9c2 myocardial cell hypoxia model; Myocardial protection; Oxidative stress; Cell apoptosis; lactic dehydrogenase(LDH); Reactive oxygen species(ROS)
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.06.005
豨莶草(Siegesbeckiae Herba,HS)性寒味苦,归肝、肾经,具有祛风湿,通经络,清热解毒的功效,临床上常用于治疗风湿痹痛、筋骨不利,并具有很好抗炎镇痛功效[1-2]。近年来越来越多的研究发现,HS对心脏具有很好的保护作用,可以通过抑制炎症,抗氧化作用抵抗慢性心肌损伤,其对于急性心肌损伤也具有保护作用,其机制可能是通过抗氧化作用或者防止心肌重构来发挥作用[3-4]。然而我们发现豨莶草炮制方法多样,无论是含有豨莶草的中成药,还是临床应用的豨莶草,使用比较多的炮制方法清蒸和酒蒸,即生豨莶草(SHS)和酒制豨莶草(JHS)。临床应用多根据经验和医生偏好选择HS炮制品,尚未见从药效学对常用2种炮制品进行评价研究[3-5]。因此,本实验采用H9c2心肌细胞缺氧损伤模型,通过考察细胞成活率、乳酸脱氢酶(Lactate Dehydrogenase,LDH)漏出率、氧化酶活力、凋亡相关蛋白表达情况,探讨SHS和JHS对H9c2细胞缺氧损伤的保护作用及其机制,比较二者药效学差异,为临床选择HS的炮制品提供实验依据,同时也为HS治疗心血管疾病的机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞 H9c2大鼠心肌细胞株,购于中国医学科学院基础医学研究所协和细胞资源中心,批号:H9c2 2-1。
1.1.2 药物 生豨莶草和酒制豨莶草提取物由北京中医药大学东直门医院实验室提供,批号:83161101。
1.1.3 试剂与仪器 DMEM高糖培养基(BI公司,以色列,批号:0024219);胎牛血清(Gibco公司,美国,批号:2045677R);胰蛋白酶(Gibco公司,美国,批号:15140-122);细胞增殖-毒性检测试剂盒(日本同仁化学研究所,日本,批号:CK04);青-链霉素溶液(Gibco公司,美国,批号:15140-122);LDH试剂盒(南京建成生物工程研究所,批号:A020-2-2);SOD试剂盒(南京建成生物工程研究所,批号:A001-3-2);MDA试剂盒(南京建成生物工程研究所,批号:A003-1-2);ROS试剂盒(南京建成生物工程研究所,批号:E004);大鼠抗Bax抗体(Proteintech公司,美国,批号:50599-2-Ig);兔抗Bcl-2抗体(Proteintech公司,美国,批号:26593-1-AP);兔抗β-acting抗体(abcam公司,美国,批号:AB66132);辣根過氧化物酶标记山羊抗兔IgG(上海碧云天生物技术有限公司,批号:BST13L04A54);抗鼠IgG抗体(上海碧云天生物技术有限公司,批号:BST14J10A50);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:B0802);PVDF膜(Millipore公司,美国,批号:K4SA1716L);SDS-PAGE凝胶制备试剂盒(广州雅梅生物科技有限公司,批号:013C2151);ECL化学发光试剂盒(北京普利莱基因技术有限公司,批号:P1010);RIPA裂解液(北京普利莱基因技术有限公司,批号:CI1053)、奶粉(北京普利莱基因技术有限公司,批号:P1622)。酶标仪(BIO-TEX Instruments公司,美国,型号:ELX800),倒置显微镜(重庆光学仪器厂,型号:XSZ-D2),自动细胞计数仪(Countstar公司,美国,型号:IC 1000),低温离心机(Eppendorf公司,德国,型号:5424R),37 ℃恒温CO培养箱(SANYO公司,日本,型号:MCO-15AC CO),垂直电泳仪(北京市六一仪器厂,型号:DYCZ-25D),垂直电转仪(北京市六一仪器厂,型号:DYCZ-40D),凝胶成像系统(上海天能科技有限公司,型号:Tanon-5200),超净台(海尔集团,型号:HCB-900V),三气培养箱(BioSpherix,美国,型号:C42)。
1.2 方法
1.2.1 酒制豨莶草和生豨莶草的溶液制备 精密称取SHS和JHS提取物各20 mg,以DMEM高糖培养基(以下简称“培养基”)溶解制成2.0 mg/mL的贮备液,经0.22 μm滤器滤过除菌,于-20 ℃保存。后续实验时以培养基将其稀释至相应浓度。
1.2.2 H9c2细胞的培养及缺氧损伤模型的建立 H9c2细胞以含10%胎牛血清的培养基,于37 ℃、5%CO细胞培养箱中培养,待细胞增殖至80%~90%时,用0.25%胰蛋白酶消化、计数,并以1∶3比例传代。取对数生长期细胞,调整细胞悬液密度为8×10个/mL接种于细胞板或细胞瓶中,置于37 ℃、5% CO细胞培养箱中孵育48 h,待细胞增殖至80%~90%时,建立缺氧损伤模型。用磷酸盐缓冲液(PBS)清洗细胞板或细胞瓶3次,换无血清培养基,将细胞放入三气培养箱(1% O、5% CO、94% N)中密闭缺氧培养。缺氧结束后,取细胞或培养液进行相应指标检测。
1.2.3 分组与给药方法 本实验分为正常组、模型组、SHS组、JHS组。正常组:用含血清的培养基培养;模型组:缺氧条件下用无血清培养基培养;SHS组和JHS组:缺氧同时加入药物(药物用无血清培养基配制,浓度为100、300、500 μg/mL),其余过程同模型组。
1.2.4 检测指标与方法
1.2.4.1 细胞活力的检测 细胞活力检测采用CCK-8法。细胞接种于96孔板,按实验条件进行培养后,弃去细胞上清,每孔加入CCK-8溶液10 μL和100 μL无血清培养基,孵育1 h,用酶标仪在450 nm测定吸光度,计算细胞成活率,同时倒置显微镜观察各组细胞生长及损伤情况。
1.2.4.2 细胞培养上清液中LDH的含量测定 微量酶标法检测细胞LDH漏出量。细胞接种于6孔板,造模给药后,取细胞上清液,按照比色法进行LDH活性测定,并根据试剂盒上的相关换算公式将实验结果进行标准化转换。
1.2.4.3 细胞内活性氧(Reactive Oxygen Species,ROS)水平的测定 细胞接种于6孔板,造模给药后,用胰酶消化并收集細胞,PBS清洗后重悬,调整细胞悬液密度为8×10个/mL种于96孔板中,加入荧光探针2,7-二氯荧光黄双乙酸盐(DCFH-DA),避光孵育1 h后于荧光酶标仪检测含量,酶标仪激发波长510 nm,发射波长525 nm检测细胞荧光强度,并根据试剂盒上的相关换算公式将实验结果进行标准化转换。
1.2.4.4 细胞内超氧化物歧化酶(Superoxide Dismutase,SOD)活力测定 微量酶标法检测细胞中SOD活力,细胞接种于10 cm皿中,造模给药后,用胰酶消化并收集细胞,PBS洗3次后,离心,弃去细胞上清液,留取沉淀,再加入1 mL的PBS并混匀,然后将其放入液氮中反复冻融3次,在2 000 r/min,离心半径11 cm条件下离心2 min后取上清液,根据试剂盒说明书要求检测细胞内SOD活力。
1.2.4.5 B细胞淋巴瘤-2(Bcl-2)蛋白和Bcl-2相关X蛋白(Bax)表达水平检测 细胞接种于25 cm培养瓶中,造模给药后,用胰酶消化并收集细胞。然后用RIPA细胞裂解液在冰上裂解30 min,15 000 r/min,离心半径6 cm条件下离心后取上清液,用BCA试剂盒测定蛋白浓度。取等量总蛋白上样,10%SDS聚丙烯酰胺凝胶电泳(SDS Polyacrylamide Gel Electrophoresis,SDS-PAGE)凝胶电泳分离后,将蛋白转印至聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜。用5%的脱脂奶粉封闭1 h,加入一抗Rabbit Anti-Bcl-2(浓度为1∶1 000),Mouse Anti-Bax(浓度为1∶5 000),Rabbit Anti-bactin(浓度为1∶5 000),在4 ℃条件下摇床孵育过夜。次日,TBST洗膜5次后,用Goat Anti-rabbit,Goatanti-mouse(浓度为1∶5 000)室温孵育1 h,TBST洗涤5次后,增强型化学发光试剂(ECL)显色。Image J软件灰度分析。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
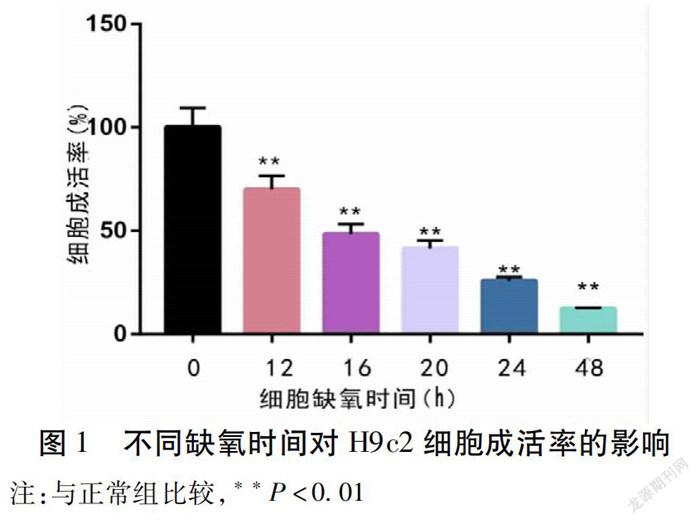
2.1 不同缺氧时间对H9c2细胞成活率的影响 缺氧时间增加可加重H9c2细胞氧化应激损伤并降低细胞成活率。实验结果显示H9c2细胞缺氧16~48 h可显著降低细胞成活率。H9c2细胞缺氧16 h,细胞成活率为48.39%,细胞成活率降低程度适中,实验结果重复性好(n=6),因此选择16 h来建立细胞缺氧损伤模型。见图1。
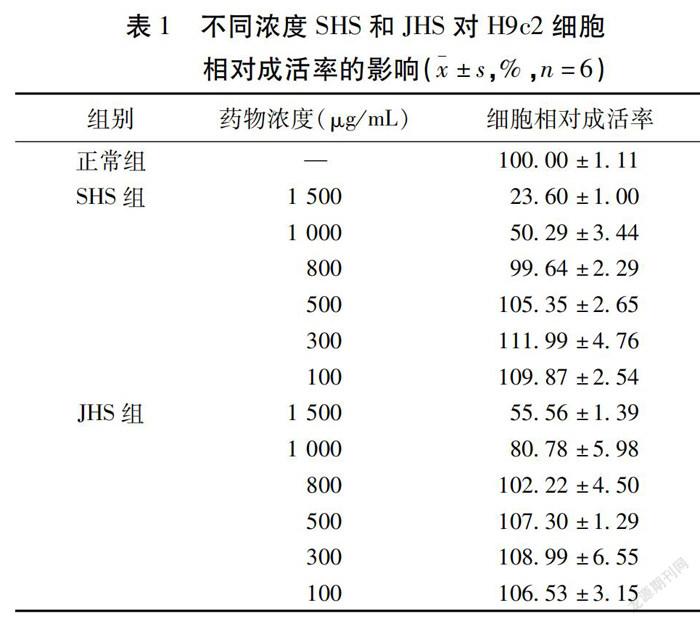
2.2 SHS和JHS不同浓度对H9c2细胞活力的影响 与正常组比较,给药浓度在800 μg/mL以下未见细胞毒性,因此在后续实验中,SHS和JHS均采用500、300、100 μg/mL为药物干预浓度。见表1。
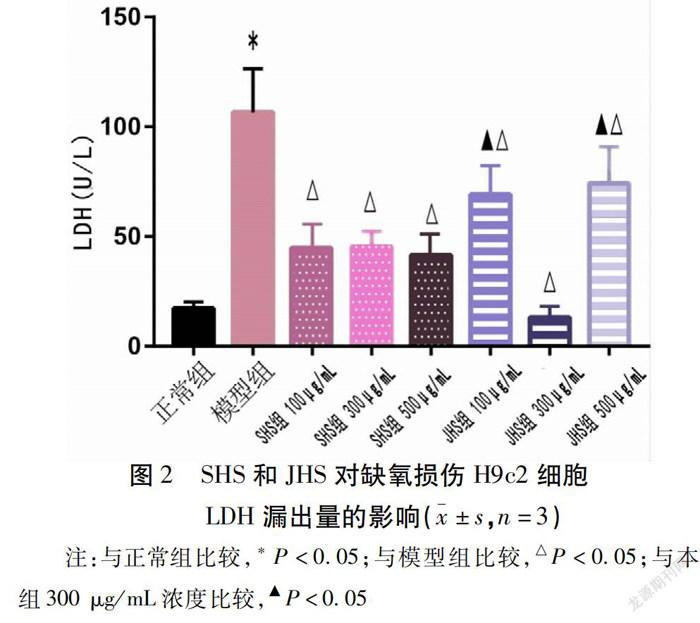
2.3 SHS和JHS对缺氧损伤H9c2细胞活力和LDH漏出率的影响 与正常组比较,模型组细胞成活率下降(P<0.05),LDH漏出率增多(P<0.05);与模型组比较,3个浓度的SHS组和JHS组细胞成活率均升高(P<0.05),LDH的漏出率下降(P<0.05)。SHS各浓度组间比较,给药浓度为300 μg/mL时,细胞成活率最高(P<0.05),LDH漏出率各组之间差异无统计学意义(P>0.05);JHS各浓度组间比较,给药浓度为300 μg/mL时,LDH漏出率最低(P<0.05),细胞成活率各组差异无统计学意义(P>0.05)。因此,综合造模给药后细胞活力和LDH指标筛选出最适给药剂量分别为:SHS给药浓度为300 μg/mL,JHS给药浓度为300 μg/mL,接下来实验SHS和JHS均采用该浓度。见表2,图2。
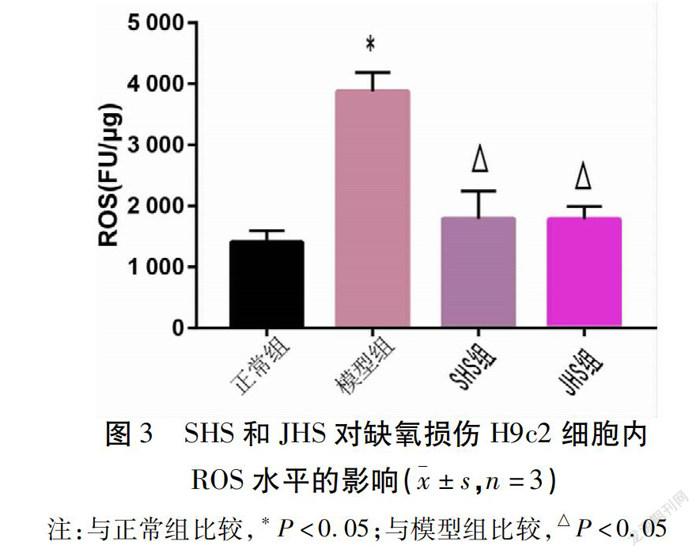
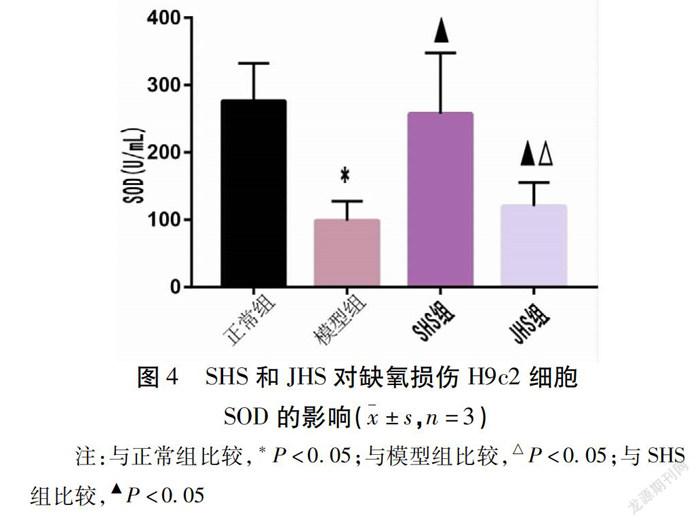
2.4 SHS和JHS对缺氧损伤H9c2细胞ROS水平、SOD活性的影响 与正常组比较,模型组细胞内ROS水平增加(P<0.05),SOD活力降低(P<0.05);与模型组比较,SHS组和JHS组均降低细胞胞内ROS的水平(P<0.05),增加SOD活性(P<0.05);SHS组与JHS组比较,SHS组SOD活性高于JHS组(P<0.05),ROS水平2组之间差异无统计学意义(P>0.05)。见图3、图4。
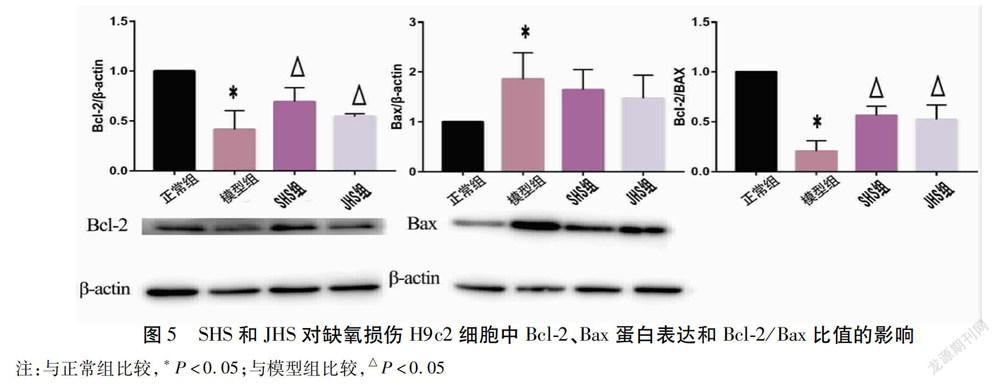
2.5 SHS和JHS对缺氧损伤后H9c2细胞中Bax,Bcl-2,Bcl-2/Bax蛋白表达的影响 与正常组比较,模型组Bcl-2表达水平下调(P<0.05),Bax表达水平上调(P<0.05),Bcl-2/Bax比值下调(P<0.05);与模型组比较,SHS组和JHS组均可上调Bcl-2的表达(P<0.05),上调Bcl-2/Bax的比值(P<0.05),但Bax值未见明显差异;SHS组与JHS组的Bax、Bcl-2、Bcl-2/Bax水平比较,差异无统计学意义(P>0.05)。见图5。
3 讨论
HS最早记载于唐代的《新修本草》:“主金疮,止痛,断血,生肉,除诸恶症,消浮肿,捣封之。汤渍、散敷并良。”古文献中记载的炮制方法有很多种,包括清蒸、酒蜜蒸、酒蒸、酒炒、清炒等,其中以清蒸、酒蒸应用最为广泛[6]。现代临床应用和专利药中HS多是清蒸和酒蒸,但品种选择依据未见相关实验报道,因此本实验以豨莶草的2种常用品种SHS和JHS为研究对象,从防治心肌缺氧损伤药理作用进行比较研究。
心肌缺氧造模选用经典造模方式,依据本实验结果调整缺氧时间,H9c2细胞缺氧不同时间,则细胞受损程度不同[14]。缺氧16 h时,细胞损伤明显,细胞成活率降至50%左右,因此选择16 h为本实验缺氧损伤的造模时间。采用CCK-8法筛选药物给药浓度,发现药物浓度为800 μg/mL以下细胞正常生长,避免了药物毒性对实验结果的影响,本实验采用500、300、100 μg/mL为药物干预浓度。心肌缺氧时,细胞膜和线粒体膜损伤导致膜通透性增加,LDH漏出增多,LDH作为有效评价心肌损伤程度的指标[10]。本研究从细胞活力和LDH指标進一步筛选,确定给药浓度SHS为300 μg/mL,JHS为300 μg/mL。
心肌细胞在缺氧状态下,清除氧自由基的SOD含量下降,氧自由基增多,导致ROS清除不足,ROS在体内增多,破坏机体氧化/还原反应,从而引起细胞氧化损伤[8,17-18]。心肌缺氧时LDH漏出增多,细胞膜和线粒体膜损伤而介导的膜通透性增加,线粒体受损或功能障碍激活线粒体自噬,从而降解受损线粒体达到降低ROS等促凋亡因子的生成[10,19-20],因此当ROS在体内过度增多时,机体会代偿性通过多途径减少其分泌,降低ROS的含量。本研究发现,SHS和JHS均能明显提升SOD活力,显著降低LDH外漏和ROS含量,具有清除氧化自由基的能力,减轻氧自由基损伤的作用。浓度为300 μg/mL时,SHS组细胞成活率和SOD活性高于JHS组,JHS抑制LDH外漏作用强于SHS,2组ROS水平比较,差异无统计学意义。分析产生差异的原因可能是,炮制后的JHS有效成分发生改变,其中豨莶精醇含量下降,奇壬醇和豨莶苷含量升高[7]。推测可能是豨莶精醇在提高SOD活力方面优于奇壬醇和豨莶苷,而奇壬醇和豨莶苷则对抑制LDH外漏有更好的效果。
心肌缺氧损伤可以导致线粒体功能障碍,线粒体是心肌细胞内重要的细胞器,不仅是ATP产生的主要场所,而且是细胞凋亡的启动处[21]。Bcl2蛋白通过维持线粒体钙离子稳定,抑制细胞色素C等促凋亡物质,从而维持线粒体稳定[11]。Bax蛋白是Bcl2的家族成员,二者共同调控细胞凋亡[12]。研究者把Bcl-2/Bax作为调节细胞凋亡的指标,其比值增加,细胞凋亡减少,比值降低,则促使细胞凋亡[16]。本实验发现SHS和JHS均能明显下调Bcl-2的表达,上调Bcl-2/Bax比值,减少细胞凋亡。
综上所述,SHS和JHS对缺氧损伤H9c2细胞具有保护作用。其作用机制可能是抑制LDH外漏,提高SOD活力,清除过量ROS,调节Bcl-2和Bax蛋白的表达,抗氧化应激和维持线粒体完整从而抑制心肌细胞凋亡。其中SHS在提高SOD活力和细胞成活率方面优于JHS,JHS在防止LDH外漏方面优于SHS,其他方面没有显著差异,综合以上指标评价SHS在保护心肌缺氧方面略优于JHS。本实验从细胞水平比较了生豨莶草和酒制豨签草对心肌缺氧损伤的疗效,并探讨了初步的作用机制,为炮制品的临床应用选择提供实验依据,为豨莶草在心血管疾病防治方面深入研究奠定基础。
参考文献
[1]罗琼,汪建平,阮金兰,等.豨莶草局部外用的抗炎镇痛作用研究[J].湖北中医学院学报,2008,10(3):9-11.
[2]王维伟,韩蕾,周晓辉,等.豨莶草对压力超负荷型大鼠心肌重构的影响[J].辽宁中医药大学学报,2011,13(7):102-105.
[3]于静,王婧,苏素文,等.豨莶草提取物抗多柔比星致大鼠急性心肌损伤的作用[J].医药导报,2013,32(7):843-847.
[4]王永,厉保秋,周莉,等.豨莶草胶囊对比格犬凝血功能及血液流变学的影响[J].亚太传统医药,2012,8(3):6-7.
[5]孟倩超,金若敏,王聃,等.豨莶草抗血栓组分对血小板聚集的影响[J].上海中医药杂志,2008,42(5):89-91.
[6]胡慧华.豨莶草入药部位、炮制历史沿革的考证[C].中华中医药学会中药炮制分会.中华中医药学会第五届中药炮制分会学术会议论文集.普宁:中华中医药学会中药炮制分会,2005:87-94.
[7]Arevalo JF,Lasave AF,Wu L,et al.INTRAVITREAL BEVACIZUMAB FOR PROLIFERATIVE DIABETIC RETINOPATHY:Results From the Pan-American Collaborative Retina Study Group(PACORES) at 24 Months of Follow-up[J].Retina,2017,37(2):334-343.
[8]Hess ML,Manson NH.Molecular oxygen:friend and foe.The role of the oxygen free radical system in the calcium paradox,the oxygen paradox and ischemia/reperfusion injury[J].J Mol Cell Cardiol,1984,16(11):969-985.
[9]Petersen KF,Befroy D,Dufour S,et al.Mitochondrial dysfunction in the elderly:possible role in insulin resistance[J].Science,2003,300(5622):1140-1142.
[10]Ma Y,Li L,Shang XM,et al.Analysis of factors related to short-term prognosis in patients undergoing percutaneous coronary intervention for acute myocardial infarction[J].Exp Ther Med,2013,5(4):1206-1210.
[11]Liu L,Zhang Z,Xing D.Cell death via mitochondrial apoptotic pathway due to activation of Bax by lysosomal photodamage[J].Free Radic Biol Med,2011,51(1):53-68.
[12]Liu L,Zhang Z,Xing D.Cell death via mitochondrial apoptotic pathway due to activation of Bax by lysosomal photodamage[J].Free Radic Biol Med,2011,51(1):53-68.
[13]于静,苏素文,杨继章,等.豨莶草醇提物对多柔比星致小鼠慢性心肌损伤的保护作用[J].中国药房,2017,28(10):1320-1323.
[14]穆清,张志良,杨胜.薯蓣皂素對缺氧诱导的H9C2大鼠心肌细胞内质网应激损伤的保护作用[J].中国临床解剖学杂志,2019,37(2):153-159.
[15]林繄依,夏欢,夏桂阳,等.豨莶草治疗慢性疼痛研究进展[J].中国中药杂志,2020,45(8):1851-1858.
[16]王晓丽,万生芳,魏昭晖,等.红芪多糖对脾虚型糖尿病大鼠Bcl-2/Bax表达的影响[J].时珍国医国药,2019,30(8):1802-1804.
[17]杨洋,刘亭,王文华,等.参芎葡萄糖注射液对HO诱导的H9C2细胞氧化损伤的保护作用[J].中国实验方剂学杂志,2016,22(8):153-158.
[18]王瑞楠,付洋洋,铁芳芳,等.胡芦巴叶黄酮组分的制备、表征及其对肝细胞氧化损伤的保护作用[J/OL].中国中药杂志,(2022-1-12)[2022-03-14].https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST&filename=ZGZY20211103000&uniplatform=NZKPT&v=8Z0L1TRGFxe5i9A-8dc2woDuCdD8K6msDdNxQE8OfxsPBfxX8GSq-FMSlPYVnQyRV.
[19]薛兴翠,孙军奎,贺连栋.知母皂苷B-Ⅱ通过调控LncRNA XLOC_032768减轻LPS诱导心肌细胞损伤[J].中成药,2021,43(10):2679-2684.
[20]辛高杰,付建华,韩笑,等.丹酚酸B调控NIX介导的线粒体自噬保护H9C2心肌细胞缺氧/复氧损伤[J].中国中药杂志,2020,45(12):2960-2965.
[21]Kroemer G,Galluzzi L,Brenner C.Mitochondrial membrane permeabilization in cell death[J].Physiol Rev,2007,87(1):99-163.
(2020-07-16收稿 本文编辑:王明)
基金项目:第二批国家“万人计划”科技创新领军人才特殊支持经费资助项目(W02020052);北京中医药大学重点实验室项目(1000061222482)
作者简介:白云绮(1994.08—),女,硕士研究生在读,研究方向:心脑血管的中医药防治;E-mail:1723668176@qq.com
通信作者:聂波(1977.12—),女,博士,研究员,研究方向:中医药防治动脉粥样硬化及其作用机制,中药药效物质质量标准及药物代谢,E-mail:nieboww_1977@163.com
