一道关于pH振荡的高考化学试题解析与拓展
2022-05-23沈坤华
沈坤华
(浙江省桐乡市凤鸣高级中学 314500)
2021年6月浙江省高考化学选考试题第29题第4小题如下:
一定条件下,在Na2S-H2SO4-H2O2溶液体系中,检测得到pH-时间振荡曲线如图1所示,同时观察到体系由澄清→浑浊→澄清的周期性变化.

图1
可用一组离子方程式表示每一个周期内的反应进程,请补充其中的两个离子方程式.

Ⅱ.①____;

Ⅳ.②____.

然而,学生写Ⅱ反应感到困难,无从下手,许多学生分析了pH-时间图像,产生一系列疑问,影响了Ⅱ反应离子方程式的书写,能正确写出
的考生极少.作为化学教师应能解释学生的一系列困惑,不仅知其然,而要知其所以然.
1 pH振荡及其机理
pH振荡是一种化学振荡,指溶液体系中H+浓度随时间的变化而发生周期性变化的现象.与蓝瓶子实验、碘钟实验等反应可以在封闭体系中产生振荡不同,pH振荡必须在连续流动搅拌反应器(CSTR)中才能进行.
pH振荡的机理因振荡体系的组成差异而有所不同,但从本质上讲,皆可看作由两个复杂的氧化还原反应组成.在单底物(初始时,加入的一种还原剂)体系中,按照体系的初始pH和氧化剂与还原剂(底物)的初始比例,底物可被氧化为两种不同的程度,一条途径是部分氧化,形成相对稳定的中间体,该反应消耗H+,因此当该反应占主导时,体系pH升高.当H+浓度降低,部分氧化逐渐缓慢,当pH升高到一定值,部分氧化停止,此步为自抑制过程.而高pH有利于另外一条途径,即:中间产物和底物的完全氧化伴随着自催化产生H+的过程.此步完成,pH回复到初始的低值,如果有反应物以适当的速率持续流入反应器,则循环重新开始.H+的消耗和产生过程如图2所示.
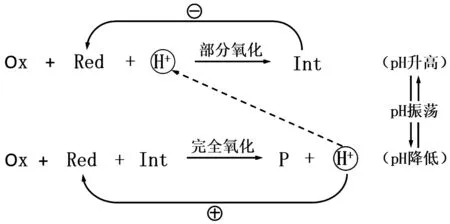
Ox,氧化剂;Red,还原剂;Int,中间体;P,最终产物;-和⨁分别代表自抑制和自催化.图2
H+在产生振荡行为中起了至关重要的驱动作用,即H+既不是振荡的结果,也不是指示剂,而是振荡的驱动力.
2 Na2S-H2SO4-H2O2振荡体系实例分析
实验中,一定浓度一定比例的Na2S、H2O2和H2SO4三种反应物经过三个独立通道用蠕动泵送入反应器(CSTR),用磁力搅拌器高速搅拌使其混合均匀,混合液达到一定体积后,从反应器上部孔流出,同时检测反应器内溶液pH变化.实验证实,该体系pH在6.0~8.5范围内振荡,如图1所示.
北京大学傅鹰先生曾说:“没有理论,实验就有可能变成盲动,劳而无功、进步迟缓,甚或根本不能进步”.可见理论指导实践的重要性.下面运用pH振荡理论解释Na2S-H2SO4-H2O2体系的振荡现象.
反应体系中,首先S2-转变成HS-形态:

(1)
HS-按照下式发生2种氧化过程:

(2)

(3)

(4)
反应(4)生成了H+,pH回复到初始的低值状态,促进了反应(2)的进行,这样一个新的循环又开始了.

许多考生及一些高中化学教师认为试题中有4个反应,pH-时间曲线的一条斜面对应一个反应,依试题中Ⅰ-Ⅱ-Ⅲ-Ⅳ顺序向右进行反应,按这种思路,应在高pH区出现浑浊,振荡周期要扩大1倍,这不符合实验事实,根本原因是对pH振荡本质的不理解造成的.有实验条件的学校,可把此实验作为学生课外探究实验,训练学生科学思维和实践能力.
由于pH变化具有普遍性且容易检测,pH振荡已成为国际上化学动力学研究的一个热点,在化学、医学、生命科学以及自动化等领域有着广阔的应用前景.
3 教学启示
当今社会,化学科学与技术突飞猛进,化学新知识、新技术不断涌现,丰富了人们的学习与生活,促进了人类文明的进步.《普通高中化学课程标准(2017年版2020年修订)》内容要求中提到了许多化学前沿领域和当代社会的热点问题,如合成化学、能源化学、生物大分子、超分子、电浮选凝聚法、膜分离工程等化学知识与技术,作为高中化学教师必须紧跟时代步伐,除了学习课改、教改、考改政策和课程与教学论知识外,必须加强化学学科知识的学习与进修,提升自己的学科理解,并将化学前沿知识以适当的方式融入课堂或以此为背景编制化学习题,体现化学教学的时代特色和化学学科价值,培养学生在陌生情境下解决实际问题的能力,发展学生化学学科核心素养.
