例谈守恒原理的应用
2022-05-23朱宏
朱 宏
(云南师范大学实验中学 650031)
守恒定律是指在化学反应前后,参与化学反应的各物质质量、元素种类、原子间的类型、数目、电子转移数保持不变;元素的化合价可能改变,但前后化合价升降数不变,即电子转移数不变.守恒现象很多,本文依托常见原子守恒、电子守恒、电荷守恒原理总结了中学化学中常见的一些题目的解题思路.
1 原子守恒原理
原子守恒即在化学反应前后,各元素原子个数相等.
例1以38.4g铜和适量的浓硝酸发生反应,铜完全反应后,共获得了标准状况下22.4L气体,而反应中消耗的硝酸物质的量可能为( ).
A.1.0mol B.1.6mol C.2.2mol D.2.4mol
解析因为随着化学反应的发生,以及HNO3含量的变化,所收集的气体必然是NO2与NO的混合物,则硝酸在和金属反应时生成的二氧化氮与一氧化氮的总量,即为硝酸呈现氧化性的那组成部分量,而呈现酸性的那部分硝酸则生成硝酸铜,由于化学反应前后氮原子守恒,则化学反应耗费HNO3的物质的量为:
n(硝酸)=2×n[硝酸铜]+n(氮氧化物)
=38.4g÷64g/mol×2+22.4L÷22.4L/mol
=2.2mol
所以,C正确.
例2有一在空气中暴露后变质的氢氧化钾固体溶液,分析知其水分为7.62%,碳酸钾2.83%,氢氧化钾90%.若把此样品加在1mol/L的盐酸溶液46.00mL里,将过量的盐酸溶液用27.65mL 1.07mol/L氢氧化钾溶液恰好中和,蒸发溶液可得固体约为( ).
A.3.43g B.4.00g C.4.50g D.1.07g
解析氯元素原子守恒,固体中KCl的质量为:
1.0mol/L×46.00mL/1000×74.5g/mol
=3.43g
故A正确.
例3 将100mL 1mol/L的盐酸加入一定量的铁、氧化亚铁和三氧化二铁的混合物中,恰好溶解,并收集到标准状况下224mL氢气,向所得溶液加入硫氰化钾后不呈红色,再加足量氢氧化钠溶液,使水溶液中的金属阳离子全部转成沉淀,并将沉淀在空气中充分煅烧,将之后的固体在高温下用足够量一氧化碳还原,得到Fe的总质量是( ).
A.11 B.2.8g C.5.6g D.无法计算
解析(1)向混合物中加入盐酸至混合物完全溶解,发生反应:


加入足量的NaOH水溶液,金属阳离子全部转成沉淀并完全氧化.


整体分析各元素关系如下:
Fe-FeO-FeCl2-Fe(OH)2-Fe(OH)3-Fe2O3-Fe
根据原子守恒则得出如下关系:
即n(Fe)=n(FeCl2)=1/2n(Cl-)
n(Fe)=1/2×0.1L×1mol/L=0.05mol
故m(Fe)=56g/mol×0.05mol=2.8g
故B答案正确.
例4 把0.4mol二氧化碳水溶液通入1L 0.5mol/L氢氧化钠水溶液中充分化学反应后,可得到水溶液中NaHCO3与Na2CO3的物质的量的比为( ).
A.1∶3 B.1∶2 C.1∶1 D.3∶1
解析本题如果通过化学方程式来进行计算:


根据原子守恒,在该反应中Na+和碳原子的物质的量将始终不变,即
n(Na+)=0.5mol,n(C)=0.4mol
设NaHCO3和Na2CO3的物质的量分别为xmol、ymol,即可列出两个等式:
x+y=0.4x+2y=0.5
解得x=0.3mol、y=0.1mol,故x∶y=3∶1
故D正确.
2电子守恒原理
电子守恒是指在氧化还原反应过程中,氧化剂与还原剂转移电子的物质的量不变.
例5将一份含硫酸铜为0.4mol、氯化钾为0.2mol的混合水溶液为1L,用惰性电极为阴极电解一段时间后,在其中某电极上析出0.3mol Cu,则另一电极上收集标准状态下气体的体积是( ).
A.4.48L B.6.72L C.5.60L D.13.44L
解析根据电化学原理,Cu2+在阴极得电子生成为Cu,即

阴极生成0.3mol Cu,得电子为0.6mol.
阳极中Cl-失电子生成Cl2:

共0.2mol Cl-失去0.2mol电子生成0.1mol Cl2,而根据电子数守恒,在溶液中的OH-应失去电了0.4mol.因

则放出的O2气体0.1mol,而气体总物质的总数是0.2mol,故在标准状况下气体的体积是0.2mol×22.4 L/mol=4.48L.
故A正确.
例6通入标准状况下2.24L的氯气到100mL的溴化亚铁水溶液中,充分反应后,水溶液中溴离子约1/3被氧化生成溴单质,则原溴化亚铁溶液物质的量浓度为( ).
A.0.6mol/L B.1.2mol/L C.1.8mol/L D.2.24mol/L
解析设FeBr2溶液浓度为xmoL/L,按照电子守恒原则可知从氯气得电子的物质的量,相当于亚铁离子和溴离子失电子的物质的量之和,则:
2.24L/22.4L/mol×2
=0.1x×1+(0.1x/3)×2×1
解得x=1.2mol/L.
故B正确.
例7在一定量的浓硝酸中加入1.92g铜单质,铜全部溶解,生成气体颜色逐渐变浅,收到标准状况下的气体为672mL,把盛气体的仪器倒扣到水内,标准状况下一定体积的氧气恰好使气体溶于水中,则通入氧气的体积为( ).
A.112mL B.224mL C.336mL D.448mL
解析向HNO3反应还原生成NO2、NO,则铜失电子数目应等于硝酸得电子数目,向容器中通入氧气,使二氧化氮、一氧化氮转变为硝酸时,则二氧化氮、一氧化氮失去电子的量应等于氧气得电子的量.Cu失去的电子最终给了O2,由得失电子守恒可得:
4n(O2)=2n(Cu)
故V(O2)=n(O2)×Vm=n(Cu)/2×Vm
=1.92g÷64g/mol÷2×22.4L/mol
=0.336L=336mL.
故C正确.
3 电荷守恒原理
主要指在电解质水溶液中或某化合物里阴阳离子所带的正负电荷数量相等.
例8常温下,将稀硫酸与氨水混合,所得溶液的pH=7,则此溶液中( ).
解析根据电荷守恒原理,在溶液中

故C正确.
例93.2g铜和30mL 8mol/L硝酸溶液充分反应,硝酸的还原物质有二氧化氮和一氧化氮,反应后H+的物质的量为amol,则此时溶液含硝酸根离子的物质的量为( ).
A.(a+0.1)mol B.(a+0.2)mol
C.(2a+0.1)mol D.(2a+0.2)mol

n(Cu2+)×2+n(H+)×1=n(NO3-)×1

故A正确.

A.3 B.4 C.5 D.6
解析先按照题意把系统内存在的全部带电粒子都写出:
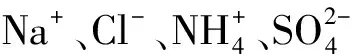
故C正确.
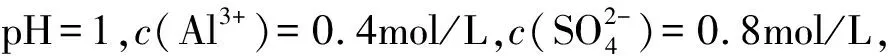
A.0.15mol/L B.0.2mol/L
C.0.3mol/L D.0.4mol/L
解析依据电荷守恒原理,在溶液中
c(K+)+c(H+)+3c(Al3+)=2c(SO42-)+c(OH-)
c(OH-)忽略不计,故c(K+)=0.3mol/L.
故C正确.
