泽泻对MSG大鼠肝损伤及抗氧化作用的影响
2022-05-23黄春丽冯光维余跃生
黄春丽,冯光维,汪 巍,余跃生
(黔南民族医学高等专科学校,贵州都匀558013)
糖尿病( diabetesmellitus,DM)是一种胰岛素分泌不足或胰岛功能受损引发的以高血糖为特征并伴有多种并发症的的代谢性疾病[1]。近年来随着人们生活结构的改变以及人口老龄化的影响,糖尿病的发病率迅速增长,预计2040年全球糖尿病患者将达到6.42亿[2],严重威胁到人类身体健康。肝脏作为机体糖代谢的主要场所,也是胰岛素的主要靶器官,临床研究发现约有70%糖尿病患者伴有不同程度的肝脏病变,如肝纤维化、肝硬化甚至肝衰竭等[3]。近年来对由2型糖尿病引起的肝损伤研究逐渐增多,糖尿病肝损伤越来越受到人们的重视[4]。泽泻为泽泻科泽泻属植物泽泻Alismaorientalis( Samuel.) JuzeP. 的干燥块茎,具有利尿、降血糖、降血脂、抗氧化及保肝等作用[5-7]。泽泻对糖尿病的研究多停留在调节糖脂代谢紊乱方面,关于泽泻治疗糖尿病引起的肝损伤方面的研究较少。本研究利用谷氨酸钠(monosodiumglutamate,MSG)联合高脂饲料诱导的MSG肥胖大鼠模型,模拟糖尿病早期糖脂代谢紊乱的症状,通过观察泽泻对MSG肥胖大鼠肝脏的保护作用并探讨可能的作用机制,为泽泻的临床应用提供科学依据。
1 材料与仪器
1.1 动物 SD孕鼠,体重(300~400) g,由长沙市天勤生物技术有限公司提供,动物合格证编号:SCXK(湘 )2014-0011。实验前 1周饲养于黔南民族医学高等专科学校实验动物中心,自由饮食,温度 18~22℃。
1.2 药品 泽泻药材(产自中国广西,符合2015年药典标准),非诺贝特(江苏瑞年前进制药有限公司,批号:1803241),罗格列酮(成都瑞恒有限公司,批号:190512)。
1.3 试剂与仪器 超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号20200309),丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号20200304),谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所,批号20200306),ME203E/02电子天平(梅特勒-托利多仪器(上海)有限公司),RE-2000 旋转蒸发仪( 上海亚荣生化仪器厂) ,KZ-II高速组织研磨仪(Servicebio公司),D3024R台式高速冷冻离心机(大龙公司),EPoch酶标检测仪(BioTeK公司),BMJ-1生物组织包埋机(天津航空机电公司),ASP300S全自动封闭脱水机 (LEICA公司),RM2135病理切片机(LEICA公司),CX显微镜(OLYMPuS公司)。
2 方法
2.1 药物制备 先将泽泻药材粉粹成粗粉,取粗粉1 kg加80%乙醇回流提取3次,每次2 h,减压回收溶剂既得泽泻醇提取物,灌胃时用5%阿拉伯胶水溶液配制成所需浓度。高脂饲料配方:2%胆固醇,0.2%猪胆盐,15%蛋黄粉,22%猪油,10%蔗糖另加高营养饲料搅拌混匀,经过高压、熟化灭菌制得。
2.2 模型建立 SD大鼠新生乳鼠从第2天开始皮下注射L-谷氨酸钠,剂量为4 g/(kg·d)连续注射7 d,正常对照组给予等量生理盐水。21 d后离乳饲养,MSG组给予高脂饲料喂养,正常对照组普通饲料,每周记录体重观察体型变化,8周后眼眶采血检测空腹血糖及血脂变化,以空腹血糖及血脂水平显著高于正常组为造模成功标准。
2.3 分组及给药 筛选符合模型标准的大鼠48只大鼠,雌雄各半,按随机数字表法分为6组,分别为模型组、罗格列酮组、非洛贝特组、泽泻高、中、低剂量组,每组8只,另取8只空白大鼠作为正常对照组。罗格列酮组按5 mg/kg灌胃,非诺贝特组100 mg/kg,泽泻醇提取物高、中、低剂量组分别为(生药4、2、1 g/kg),各组每日灌胃1次,连续 8周,用药体积按每100 g体重灌胃1 ml,模型组及正常组灌胃同体积5%的阿拉伯胶水溶液。每周称重1次,根据体重调整给药量。
2.4 标本采集 给药8周后,腹主动脉采血,剖取肝脏组织,摘取1片液氮速冻后,迅速转入-80℃冰箱冷贮备用。另取1片浸泡于10%福尔马林溶液,用于肝脏组织形态变化的观察。
2.5 指标检测
2.5.1 肝脏系数的计算 将剖取的所有肝脏组织,用生理盐水冲洗,滤纸吸干水分后,称重,计算肝脏系数。肝脏系数=肝脏重量(mg)/大鼠体重(g)×100%。
2.5.2 肝脏病理的检测 取出福尔马林中固定好的肝脏组织,进行常规的洗涤、改刀、脱水、石蜡包埋,切片,HE染色,光镜下200倍观察肝脏组织形态学变化并拍照。
2.5.3 肝脏SOD、MDA及GSH-Px水平检测 称取肝脏适量,用9倍匀浆介质研磨,然后将研磨液3 500 r/min,离心10 min,取上清制备成10%的组织匀浆,严格按试剂盒的要求进行检测。
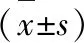
3 结果
3.1 泽泻对MSG大鼠肝脏重量及肝脏系数的影响 给药8周后,与正常对照组相比,模型对照组肝脏重量及肝脏系数显著升高(P<0.01);与模型对照组相比,罗格利酮、非诺贝特组肝脏重量及肝脏系数显著降低(P<0.01,P<0.05);泽泻高、中剂量组肝脏重量及肝脏系数显著降低(P<0.01,P<0.05)。泽泻低剂量组对肝脏重量及肝脏系数没有明显影响,见表1。
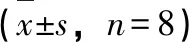
表1 泽泻对MSG大鼠肝脏重量及肝脏系数的影响
3.2 泽泻对MSG大鼠肝脏组织变化的影响 正常对照组大鼠肝脏组织结构清晰,肝细胞形态正常,细胞质染色均匀,细胞排列整齐,围绕中央静脉呈放射状,未见明显病理变化(图1-A);模型对照组大鼠肝脏结构不清晰,肝细胞肿大,脂肪变性明显,胞浆充满空泡脂肪,细胞核偏离正常位置,细胞排列紊乱条索状排列基本消失(图1-B)。与模型组相比各治疗组除泽泻低剂量组外其余各组细胞肿胀程度均有减轻,胞浆空泡脂肪减少,脂肪变性程度有所改善,肝细胞结构基本趋于正常(图1-C~G)。

A正常对照组(H.E×200) B 模型对照组(H.E×200) C罗格列酮组(H.E×200) D非诺贝特组(H.E×200)
3.3 泽泻对MSG大鼠肝脏SOD、MDA及GSH-Px含量的影响 给药8周后,与正常对照组相比,模型对照组SOD、GSH-Px含量显著降低(P<0.01);MDA含量显著升高(P<0.01);与模型对照组相比,罗格利酮、非诺贝特组SOD、GSH-Px活性显著降低(P<0.01),MDA含量显著升高(P<0.01);泽泻高、中剂量组SOD、GSH-Px活性显著降低(P<0.01,P<0.05),MDA含量显著升高(P<0.01,P<0.05)。泽泻低剂量组对肝脏SOD、GSH-Px活性及MDA含量没有明显影响,见表2。
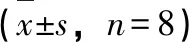
表2 泽泻对MSG大鼠肝脏SOD、GSH-Px及MDA的影响
4 讨论
糖尿病长期高血糖导致机体不能很好利用的葡萄糖和脂肪酸在肝脏内转变为脂肪,脂肪在肝脏沉积后容易引起肝损伤[8]。反过来,肝损伤后又会影响糖原对葡萄糖的转化,最终影响血糖[9]。因此改善糖尿病引起的肝损伤在糖尿病的治疗过程中意义重大。肝脏作为糖脂代谢的主要场所,血糖血脂升高后,肝脏过氧化应激水平升高[10],产生大量氧自由基与体内脂质过氧化产生大量丙二醛(MDA),与蛋白结合后能使细胞功能失调甚至破坏细胞活性。而超氧化物歧化酶(SOD)能防止脂质过氧化,但血脂上升后损伤肝脏抗氧化能力,致使SOD、GSH-Px活性降低,自由基产生和清除的动态平衡受到破坏。实验结果显示采用MSG加高脂饲料复制的MSG肥胖大鼠肝脏有一定程度的受损,并且肝脏中SOD、GSH-Px活性显著降低,MDA含量明显上升,经过泽泻治疗后,各组大鼠肝脏SOD、GSH-Px活性显著升高,MDA含量显著降低,肝脏组织受损情况也有所改善,说明泽泻对MSG大鼠肝脏有一定的保护作用,并且其作用机制可能与其增加肝脏抗氧化能力有关,是否是多靶点多途径还需进行进一步深入研究。
