假交替单胞菌GCY生物膜降解双酚A研究
2022-05-23吴硕,张兴文,吕菁萍,王竞
吴 硕, 张 兴 文, 吕 菁 萍, 王 竞
(大连理工大学 环境学院,辽宁 大连 116024 )
0 引 言
以药品及个人护理品、溴代阻燃剂和内分泌干扰物等为代表的微量有机污染物(organic micropollutants,OMPs),虽然在环境中处于低浓度水平,但因具有三致毒性、生长毒性以及生殖毒性等[1-2],极易对生态环境和人类健康造成危胁[3-5],从而引起了广泛关注.其中,双酚A(bisphenol A,BPA)作为一种典型的OMPs,被大规模应用于工业生产中.BPA可通过污水溢流、人类活动及地表径流等途径进入海洋环境[6-7].现阶段BPA已在全球海洋环境中被广泛检测到,浓度范围在10-9~10-6g·L-1[7-9].毒理学研究显示,BPA与雌性激素结构类似,是一类典型的内分泌干扰物,可对人类的生殖及免疫系统产生毒害作用[10].
生物降解则是自然环境中消除BPA的重要途径.已有研究指出,陆域真菌、陆域细菌等微生物可以实现BPA的生物降解[11-12].而海洋环境中普遍存在的各类微生物,也展现出对BPA的生物降解能力:Ying等[13]利用澳大利亚南部海岸海洋底泥微生物菌群,实现BPA的生物降解;Ben Ouada等[14]研究发现,皮囊藻对BPA存在良好的去除效果,可用作BPA的生物修复剂;Sakai等[15]则使用海水中分离出的纯菌Sphingomonassp.菌株BP-7降解BPA.在实际海洋环境中,大部分的海洋微生物都倾向于附着在海底礁石、动植物残骸等载体表面,以生物膜形式生长.生物膜则为微生物提供了稳定良好的生存环境,并可以影响微生物的代谢活性[16-17].因此,相较于游离细菌,以生物膜形式存在的海洋细菌可能显现出不同的污染物降解特性,进而影响物质归趋.但目前海洋细菌生物膜对海洋环境中BPA归趋的影响尚未见报道.
因此,本文选取海洋源假交替单胞菌GCY(Pseudoalteromonassp.,GCY)进行研究,该菌属广泛分布于全球海洋环境中,且菌株GCY在游离状态下可以产生活性氧(reactive oxygen species,ROS).对该菌株进行挂膜培养,以探究菌株GCY生物膜对BPA的降解特性和降解途径.
1 材料与方法
1.1 实验材料
(1)菌株

(2)培养基
菌株活化培养基为2216E培养基,配方为酵母浸粉1 g·L-1、蛋白胨5 g·L-1.降解实验所用的培养基均为酵母浸粉培养基,配方为酵母浸粉6 g·L-1.实验所用培养基均以人工海水为溶剂,并调节培养基的初始pH至8.0.
(3)载体材料
本实验采用泡沫炭作为生物膜培养的载体材料.
1.2 实验方法
1.2.1 生物膜培养 将菌体接种到100 mL无菌2216E培养基内,在25 ℃恒温摇床中以150 r·min-1的转速连续培养12 h,至菌体达到对数生长期再离心收菌,用无菌的人工海水冲洗菌饼备用.
生物膜的培养方法参照Li等的方法,并在此基础上做出改进[19-21].将泡沫炭裁剪成1 cm×1 cm×2 cm的小立方体,用超纯水清洗数次烘干后灭菌.使用支架固定,放置于100 mL酵母浸粉培养基中,将活化后的菌体接种到泡沫炭上.在恒温摇床内培养96 h,得到生物膜.
1.2.2 BPA降解实验 为探究附着态微生物与游离态微生物对不同污染物降解能力的差异,设置了如下实验对照组,每组设置3个平行:
(1)生物膜体系
按照前文所述方法培养生物膜后,取出生物膜并用无菌PBS溶液轻轻冲洗后,接种到添加了10 mg·L-1BPA的100 mL酵母浸粉培养基中.
(2)游离菌体系
游离态细菌活化后,取与生物膜相同的初始生物量接种到添加了10 mg·L-1BPA的100 mL 酵母浸粉培养基中.
整个降解实验在25 ℃恒温摇床(150 r·min-1)中进行,分别在细菌生长的对数期、稳定期取样,离心(10 000 r·min-1,5 min)后取上清液过0.22 μm滤膜,分别测定两个体系内的污染物浓度.
1.2.3 降解定位与活性物种鉴定 为确定BPA降解发生的位置,进行了降解定位实验:参照顾晨[22]的方法,获取胞内、胞周及胞外提取液,并向提取液中分别加入10 mg ·L-1的BPA.避光反应5 h后测定BPA浓度.

1.2.4 ROS及相关酶测定 在降解实验的同时,于对数期和稳定期进行取样测定胞外液中ROS生成情况及相关酶活性,测定方法如下:
(1)超氧阴离子自由基

(2)过氧化氢的测定
H2O2的测定使用DPD(N,N-diethyl-p-phenylenediamine)/POD(horseradish peroxidase)法[24].
(3)羟基自由基
•OH采用苯甲酸液相色谱法进行测定[25].
(4)L-氨基酸氧化酶(L-amino acid oxidase,LAAO)活性
向胞外液中添加等体积5 g·L-1的亮氨酸溶液,反应30 min后测定体系中H2O2的增量.
(5)铁载体
铁载体采用CAS法进行测定.向胞外液样品中加入等体积的CAS溶液,混匀放置30 min,以酵母浸粉培养基作为空白对照,在630 nm下测定吸光度.
1.2.5 BPA及降解产物测定 BPA使用高效液相色谱法进行测定[26],采用Elite C18色谱柱(5 μm,4.6 mm×250 mm),流动相A为甲醇,流动相B为超纯水,V(A)∶V(B)=80∶20,流动相流速为0.8 mL·min-1,柱温为40 ℃,紫外检测器在273 nm波长下进行测定.单个样品检测时间为10 min.并使用Origin软件进行降解动力学拟合,由于生物降解为单反应物反应体系,故通常选择一级反应动力学模型进行动力学拟合,拟合公式如下:
lnc/c0=-kt
式中:c为污染物在t时刻的浓度,c0为污染物的初始浓度,k为一级反应动力学常数,t为时间.
降解产物采用液相色谱-串联四极杆质谱联用仪(LC-MS)进行测定,生物膜体系在降解反应36 h及72 h后,离心取上清液过0.22 μm滤膜.色谱柱使用Xterra MS C18反相柱(5 μm,2.1 mm×100 mm,Waters,Milford,MA).流动相A为乙腈,流动相B为0.01%的氨水,V(A)∶V(B)=60∶40,流速为0.25 mL·min-1.检测模式为负模式.质谱离子源为电喷雾离子化源(ESI),以SCAN模式扫描,m/z扫描范围为80~400.鞘气为N2,流速为8.0 L·min-1.
2 结果与讨论
2.1 生物膜降解BPA动力学特性
实验结果表明,降解过程主要发生在12~48 h(图1(a)).游离菌体系在接入降解培养基的前12 h内,并未发生明显的降解反应,为降解停滞期;而生物膜体系却在12 h降解了13%的BPA,出现了降解提前的现象.并且在12~48 h,生物膜体系对BPA的降解效果始终优于游离菌体系.
对BPA生物降解过程进行动力学拟合,发现两体系中的降解过程均符合准一级反应动力学(图1(b)).生物膜体系与游离菌体系的降解速率常数分别为0.042 5 h-1和0.037 4 h-1,降解反应的半衰期t1/2分别为16.3 h和18.5 h.这表明生物膜体系相较于游离菌体系,可以更快速地降解BPA.
2.2 BPA生物降解定位与活性物种鉴定
首先通过降解定位实验,确定生物膜体系与游离菌体系的BPA生物降解位置.两体系的胞内和胞周提取液均无法降解BPA,但胞外液则可以降解BPA(图2).生物膜体系胞外液可降解73%的BPA,游离菌体系的胞外液可降解68%的BPA.由此推断,BPA的降解主要发生在胞外.

(a)BPA降解曲线

图2 不同细胞部分对BPA的降解Fig.2 BPA degradation by different cell fractions
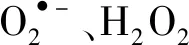

图3 活性物质淬灭实验的相对降解率RFig.3 Relative degradation efficiency R of quenching experiment for reactive substance
2.3 降解过程中ROS及相关酶

生物膜体系的H2O2产量始终高于游离菌体系,这一产量提升的现象在24 h及48 h尤为显著,分别提升了115%和45%(图4(a)).这也可以解释24 h时间点的淬灭实验中,H2O2主导的降解反应占比提升的现象.菌株GCY生成胞外H2O2的过程由LAAO参与[22],因此本实验考察了两体系的LAAO酶活性(图4(b)).菌株GCY在生长的各个阶段均检测到LAAO酶活性,且生物膜体系均高于游离菌体系.值得注意的是,在24 h生物膜体系内检测到的LAAO酶活性为游离菌体系的1.85倍,这也解释了24 h两体系中H2O2产量差异巨大的原因.

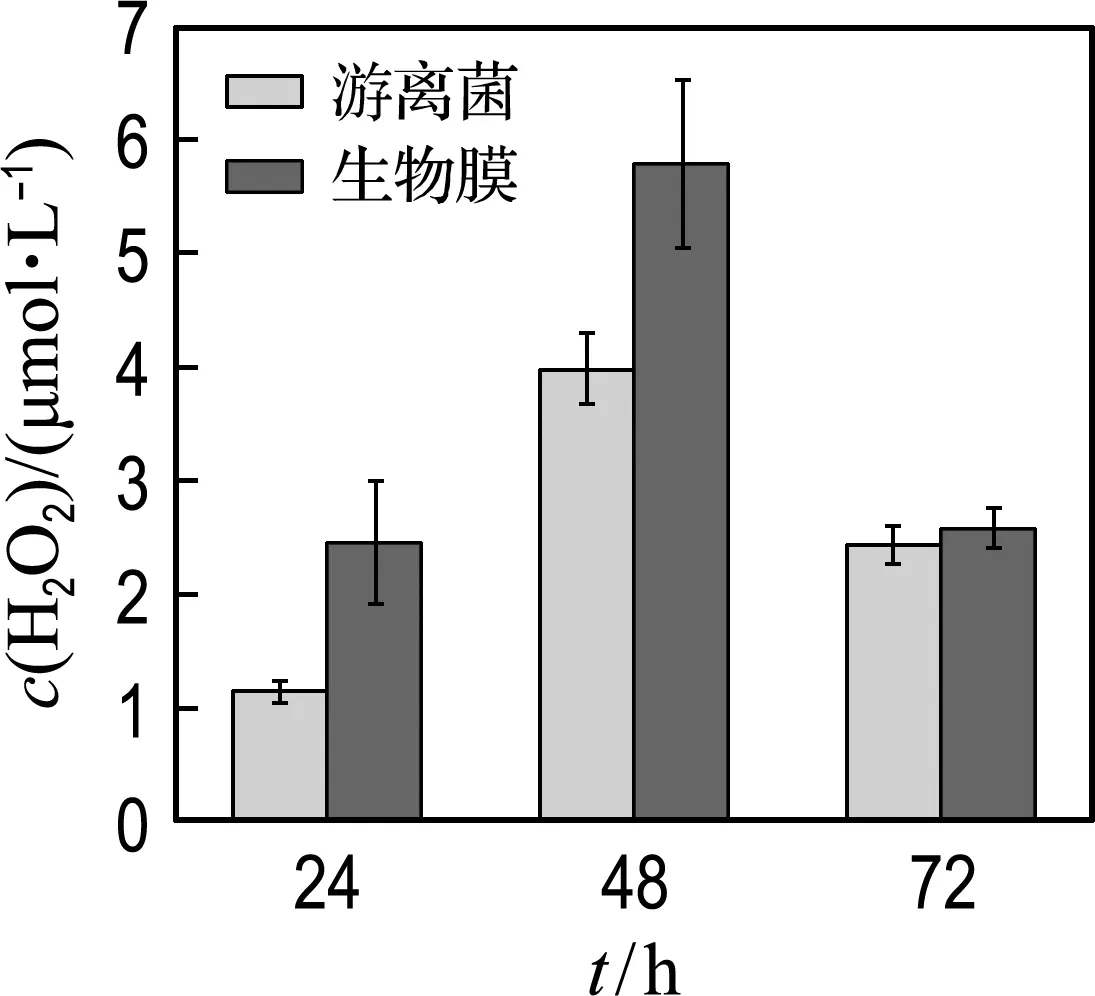
(a)菌株生长各个时期H2O2产量

图5 菌株GCY的胞外生成情况Fig.5 Extracellular production of strain GCY
研究指出H2O2可与Fe(Ⅱ)或铁载体络合的Fe(Ⅱ)发生类芬顿反应产生•OH并降解污染物[22].因此,测定了降解过程中的•OH与铁载体产量的变化(图6).在BPA存在的条件下,生物膜体系中的•OH产量最高可达0.55 μmol·L-1,为同时刻游离菌体系的1.3倍.在生物膜体系中检测到了更明显的铁络合现象.这表明生物膜体系相比于游离菌体系,铁载体活性更高.这与两体系中•OH 的生成趋势相一致.

(a)•OH产量
2.4 降解途径推测
对生物膜体系降解BPA的中间产物进行鉴定,并推测BPA的生物降解途径.共检测出5个BPA中间产物,分别为产物A、B、C、D、E,中间产物的m/z及命名如表1所示.

表1 BPA降解中间产物Tab.1 Intermediates detected in BPA degradation
首先•OH攻击BPA两苯环之间的C—C单键,发生异丙基断裂,生成对异丙基苯酚自由基(产物A)和苯酚(产物B),这与Dong等[29]利用高级氧化法去除BPA的反应途径相一致;产物A通过水合反应及脱氢反应生成对异丙烯基苯酚(产物C),产物C进一步反应生成对羟基苯丙酮(产物D),Li等[30]在利用过氧化物自由基去除BPA中也检测到产物C和产物D的存在;此外,异丙基苯酚自由基能进攻BPA苯环上羟基的邻位,生成4,4′-(4-羟基-1,3-苯基)双(丙-2,2-二基)双酚,此中间产物断键分解成苯酚和2-(4-羟基苯基),2-(2-羟基,5-叔丁基)丙烷(产物E),这一由自由基引发的反应过程已被报道[31-33].Lin等[34]对于BPA的降解路径分析中同样出现该反应通路及关键产物E.综上,生物膜体系降解BPA的途径为•OH攻击异丙基,致使异丙基断裂并进一步发生后续反应.这与已报道的高级氧化法降解BPA的途径类似,也进一步证明了假交替单胞菌GCY生物膜是通过产生胞外ROS以降解BPA.菌株GCY降解BPA途径推测见图7.

图7 菌株GCY降解BPA途径推测Fig.7 The proposed biodegradation pathway of BPA by strain GCY
3 结 语

