白芨多糖对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎治疗模型的优化和建立
2022-05-21余雪嫣李雨芯罗毅华
余雪嫣,黄 雪,李雨芯,罗毅华
(广西医科大学第一附属医院老年病学消化内科,广西南宁 530021)
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性炎症性疾病,病变主要累及结直肠黏膜及黏膜下层,表现有腹痛、腹泻、黏液脓血便及体重减轻等,严重影响患者生活质量。目前,UC 发病率逐年上升,因其反复发作,现有的治疗手段无法完全治愈,大部分患者须终身服药,已被世界卫生组织列为现代难治病之一[1]。近年由于我国民众的生活习惯和生存环境的改变,国家医疗诊断技术的标准化和规范化,UC 的检出率迅速上升[2]。迄今为止,UC 的病因尚未完全明确,目前认为可能由环境、肠道菌群、结肠免疫功能异常等多重因素相互影响[3]。因此,开展UC 的发病机制及药物治疗方面研究日益迫切。动物模型是研究过程中不可或缺的手段,构建理想且成熟稳定的动物模型对UC 发病机制、疾病发展规律、诊疗手段及新药的研究和开发均有重要的研究意义。
白芨是一种传统中药,具有止血、消肿和促进组织再生等功效,广泛用于临床,已有文献报道临床上应用白芨联合其他中药或西药治疗UC 患者均取得了较好的疗效[4]。白芨多糖(Bletilla striata polysaccharide, BSP)是一种水溶性多糖,是白芨的主要生物活性物质,具有抗炎、抗溃疡、保护黏膜、促进伤口愈合及免疫调节活性等多种药理作用,提示BSP 在临床中具有广泛的应用前景及研究价值[5]。已有研究表明,BSP 对UC 动物模型具有良好的治疗作用,但BSP 对UC 的作用机制尚未完全明确,具有广阔的研究空间。
目前研究BSP 对UC 作用的文献中,对于UC 动物模型的选择尚不统一。黎笑兰等[6]采用三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)作用于SD大鼠,柯昌毅等[7]和时松等[8]选用恶唑酮(oxazolidone, OXZ)作用于不同品系的小鼠,而王川[9]采用乙醇作用于SD 大鼠。各个模型使用的药物和操作手法差别过大,很难保证实验的稳定性和可靠性。同时,以上文献在进行BSP 对UC 作用研究时,对BSP浓度的选择也差别较大,对最佳药物浓度并未探讨。本研究通过数次实验探索,旨在建立最佳的UC 动物模型,并寻找BSP 对该模型最佳的作用条件和剂量,有利于后续研究者直接快速地建立模型,减少花费并提高效率。
1 材料与方法
1.1 动物与试剂
健 康SPF 级C57BL/6 小 鼠48 只,雄 性,8 周 龄,体质量22~24 g,由广西医科大学动物实验中心提供,许可证号:SCXK 桂2014-0002。室内温度21~25 ℃,相对湿度(50±10)%,12 h 光照/黑暗循环,按照3R原则对实验动物给予人道关怀。BSP(纯度70%,上海源叶生物科技有限公司),DSS(分子量36~50 ku,美国MP Biomedicals),柳氮磺吡啶肠溶片(Salazosulfapyridine, SASP,上海信谊天平药业有限公司),大便隐血测定试剂盒(干化学法,美利泰格诊断试剂(嘉兴)有限公司),Claudin-1单克隆抗体(Abcam公司),GAPDH抗体(Cell Signaling Technology 公司)等。
1.2 实验分组及药物干预
将小鼠随机分为正常对照组、DSS 模型组及BSP 低、中、高剂量组和SASP 阳性对照组,每组各8 只,适应性喂养1 周。将DSS 溶于蒸馏水中配制成25 g/L 的DSS 溶液,且每2 天配制1 次新鲜的DSS 溶液,除正常对照组给予蒸馏水外,其余各组均采用自由饮用25 g/L 的DSS 溶液以诱导建立小鼠UC模型;连续饮用7 d,第8天开始全部换成蒸馏水。BSP 低、中、高(95、190、380 mg/kg)剂量组和SASP(320 mg/kg)阳性对照组在造模第2 天即开始灌胃给药,灌胃量根据体质量以10 μL/g 计算;正常对照组和DSS 模型组同样按该比例灌胃生理盐水;每天1 次,连续7 d,并保证每天给药均在同一时段。
1.3 一般情况的观察
实验期间,每天观察并详细记录各组小鼠的一般情况、活动反应、精神状态、体毛色泽、进食、饮水、体质量变化、大便性状、大便隐血/肉眼便血情况。比较各组小鼠的每日体质量变化百分比(%)(每只每天同时段体质量/第1 天体质量)。
1.4 标本的采集处理及评估观察
经禁食12 h,于造模第9 天采用40 mL/L 的水合氯醛腹腔注射麻醉后处死。乙醇消毒腹部,用高压消毒后的器械分离肛门至回盲部肠管,测量结肠长度,沿肠系膜缘纵轴剖开后迅速用4 ℃的生理盐水将结肠冲洗干净,将结肠平铺于干燥滤纸上,肉眼观察并拍摄记录小鼠结肠炎症严重程度及溃疡情况,后续采用COOPER 等[10]评分标准,综合体质量变化、大便性状和大便隐血/肉眼便血情况对各组小鼠每天情况进行DAI 评分。
选取病变明显结肠段分成两份,一份立即放入液氮中,过夜后转移至-80 ℃超低温冰箱保存备用;另一份置于40 g/L 的多聚甲醛固定液中固定24 h,常规制作4 μm 石蜡切片,经HE 染色后在光学显微镜下观察结肠组织形态学变化,并根据SHI 等[11]的评分标准对小鼠结肠组织切片进行组织病理学评分。
器械分离脾脏后,用滤纸吸干并称重,计算脾脏指数。脾脏指数=脾脏质量(mg)/小鼠体质量(g)。
1.5 Western blotting 法检测小鼠结肠组织紧密连接蛋白Claudin-1 的表达
取小鼠结肠组织,用RIPA 裂解液裂解后匀浆,提取小鼠结肠组织总蛋白,并用BCA 法测得蛋白浓度;用120 g/L 的SDS-PAGE 电泳分离蛋白,将蛋白转移至PVDF 膜后,在50 g/L 的脱脂牛奶中于摇床上室温封闭1 h,然后将膜分别置于Claudin-1(1∶800)和GAPDH(1∶10 000)的一抗中4 ℃冰箱孵育过夜;次日,将膜置于荧光二抗(山羊抗兔IgG),摇床室温避光孵育1 h 后,用近红外荧光法,将膜放于Odyssey 双色红外激光扫膜仪,采用Licor Odyssey V3.0 软件扫描图片,再用ImageJ 软件对条带进行评估和量化。
1.6 统计学分析
数据均采用SPSS 25.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示。数据同时满足正态分布和方差齐性条件时,采用单因素方差(ANOVA)分析,并采用LSD-t法进行两两比较;当数据不满足正态分布和方差齐性时,采用非参数检验中的Kruskal-WallisH检验,多个样本间的两两比较采用Nemenyi 法。P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠的一般情况
正常对照组小鼠活动正常,反应灵敏,精神状态佳,毛发有光泽;进食饮水正常,体质量呈上升趋势;排便成型,无血便。DSS 模型组小鼠逐渐精神萎靡,反应迟钝,倦怠懒动,毛发渐渐失去光泽;进食减少,体质量明显下降,逐渐出现大便隐血阳性或肉眼血便,部分有稀水样便,提示造模成功。BSP 低、中、高剂量组小鼠在给药干预后,上述表现较DSS 模型组均得到改善,而BSP 高剂量组改善最为明显。
2.2 小鼠体质量的变化
实验结束时,与正常对照组相比,DSS 模型组小鼠体质量明显降低(P<0.01);与DSS 模型组相比,BSP高剂量组小鼠体质量降低程度明显减小(P<0.05,图1,表1)。
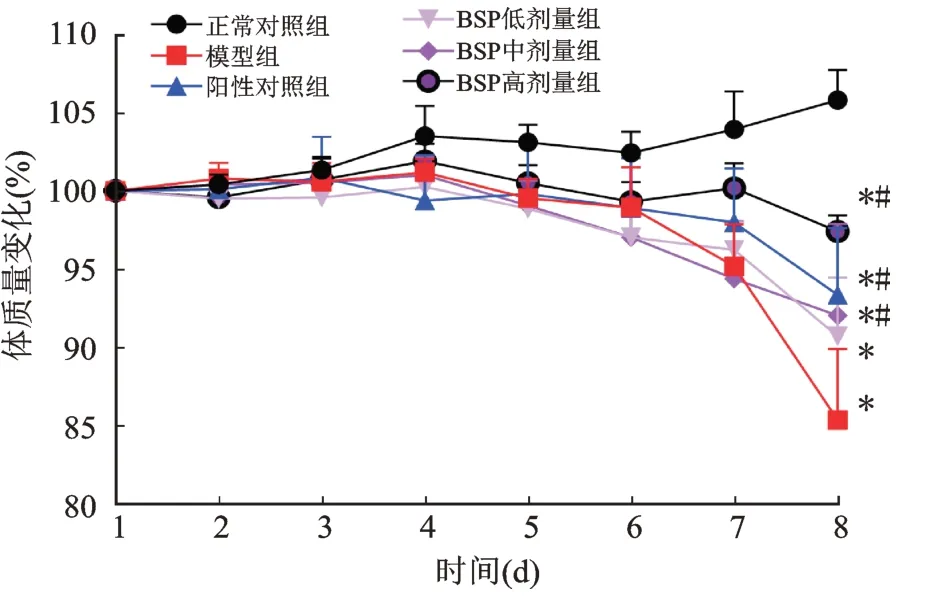
图1 BSP 对UC 小鼠体质量的影响Fig.1 Effect of BSP on body weight of UC mice
2.3 各组小鼠DAI 评分的比较
实验结束时,DSS 模型组小鼠DAI 评分较正常对照组显著增加(P<0.01);与DSS 模型组比较,BSP 高剂量组小鼠DAI 评分明显降低(P<0.05,表1,图2)。

图2 BSP 对UC 小鼠DAI 评分的影响Fig.2 Effect of BSP on DAI score of UC mice
表1 各组小鼠体质量变化百分比和DAI 评分的比较Tab.1 Percentage of body mass change and DAI score of UC mice (±s, n=8)

表1 各组小鼠体质量变化百分比和DAI 评分的比较Tab.1 Percentage of body mass change and DAI score of UC mice (±s, n=8)
与正常对照组比较,*P<0.01;与DSS 模型组比较,#P<0.05。
组别正常对照组DSS 模型组SASP 阳性对照组BSP 低剂量组BSP 中剂量组BSP 高剂量组体质量变化(%)105.82±1.92 85.35±4.53*93.35±4.28*#90.71±3.76*92.03±5.85*#97.41±1.02*#DAI 评分0.00±0.00 3.98±0.78*2.78±0.50*#3.39±0.25*2.50±0.81*#2.17±0.43*#
2.4 各组小鼠脾脏指数的比较
与正常对照组比较,DSS 模型组小鼠脾脏肿大,脾脏指数明显升高(P<0.01);与DSS 模型组比较,BSP 低、中、高剂量组小鼠脾脏肿大缓解,脾脏指数均降低(P<0.05,图3 和表2)。

图3 BSP 对UC 小鼠结肠和脾脏的影响Fig.3 Effect of BSP on the colon and spleen of UC mice
2.5 各组小鼠结肠组织的大体形态改变及长度变化
正常对照组小鼠结肠长度正常,无充血水肿和溃疡;与正常对照组比较,DSS 模型组小鼠结肠长度显著缩短(P<0.01),结肠充血红肿明显,局部有糜烂、出血,内壁可见浅溃疡灶,病变累及整段结肠;与DSS 模型组比较,BSP 低、中、高剂量组小鼠结肠缩短程度均有减小(P<0.05),结肠充血红肿的症状均有减轻,内壁溃疡灶明显缓解,以BSP 高剂量组最为明显(图3 和表2)。
表2 BSP 对UC 小鼠结肠长度和脾脏指数的影响Tab. 2 Effect of Bletilla striata polysaccharide on colon length and spleen index of UC mice (±s, n=8)
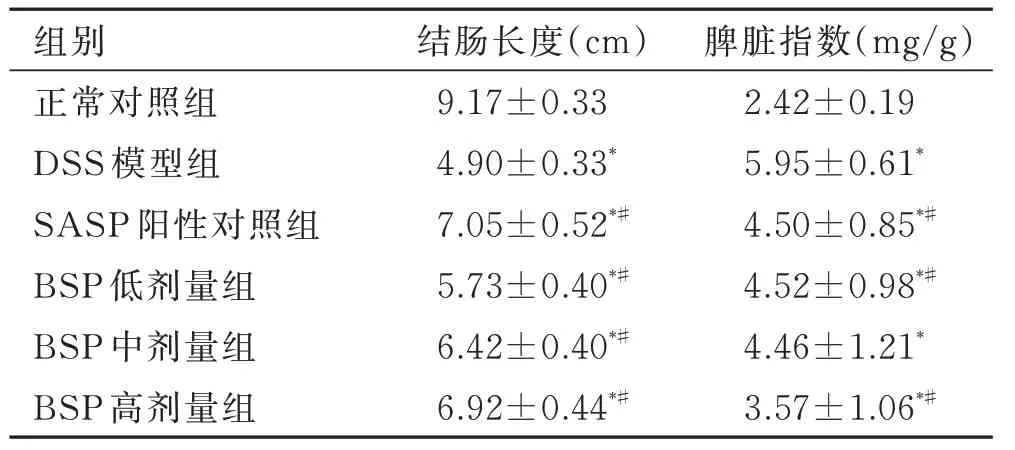
表2 BSP 对UC 小鼠结肠长度和脾脏指数的影响Tab. 2 Effect of Bletilla striata polysaccharide on colon length and spleen index of UC mice (±s, n=8)
与正常对照组比较,*P<0.01;与DSS 模型组比较,#P<0.05。
组别正常对照组DSS 模型组SASP 阳性对照组BSP 低剂量组BSP 中剂量组BSP 高剂量组结肠长度(cm)9.17±0.33 4.90±0.33*7.05±0.52*#5.73±0.40*#6.42±0.40*#6.92±0.44*#脾脏指数(mg/g)2.42±0.19 5.95±0.61*4.50±0.85*#4.52±0.98*#4.46±1.21*3.57±1.06*#
2.6 各组小鼠结肠组织的病理学评估
HE 染色结果显示(图4),正常对照组小鼠结肠黏膜上皮结构完整,腺体结构完整且排列整齐,基本不见炎性细胞浸润;DSS 模型组小鼠结肠黏膜上皮严重破坏、结构紊乱,腺体呈现变形甚至消失,隐窝萎缩扭曲,黏膜及其下层可见大量炎性细胞浸润,偶有隐窝脓肿形成,提示成功构建小鼠UC 模型。根据SHI 等[11]的评分标准,综合炎症程度、损伤深度、隐窝损伤程度对小鼠结肠组织切片进行组织病理学评分,每个组织切片随机选取3 个以上高倍视野(×200),由2 人进行盲法评分,取平均值作为最终结果。与正常对照组比较,DSS 模型组小鼠结肠组织病理学评分明显升高(P<0.01);与DSS 模型组比较,BSP 低、中、高剂量组小鼠结肠黏膜损伤程度均得到改善,组织病理学评分均有降低(P<0.05),BSP 高剂量组降低最多,改善也最为明显(表3)。

图4 各组小鼠结肠组织的病理学改变Fig.4 The histopathological changes of the colon in mice of each group(HE staining,×200,ruler=50 μm)
表3 BSP 对UC 小鼠结肠组织病理学评分的影响Tab. 3 Effect of Bletilla striata polysaccharide on colonic histopathological score of UC mice (±s,n=8)

表3 BSP 对UC 小鼠结肠组织病理学评分的影响Tab. 3 Effect of Bletilla striata polysaccharide on colonic histopathological score of UC mice (±s,n=8)
与正常对照组比较,*P<0.01;与DSS 模型组比较,#P<0.05。
组别正常对照组DSS 模型组SASP 阳性对照组BSP 低剂量组BSP 中剂量组BSP 高剂量组组织病理学评分1.11±0.75 9.11±0.83*5.28±0.68*#7.00±0.81*#5.50±0.96*#3.99±0.99*#
2.7 BSP对UC小鼠肠道Claudin-1蛋白表达的影响
Western blotting 检测结果显示,与正常对照组比较,DSS 模型组肠道紧密连接蛋白Claudin-1 表达明显下降(P<0.01);与DSS 模型组比较,BSP 低、中、高剂量组紧密连接蛋白Claudin-1 表达均明显增加(P<0.05),其中BSP 高剂量组表达最接近正常组(图5)。
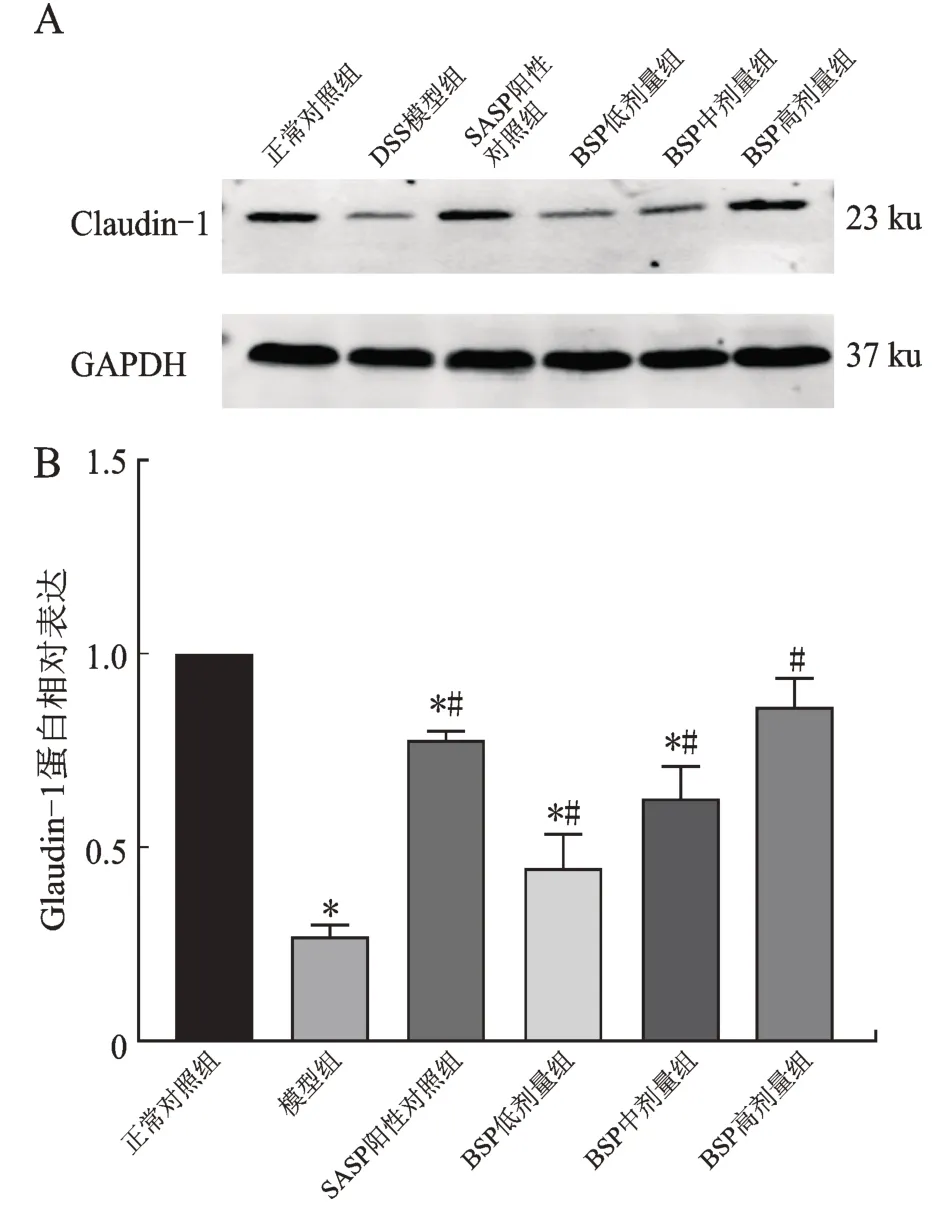
图5 各组小鼠结肠组织紧密连接蛋白Claudin-1 蛋白表达的比较Fig.5 Comparison of tight junction protein Claudin-1 expression in mouse colon
3 讨 论
在开展实验研究前应根据研究方向及实际可行性等,应充分考虑动物模型和造模方式的选择。选择合适的造模对象,摸索出可靠的造模浓度和方式等,有助于节省时间人力,建立高成功率的UC 模型。
目前,国内外对UC 动物模型研究颇多。基因修饰法对技术和条件要求高,价格昂贵,且多为单一基因模型,无法完全模拟人类UC 疾病。自发型动物来源稀少,价格更贵。免疫诱导法造模周期长,操作复杂,对技术和条件要求也较高,成功率低。由于化学药物诱导UC 模型的廉价、造模方法简便、成功率较高,而被广泛应用。既往研究中,王川[9]采用乙酸诱导UC 模型,但该模型是利用其直接刺激作用而引起结肠出现急性化学损伤的单纯性炎症反应,不能反映免疫学变化,且自愈性强,易导致与药物疗效评价相混[12];黎笑兰等[6]选用的TNBS 诱导大鼠UC 模型,炎症时间长,缺乏急性期表现[13],且TNBS 模型免疫反应以Th1、Th17 反应为主,组织学改变主要是跨膜炎症和水肿[14],与人类克罗恩病症状相似,故不适用于UC 的研究;柯昌毅等[7]和时松等[8]采用的OXZ 诱导UC 模型,建立的疾病维持时间短、自愈性强,同时还需进行皮肤预致敏操作[15],故亦不做优选。DSS 是一种易溶于水的肝素样硫酸多糖,能抑制血液凝固、血小板聚集、增强纤维蛋白溶解作用及结肠黏膜组织缺氧,加重肠道出血、产生血便[16],便于直观观察是否造模成功。DSS 诱导UC 模型方法简便,结果可靠,易于复制,周期可长可短,维持性好,不需灌肠等有创操作,经过多年摸索,建模成功率最高,并且其诱导所致的上皮破坏、局灶性病变和浅表炎症类似于UC 在人体中的表现[17]。DSS 可从多方面破坏肠上皮屏障紧密连接结构,使肠黏膜屏障通透性增加,以致菌群和大分子物质进入黏膜或黏膜下层,进而引发一系列炎症反应。这种病理性的定植侵入会刺激先天和适应性免疫应答,上调多种促炎细胞因子和趋化因子的分泌,激活某些通路,类似人类UC 发病机制,是目前最为理想的UC 模型,可作为后续研究人类UC 的免疫机制奠定实验基础[18]。故本实验选此方法进行造模。
不同种属和种系的动物对DSS 易感性不同,临床表现、炎症程度和病变部位也不同。在既往文献中,黎笑兰等[6]和王川[9]选用SD 大鼠,柯昌毅等[7]、时松 等[8]、崔 向 磊[19]分 别 选 用KM 小 鼠、NIH 小 鼠 和BALB/c 小鼠,研究对象未形成统一。经文献证实,C57BL/6J 小鼠对DSS 诱导的结肠炎敏感,其病变主要集中在中远端结肠,表现为出血、腹泻、溃疡、淋巴细胞和中性粒细胞浸润,与人类UC 临床和组织学表现相似[20]。同时C57BL/6J 来源充足且费用低廉、适应环境能力强、样本量大、体型小、易饲养操作,故本实验选其作为实验对象。
既往研究证明,用分子量较小(40 ku)的DSS 处理小鼠可出现结肠炎症状,而使用分子量较大(500 ku)的DSS 则无上述表现。另有研究证明,用分子量5 ku和40 ku 的DSS 分别诱导结肠炎,后者较前者病变重,且病变主要在远端结肠,所造成的病理变化与人类结肠炎相似[21]。因此,本实验选择36~50 ku 的DSS 进行造模,其可靠性优于崔向磊等[19]使用分子量为5 ku 的DSS 所诱导的UC 模型。
DSS 浓度是实验成功至关重要的因素。DSS 造模通常采用给予20~50 g/L DSS溶液自由饮用5~7 d。一般在给药后2~3 d 就可出现大便潜血阳性和腹泻;随后症状加重,或有肉眼血便,体质量明显下降,直至6~7 d 出现明显的结肠炎症状,符合UC 模型急性期的表现[22]。本实验经过多次摸索,最终使用25 g/L 的DSS 很好重复了前述症状。
DSS 给药方式多为自由饮用,有学者质疑该方法会因小鼠饮水量的差异造成DSS 摄入量不同而导致组内差异较大。但目前已有多项研究表明,DSS诱导UC 小鼠模型的结肠黏膜损伤程度主要取决于DSS 浓度,而非摄取的DSS 总量[23]。当造模小鼠DSS 总摄取量超过最低阈值后,即可成功建立急性UC 模型。另有研究者探究了自由饮用和灌胃的差异,结果显示DSS 灌胃造模的效果并不及自由饮用法,这可能是小鼠自由饮用方式的摄入缓慢持久,可长久刺激机体的结果;灌胃法药物代谢速度快,虽给药量大,但刺激时间短,效果不佳[24]。
目前UC 尚无特异的治疗方法,西医主要运用5-氨基水杨酸、糖皮质激素及免疫抑制剂进行治疗,虽起效快、短期临床缓解率高,但维持缓解治疗长达数年甚至终身,停药易复发,不良反应多,治标不治本[25]。中药价廉易得、资源丰富、应用广泛,已有不少从传统中药中分离出的天然产物已被临床研究及基础实验证实对UC 具有有益作用。随着药理学的发展,研究者发现一些中药有效成分(如多糖类等)在治疗UC 上取得了一定的效果。BSP 作为白芨的主要成分,不仅有止血、促进骨髓造血、促进创伤愈合、保护胃黏膜、抗溃疡、抗氧化、抗衰老、免疫调节等作用,并且具有自身降解性,无毒副作用,有良好的生物相容性[19]。本实验结果显示,BSP 对UC 有治疗作用。与正常对照组相比,BSP 高剂量组体质量下降不明显、结肠长度缩短不明显、DAI 评分升高减少、结肠组织病理学评分较低,整体作用效果甚至略优于SASP阳性对照组,这从多个角度提示380 mg/kg 的BSP 对UC 具有最佳的治疗效果,是后续研究者可供选择的最佳给药浓度。
大量研究表明,肠上皮屏障功能障碍与UC 的进展有着密不可分的关系。紧密连接是肠上皮屏障的最重要组成部分,对于维持肠上皮屏障的正常功能至关重要[26]。Claudin-1 作为肠上皮屏障紧密连接中的重要蛋白,可通过检测Claudin-1 的表达观察BSP 对肠道屏障的作用,探讨其对UC 的作用。本研究用Western blotting 检测各组小鼠结肠组织紧密连接蛋白Claudin-1 的表达,从蛋白水平证明高剂量的BSP 可明显增强肠道屏障功能从而对结肠炎有明显治疗效果,更进一步明确了高浓度BSP 是治疗UC 的优选。
作为一种低价且疗效甚佳的中药制剂,BSP 具有广阔的研究前景。本研究探索BSP 治疗UC 小鼠的最佳动物模型和药物干预浓度,为进一步研究BSP 对UC 的作用打下基础。本研究既建立了具有典型病理改变的UC 动物模型,又找到了合适有效的BSP 药物干预浓度,在节约资源的同时又具有发展价值,具有一定的社会经济效益。
