青藤碱调节胃癌细胞诱发的巨噬细胞M2 极化的机制
2022-05-21陈昳菲任牡丹卢新兰卢桂芳李雅睿和水祥
陈昳菲,任牡丹,卢新兰,卢桂芳,张 丹,赵 艳,李雅睿,郭 丹,和水祥
(西安交通大学第一附属医院消化内科,陕西西安 710061)
胃癌是全球第五大常见癌症和第三大癌症死亡原因[1]。由于内镜下或外科手术切除等治疗方式的发展,早期胃癌患者的5 年生存率可达95%以上,但我国大多数患者在诊断时已是中晚期[2]。晚期胃癌的预后较差,姑息性化疗是主要的治疗方法,临床仍需要探索更多新的治疗办法来改善生存期,提高生存率[3]。
越来越多的证据支持,肿瘤微环境(tumor microenvironment, TME)中的肿瘤相关细胞(TAM)的高密度与胃癌患者预后不良之间存在正相关[4]。TAM通常起源于循环单核细胞,可以在TME 内通过肿瘤细胞产生的细胞外信号募集,这些信号可能将TAM从抑制肿瘤的M1 表型转化为促进肿瘤的M2 表型巨噬细胞[5-6],而巨噬细胞反过来影响肿瘤的生长[7-8]。值得注意的是,很多研究都证明,驱动巨噬细胞M2极化可能促进胃癌细胞的增殖或者调节其活力、侵袭和迁移[9-11]。
青藤碱(sinomenine, SIN)是一种从中药植物青藤中提取的生物活性碱化合物,盐酸青藤碱是其水溶性盐酸盐(图1A)。SIN 具有不同的治疗特性,包括抗炎和免疫抑制活性[12],还是一种多靶点抗肿瘤天然物质[13]。已有研究证明了SIN 在胃癌中的关键作用[14-15],同时它还可以调节巨噬细胞亚群的分泌[16],暗示了SIN 通过影响肿瘤微环境而在胃癌进展中发挥潜在作用。但是,SIN 在胃癌中的作用仍是不清楚的。本文旨在研究SIN 在胃癌细胞增殖和迁移中的作用,并通过探索其在胃癌细胞诱导的巨噬细胞极化中的作用及机制,阐述SIN 对胃癌肿瘤微环境的影响,进一步探讨其在胃癌治疗中的潜在价值。
1 材料与方法
1.1 细胞系及试剂
人胃癌细胞BGC-823 与MKN-45(上海生命科学研究院),SIN(湖南正清药业公司),二甲基亚砜(DMSO)(上海碧云天),DMEM 培养基(Gibco),胎牛血清(杭州四季青),胰蛋白酶(Sigma),CCK-8 试剂盒(上海碧云天),SDS-PAGE 凝胶试剂盒(上海碧云天),核蛋白提取试剂盒(上海碧云天),BCA 二辛可宁酸蛋白质测定试剂盒(上海碧云天),蛋白质多克隆 一 抗Ki67、STAT-6、p-STAT6、C/EBPβ、p-C/EBPβ、Lamin B(Abcam 公司)、辣根过氧化物酶标记的二抗(壮志生物公司),Transwell 共培养室(Corning 公司),PMA 佛波醇12-肉豆蔻酸酯13-乙酸酯(Sigma 公司),胶原酶细胞解离液(Invitrogen 公司),巨噬细胞标记物抗人抗体CD14(APC/Cy7,Biolegend)、CD163(BV510,BD Bioscience BD OptiBuild)、CD206(PE-Cy5,BD Biosciences, BD Pharmigen)、LIVE/DEAD ™Viability/Cytotoxicity Kit(Invitrogen公 司),细 胞 总RNA 提 取 试 剂Trizol(Invitrogen 公司),限制性内切酶、凝胶回收试剂盒、TaqDNA 聚合酶(TaKaRa 公司),PCR 反转录试剂盒、实时荧光定量PCR(RT-qPCR)试剂盒及引物(TaKaRa 公司),Human IL-6 ELISA 试剂盒(碧云天)。
1.2 方法
1.2.1 细胞培养及STAT6 重组载体的构建 人胃癌细胞BGC-823、MKN-45 和单核细胞系THP-1采用含100 mL/L 胎牛血清的DMEM 培养基培养于50 mL/L CO2、湿度95%、37 ℃的恒温培养箱中。重组载体构建:Trizol 试剂用于从胃癌细胞BGC-823中提取总RNA;根据SuperScript ⅡFirst-Strand Synthesis System(Invitrogen)提供的说明书合成cDNA;通过PCR 合成人类全长信号转导及转录激活蛋白6(STAT6)cDNA;将STAT6 cDNA 回收并插入pCDNA3.1(+)质粒(Invitrogen)以生成STAT6 重组质粒(rSTAT6)。质粒送测序验证序列。使用0.5 μg rSTAT6 载体或空载体用Lipofectamine 2000(Invitrogen)转染胃癌细胞BGC-823 和MKN-45。通过RTqPCR 法 及Western blotting 评 估rSTAT6 转 染 的效果。
1.2.2 CCK-8 法测定细胞活力 对数期生长的人胃癌细胞BGC-823 和MKN-45 细胞经消化、离心后,以8 000/孔接种至96 孔板,24 h 后,分别加入含有0~1 000 μmol/L SIN 的培养基。大约24 h 后,将10 μL CCK-8 试剂进一步补充到每孔培养基中培养1.5 h。随后,测定450 nm 处的A 值来评估细胞活力。
1.2.3 克隆形成实验测定细胞增殖能力 对数期生长的人胃癌细胞BGC-823 和MKN-45 以500/孔接种至6 孔板中,实验组培养基中含有50 μmol/L SIN,对照组中加入等量DMSO,培养14 d后,用5 g/L结晶紫固定染色。
1.2.4 共培养和Transwell小室迁移实验 使用Transwell共培养室进行胃癌细胞BGC-823、MKN-45 和巨噬细胞的共培养。将50 μmol/L SIN、rSTAT6质粒或外源性IL-6(10 ng/mL)预处理的胃癌细胞接种到下室。在上室铺板之前,通过用50 nmol/L PMA 孵育24 h 将THP-1 单核细胞诱导为M0 巨噬细胞。48 h后,小室用40 g/L 多聚甲醛固定15 min,结晶紫染色20 min,PBS清洗2次,然后在显微镜下拍照计数。
1.2.5 流式细胞术评估巨噬细胞极化 在与胃癌细胞BGC-823和MKN-45共培养48 h后,收集THP-1巨噬细胞。将细胞与荧光偶联的抗人APC-CD14 抗体和FITC-CD206抗体CD14(APC/Cy7)、CD163(BV510)、CD206(PE-Cy5)、LIVE/DEAD™Viability/Cytotoxicity Kit 一起孵育30 min 后,冲洗细胞并用FACScan流式细胞仪和FlowJo 软件(Becton, Dickinson &Company)进行分析,以评估巨噬细胞M2 极化。
1.2.6 RT-qPCR 法检测基因的相对表达水平 用Trizol 试剂提取样本总RNA,紫外分光光度计检测浓度及纯度。应用反转录试剂盒将RNA 反转录为cDNA,实 时定量PCR 在Bio-Rad C1000 PCR 仪上进行,每样本设3 个复孔,反应条件:95 ℃30 s,95 ℃10 s,58 ℃5 s,扩增40 个循环。基因表达情况采用2-△△Ct法进行数据分析。所有实验重复3 次。引物序列见表1。

表1 引物序列表Tab.1 Primer sequence
1.2.7 Western blotting检测蛋白的相对表达水平 细胞用RIPA 裂解缓冲液裂解,使用核蛋白提取试剂盒制备核蛋白,BCA 蛋白浓度测定试剂盒测定所提取蛋白浓度。行SDS-PAGE 凝胶电泳,每孔道上样40 μg,恒压2 h,湿法转膜至PVDF 膜上,恒流2 h。用含有50 g/L 脱脂牛奶的Tris 缓冲盐水(TBS)封闭1 h,分别加入1∶1 000 稀释的对应一抗4 ℃过夜。用TBST 充分洗涤后,加入1∶2 000 稀释的辣根过氧化物酶偶联的二抗室温孵育2 h,TBST 充分洗涤。然后使用ECL 检测试剂显影,ImageJ 软件进行灰度分析。Lamin B 用于细胞核中基因表达的内参,β-actin用于其他基因的内参。
1.3 统计学处理
数据以均数±标准差(±s)表示,应用SPSS 22.0统计学软件对数据进行分析。生物学实验均重复3 次。两组间均数比较采用独立样本t检验,多组间均数比较或多组间的两组比较应用单因素方差分析(one-way ANOVA),事后比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 SIN 抑制胃癌细胞增殖
用0~1 000 μmol/L SIN 处 理 胃 癌 细 胞BGC-823 和MKN-45,SIN 剂量依赖性地抑制了胃癌细胞的活性(图1B)。经过50 μmol/L SIN 处理后的胃癌细胞中增殖相关蛋白Ki67 的表达下调(图1C)。与此同时,克隆形成实验也证明了低剂量SIN(50 μmol/L)处理后的胃癌细胞凋亡增加(DMSO 组vs.SIN 处理组,P<0.05)(图1D)。

图1 青藤碱对胃癌细胞增殖的影响Fig.1 The effect of sinomenine on the proliferation of gastric cancer cells
2.2 SIN 抑制胃癌细胞募集巨噬细胞并抑制其M2型极化
首先建立了胃癌细胞与THP-1 巨噬细胞的Transwell 小室共培养(CC,co-culture)系统,并在肿瘤作用下评估了SIN 对巨噬细胞的招募和极化作用。胃癌细胞可以募集PMA 诱导的巨噬细胞,而在SIN处理肿瘤细胞后再与THP-1 共培养,这种募集能力减弱了(图2A)。与胃癌细胞的共培养提高了THP-1巨噬细胞中CD14+CD206+细胞的百分比(图2B),诱导M2 型 极 化,M2 标 志 物CD163、CD206 的 平 均 荧光强度升高,在SIN 处理后胃癌细胞的诱导能力明显减弱,M2 标志物CD163、CD206 的平均荧光强度也被抑制(图2C)。用SIN 处理胃癌细胞降低了巨噬细胞抗炎标志物CCL22 和Arg1 的mRNA 表达,促进了免疫抑制性炎症因子TGF-β 和IL-10 的产生(图2D)。

图2 青藤碱对胃癌细胞诱导巨噬细胞募集和M2 极化能力的影响Fig.2 The effect of sinomenine on the ability of gastric cancer cells in inducing macrophage recruitment and M2 polarization
2.3 SIN抑制了STAT6的表达及C/EBPβ的表达和入核
SIN 降 低 了 胃 癌 细 胞 中STAT6 和C/EBPβ 在mRNA 水平的表达(图3A、图3B)和在蛋白水平的表达,同时胃癌细胞核中CAAT 增强子结合蛋白β(C/EBPβ)的 蛋 白 表 达 下 调(图3C)。C/EBPβ 的Ser299磷酸化对其自身的核易位至关重要[17],在SIN 的处理后,降低了C/EBPβ 的总蛋白表达水平,同时也抑制了磷酸化(图3C、图3D)。

图3 青藤碱对胃癌细胞中STAT6 和C/EBPβ 的影响Fig.3 The effects of sinomenine on STAT6 and C/EBPβ in gastric cancer cells
2.4 STAT6 过表达可降低SIN 对胃癌细胞募集巨噬细胞和对M2 型极化的抑制作用
用重组STAT6 质粒转染后,显著提高了胃癌细 胞 系 中STAT6 和C/EBPβ 的mRNA 表 达 水 平(图4A、图4B),以及蛋白质水平(图4C)。对于巨噬细胞招募功能的分析,证实了SIN 对胃癌细胞诱导的巨噬细胞募集功能的抑制作用,STAT6 过表达阻断了SIN 对肿瘤的抑制(图4D)。同时,STAT6 的过表达还会降低SIN 对肿瘤诱导CD14+、CD206+巨噬细胞的抑制作用(图4E)。相比较于SIN 处理后的胃癌细胞共培养的巨噬细胞,STAT6 过表达后M2 巨噬细胞标志物表达显著上调(图4F)。

图4 STAT6 介导了青藤碱对胃癌细胞诱导巨噬细胞募集和M2 型极化的抑制作用Fig. 4 STAT6 mediated the inhibitory effect of sinomenine on gastric cancer cell-induced macrophage recruitment and M2-type polarization
2.5 STAT6 在胃癌细胞中释放IL-6 是造成SIN 介导的巨噬细胞募集和M2 极化的原因
SIN 降低了IL-6 的mRNA 表达水平和在胃癌细胞中的含量,但是当STAT6 过表达后这种影响被逆转(图5A、图5B)。而IL-6 抗体对其自身的抑制,显著减轻了由SIN 介导的胃癌细胞引发的对巨噬细胞募集的抑制作用(图5C)。此外,与IL-6 抗体共同孵育使在与胃癌细胞共培养的巨噬细胞中CD14+、CD206+细胞百分比下降,M2 巨噬细胞标志物表达降低。但加入外源性IL-6 后,逆转了SIN 对胃癌细胞诱导的巨噬细胞募集和M2 极化的抑制作用(图5D、图5E)。
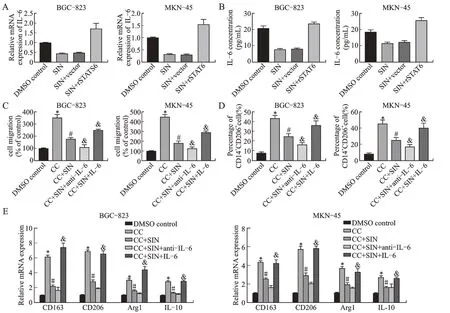
图5 STAT6 过表达胃癌细胞中IL-6 对青藤碱介导的巨噬细胞募集和M2 极化的影响Fig.5 The effect of STAT6 overexpression of IL-6 in gastric cancer cells on sinomenine-mediated macrophage recruitment and M2 polarization
3 讨 论
目前,研究者普遍认为,在实体肿瘤中,免疫微环境对肿瘤的发生发展产生了相当重要的作用,肿瘤细胞和非肿瘤细胞(免疫细胞、成纤维细胞、内皮细胞等)间通过细胞因子或直接作用等方式产生交互,进而重塑肿瘤微环境和肿瘤自身的变化。本研究专注于SIN 的药理作用,发现SIN 通过抑制胃癌细胞的细胞增殖活力和迁移来抑制胃癌的癌变进展。更重要的功能在于,SIN 通过抑制C/EBPβ 调控的IL-6分泌,来抑制胃癌细胞和巨噬细胞共培养条件下诱发的巨噬细胞招募作用和巨噬细胞M2 型极化。这项研究突出了在相对低剂量的作用下,SIN 并未直接杀死肿瘤细胞,但通过调节恶性肿瘤、癌细胞介导肿瘤相关巨噬细胞表型,改善肿瘤微环境,达到辅助免疫治疗,调整TME 的作用。
最近的证据证明了SIN在体外具有抗肿瘤活性,如抑制炎症、保护脑损伤、诱导血管舒张等。然而,由于SIN生物利用度较差,SIN的临床效用较为有限,在肿瘤的局部环境中,很难维持有效杀伤肿瘤的局部药物浓度。到目前为止,从自然界寻找有效的肿瘤抑制化合物仍然是研究热点,研究者也期待能从传统药物的宝库中寻找到解开肿瘤密码的钥匙。在乳腺癌中SIN 被证实具有抑制有丝分裂和抵抗缺氧诱导的EMT 的效果[18-19]。SIN 也可以通过调控PI3K/AKT 通路抑制视网膜母细胞瘤的增殖能力和侵袭迁移能力[20]。另外,在非小细胞肺癌、卵巢癌、胃癌、结肠癌等恶性肿瘤的相关研究中,SIN 已被证实具备体外和动物体内抑制肿瘤进展的效果[14,21-23]。本研究首次发现了SIN 调控肿瘤免疫微环境的药理作用,其药理机制通过CEBE/β/IL-6 轴抑制肿瘤的进展,进一步探索SIN在胃癌中的药理作用,有利于指导胃癌患者的治疗方案,提示新的治疗方法。
作为免疫环境中的重要成员,骨髓单核细胞来源的巨噬细胞在肿瘤浸润局部发挥的功能一直受到争议。在正常生理条件下和组织损伤后的组织稳态中,巨噬细胞起着积极的关键作用[24]。巨噬细胞的许多表型已经根据它们在细胞培养实验中的体外特征进行了表征。经典激活的M1 表型和继发激活的M2 表型根据不同的表面受体表达、分泌特征和功能进行区分[25]。M1 型巨噬细胞表现为促炎细胞,其具备较高的抗原呈递能力,激活I 型T 细胞免疫应答,具有表达较多IL-12 的特征[26]。M2 型巨噬细胞通常具有抗炎作用,其特点是抗原呈递能力差;具有低IL-12 和高IL-10、IL-4 和IL-13 分泌特征,同时伴有免疫抑制特征[27]。
在目前的研究中,C/EBPβ 的入核活化已经被证实对胃癌的细胞干性和化疗耐药起到促进作用,也能促进胃癌的增殖,从多个维度导致了胃癌的进展[28-30]。随着研究的深入,人们越来越关注C/EBPβ在肿瘤中和巨噬细胞及免疫环境之间的关系[31]。本研究证明了C/EBPβ 的过表达消除了SIN 对巨噬细胞招募和M2 极化的抑制作用。值得一提的是,C/EBPβ 本身也是重要的调控巨噬细胞表型的调控因子,在C/EBPβ 活化时介导巨噬细胞向M2 型巨噬细胞极化[32]。
综上所述,天然药物SIN 对胃癌具有良好的肿瘤抑制能力,抑制胃癌细胞的生存和迁移,并且通过抑制IL-6 的表达,抑制肿瘤微环境中的M2 表型,重塑肿瘤环境,降低M2 型巨噬细胞为胃癌肿瘤带来免疫抑制环境的风险。本研究为胃癌的临床治疗提供了新的思路,SIN 抑制肿瘤的同时重塑了免疫微环境,提示用SIN 治疗胃癌患者的同时结合免疫疗法可能带来更大的收益。
