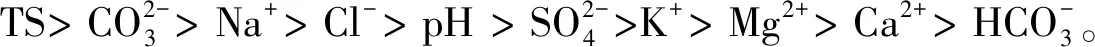鄂尔多斯台地盐沼滩涂湿地土壤细菌群落结构及特征
2022-05-20何玉实何彤慧冯艳琼陈向全赵明涛邱文静
何玉实,何彤慧,*,冯艳琼,崔 乔,陈向全,赵明涛,邱文静
1 宁夏大学生态环境学院,银川 750021 2 宁夏大学绿洲湿地生态实验室,银川 750021 3 西南民族大学青藏高原研究院,成都 610041
我国盐碱地总面积0.33亿hm2以上,占全国可利用土地面积4.88%[1]。鄂尔多斯高原地处黄河河套,是蒙古高原最南端,也是我国农牧交错带的重要组成部分[2],这里的生态环境对气候变化和人类活动响应敏感,近半个世纪以来是我国沙漠化防治与生态建设的重要区域。由于其特殊的地质条件,形成了总面积达310万hm2以上的内流河闭流区[3],是我国两大盐碱湖泊分布群之一[4]表现为极小湖面和四周大积滩涂的状态[4—5]。水域面积1km2以上的湖泊有近70个[6]。这些盐沼湖滩是该地区的物种多样性中心[7],维持着区域“山地-荒漠-绿洲-湖泊”特有的复合生态系统的稳定[8],也是遗鸥、白尾海雕等许多珍惜鸟类的栖息地,生态学意义显著。
在干旱-半干旱区,盐沼裸地周边的肉质耐盐草甸、苔草草甸、禾草草甸、杂类草草甸,有着鲜明的分布格局与植被演替过程。而土壤细菌作为生态系统的重要组成部分,不仅在物质循环、有机物分解等方面起着至关重要的作用,与土壤性质、植被类型之间也具有十分密切的关系[9—10],是生态环境演化的指示和响应。近年来蒙、宁两省实施的扬黄水利工程,使得鄂尔多斯高原的水盐运移过程更加复杂,盐沼湖滩植被演替变化也更加多样。面对水盐运移[11]不均衡这一科学问题,水文学多关注其地下水与地表水盐运移规律[12—14],农业科学侧重技术上的改水改土[15—16],生态学上普遍强调植被对盐碱地区生物适应的生理生态问题[17—18],而对于干旱半干旱地区盐沼湿地生态演替过程中的土壤细菌群落变化关注较少。
鉴于此,本研究基于Illumina Miseq测序分析结果,揭示鄂尔多斯高原盐沼滩涂湿地土壤细菌群落结构特征、分布情况,以及与土壤盐分指标的关系,以期为盐沼地区的土地修复及生境演替提供参考。
1 材料与方法
1.1 研究区概况
研究区位于鄂尔多斯高原(北纬37°36′—40°70′,东经107°26′—108°25′),地跨蒙、宁、陕3省(区),北面为库布其沙漠,南面为毛乌素沙漠,低凹处分布众多的湖(淖)和凹地草滩,总面积13×104km2。海拔1300—1500 m,降水稀少且季节分布不均衡[19],属于干旱-半干旱荒漠草原区[20],东南部土壤为栗钙土、西北部土壤为棕钙土[21]。本研究中的盐沼滩涂湿地主要分布于内陆闭流区的盐湖和沙丘之间,共调查了24个盐湖,73组样点。盐沼滩涂湿地植被主要以藜科(Chenopodiaceae)的尖叶盐爪爪(Kalidiumcuspidatum)、盐角草(Salicorniaeuropaea)和碱蓬(Suaedaglauca),苔草属(Carex)的寸草苔(Carexduriuscula),禾本科(Poaceae)的芦苇(Phragmitesaustralis)、芨芨草(Achnatherumsplendens)和碱茅(Puccinelliadistans)等为优势种的群落[22]和杂草类群落。
1.2 土壤采集与理化分析
于2019年5—6月在研究区进行植被调查和土壤采集,根据《中国植被》的分类方法,将研究区的植被划分出肉质耐盐草甸(B)、苔草草甸(C)、禾草草甸(D)和杂类草草甸(E)等4个植被亚型,并以盐沼裸地(A)为对照样地,共计5种盐沼滩涂湿地景观类型。采集的每组土样分为两部分,一部分用于土壤盐分测试,另一部分用于细菌高通量测序。
土壤细菌采集:用1 m×1 m的样方框进行土壤细菌调查,每组样地2—3个重复,共采集73组样地,187个样方,将样方中0—20 cm的土壤装入冷冻管中,放于干冰冷冻箱中运输,用于16S基因组测序。
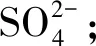
1.3 微生物测序
样品按照MOBIO PowerSoil® DNA Isolation Kit试剂盒操作方法提取样品基因组DNA[23],以338F(ACTCCTACGGGAGGCAGGAC)和806R(GGACTACHVGGGTWTCTAAT)引物进行16S rRNA基因片段PCR 扩增[24],将同一样品的PCR产物利用2%的琼脂糖凝胶电泳进行检测,采用Quanti FluorTM-ST蓝色荧光定量系统对纯化后的PCR产物进行荧光定量,PCR 扩增产物经建库检测,按照每个样本的测序量要求,进行相应比例的混合。测序在Illumina Miseq PE300 平台进行。
1.4 生物信息处理
利用Flash(V.1.2.11)进行pair-end双端序列拼接,并通过Uparse(V.7.0.1090)将97%相似性优化序列划分可操作分类单元(OTU,Operational Taxonomic Units)进行OTU聚类分析,对比Silva(https://www.arb-silva.de/)16SrRNA数据库,采用RDP (http://rdp.cme.msu.edu/)贝叶斯算法对97%相似水平的 OTU 代表序列进行分类学分析,并在各个分类水平上统计每个样品的群落组成,运用Mothur(V.1.30.2)得到优化序列,并对序列进行Alpha多样性分析(计算丰度指数(Chao1)、覆盖度(Coverage)和多样性指数(Shannon)。利用主坐标分析(PCoA),分析各样间 OTU 相似性。利用冗余分析研究土壤盐分指标与细菌群落的关系。
2 结果
2.1 细菌门水平分类和属水平分类
5种盐沼滩涂湿地的土壤细菌样品共12213条 OTUs,属于45个门,122个纲,365个目,663个科,1375个属,2882个种。图1为细菌门水平分类。将平均丰度低于2.5%的部分合并为 others 在图中显示,相对丰度较高的分别为变形菌门(Proteobacteria,26.19%),放线菌门 (Actinobacteria,17.15%),绿弯菌门 (Chloroflexi,12.62%),芽单胞菌门 (Gemmatimonadetes,11.23%),拟杆菌门 (Bacteroidetes,9.38%),酸杆菌门(Acidobacteria,8.83%)厚壁菌门(Firmicutes,2.96%)。
5种盐沼滩涂湿地相对丰度最高的都是变形菌门,分别为23.30%、26.56%、32.91%、24.14%、25.34%。除变形菌门外,A相对丰度最高的是拟杆菌门(17.83%),其次为放线菌门(16.62%)和芽单胞菌门(13.57%);B相对丰度较高的分别为放线菌门(19.67%),绿弯菌门(11.22%),芽单胞菌门(10.97%)和拟杆菌门(10.33%);C相对丰度较高的分别为放线菌门(15.91%)绿弯菌门(14.64%);D相对丰度较高的分别为放线菌门(16.78%)芽单胞菌门(15.67%),绿弯菌门(13.06%),酸杆菌门(10.16%);E相对丰度最高的是绿弯菌门(17.36%)放线菌门(15.64%)酸杆菌门 (13.48%)。
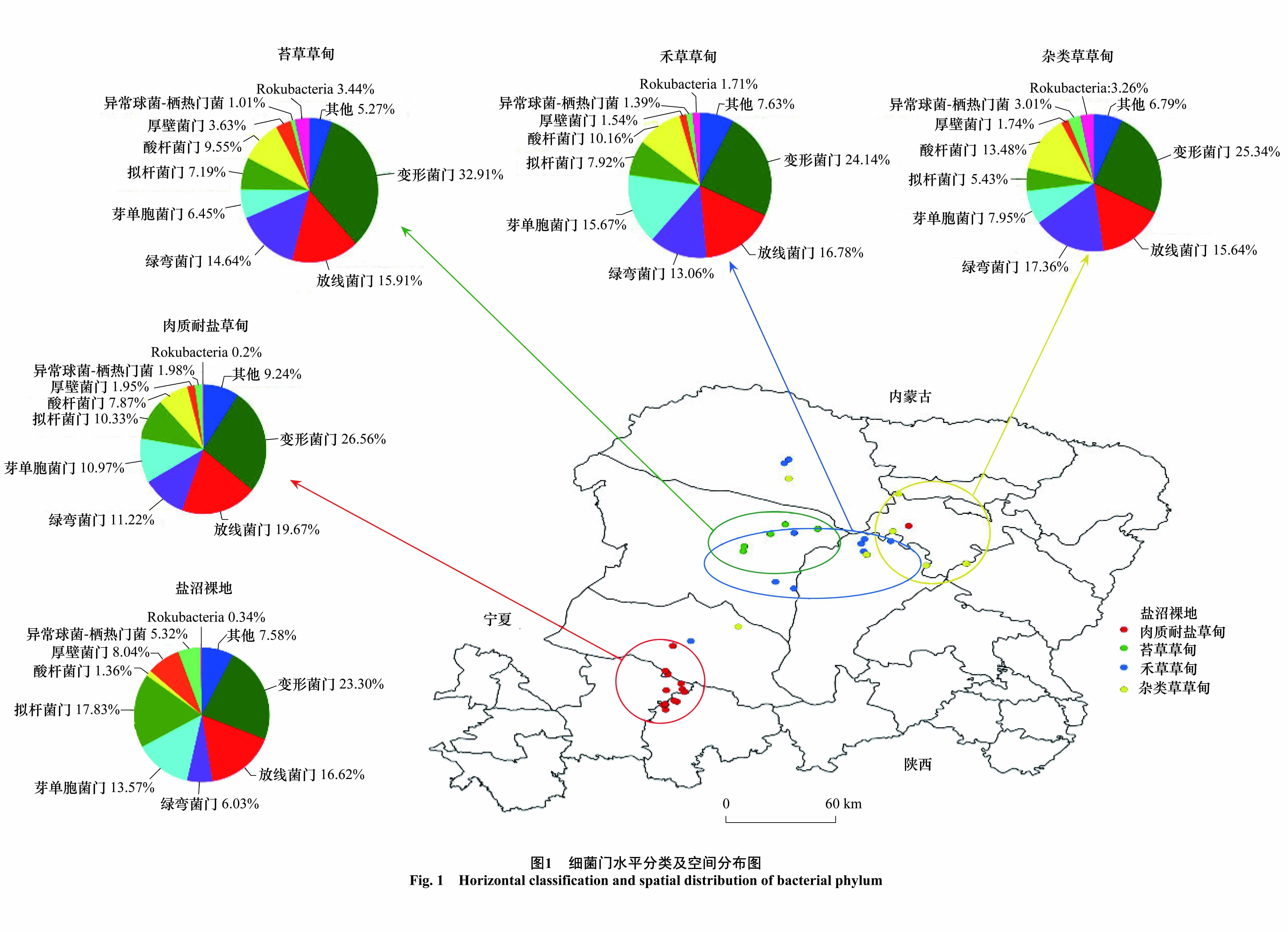
A为盐沼裸地,在各盐沼滩涂样地均有分布,故对另外4种盐沼滩涂湿地进行分析。在空间位置上,自西南向东北,随4种盐沼滩涂湿地的演替,其土壤细菌门分类相对丰度存在一定变化趋势。变形菌门相对丰度存在先增大后减小的趋势,在C达到最大,与异常球菌-栖热门菌(Deinococcus-Thermus)的变化趋势相反;放线菌门变化不大;绿弯菌门、酸杆菌门相对丰度大致呈不断增大的趋势;拟杆菌门和厚壁菌门大体呈逐渐减少的趋势;芽单胞菌门和(Rokubacteria)的变化趋势上下波动,不稳定,分别在D、C中出现最大。
图2为属水平上的细菌分类,将平均丰度低于2.5%的部分合并为 others 在图中显示,剩余13个属水平分类中有11个属于分类学数据库分类学谱系的中间等级,没有科学名称,以 norank 作为标记;1种细菌属于未系统分类细菌,以unclassified 表示。属水平分类细菌包括大量未分类和未培养细菌,给研究微生物的生态功能带来困难[25]。
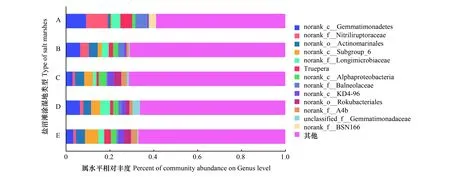
图2 细菌属水平分类Fig.2 Horizontal classification of bacteria generanorank_c_ Gemmatimonadetes:芽单胞菌纲未命名属;norank_f_Nitriliruptoraceae:放线菌科未命名属;norank_o_Actinomarinales:放线菌目未命名属;norank_c_Subgroup_6:Subgroup6号纲未命名属;norank_f_Longimicrobiaceae:长微菌科未命名属;Truepera:特鲁佩拉菌;norank_c_Alphaproteobacteria:α-变形菌纲未命名属;norank_f_Balneolaceae:浴者菌科未命名属;norank_c_KD4_96:绿弯菌门KD4-96纲未命名属;norank_o_Rokubacteriaies:Rokubacteriaies目未命名属;norank_f_A4b:A4b科未命名属;unckassified_ f_ Gemmatimonadaceae:单芽孢杆菌科未命名属;norank_ f_BSN166:BSN166科未命名属;others:自定义其他菌属
芽单胞菌纲中的一部分属水平的未定细菌(norank_c_ Gemmatimonadetes)是丰度最高的属,平均丰度为5.75%,是B、D相对丰度最大的属,也是A相对丰度第2大的属,但在C相对丰度很小 (3.02%)。放线菌科的一部分属水平的未定细菌 (norank_f_Nitriliruptoraceae)平均丰度为 3.52%,在A的相对丰度最高(9.95%)。
放线菌目中的一部分属水平的未定细菌(norank_o_Actinomarinales)、α-变形菌纲中的一部分属水平的未定细菌(norank_c_Alphaproteobacteria)、KD4_96纲中的一部分属水平的未定细菌(norank_c_KD4_96)、、A4b科中的一部分属水平的未定细菌(norank_f_A4b)呈先上升在下降再上升的趋势与芽单胞菌纲中的一部分属水平的未定细菌(norank_c_ Gemmatimonadetes)、放线菌科的一部分属水平的未定细菌 (norank_f_Nitriliruptoraceae)、巴斯德氏菌科中的一部分属水平的未定细菌(norank_f_Longimicrobiaceae)、浴者菌科中的一部分属水平的未定细菌(norank_f_Balneolaceae)的变化趋势正好相反。Subgroup_6纲中的一部分属水平的未定细菌(norank_c_Subgroup_6)从A—E呈逐渐上升的趋势,与BSN166科中的一部分属水平的未定细菌(norank_ f_BSN166)恰恰相反。芽单胞菌科中的一部分属水平的未系统分类的细菌(unckassified_ f_ Gemmatimonadaceae)的变化趋势与Truepera呈反比例关系。
2.2 属水平聚类分析
Veen 图可以表现多组样本中所共有和独有的物种数目,可以比较直观的展现不同环境样本中物种组成相似性及重叠情况。如图3所示,不同盐沼滩涂湿地土壤细菌属水平分析表明:5种盐沼滩涂湿地共有的属数目为551个,并且各区域都有不同于其他区域的属数目。另外,5种盐沼滩涂湿地细菌属的数量为D(1101)>E(1053)>B(1012)>C(993)>A(774)。A在细菌中的属的数量最低,B和D在细菌属水平聚类分析中,二者共有的微生物数量最多,一致性最高,差异较小;D和A的关系恰恰相反,细菌类群差异非常显著。
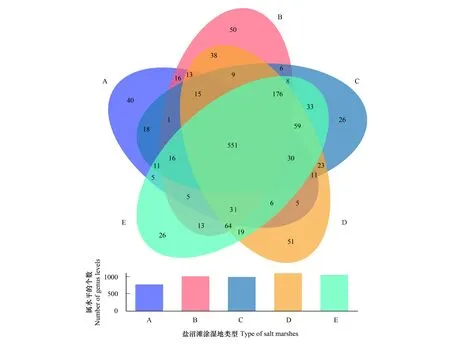
图3 属水平Veen图Fig.3 The Veen map of genera level
2.3 Alpha多样性分析
图4为反映盐沼滩涂湿地土壤细菌丰度和多样性的相关指数。5 种盐沼滩涂湿地土壤细菌群落丰度与多样性的排序是一致的:C>E>D>B>A。其中,C的丰富度与A、B、D的菌群丰富度呈显著差异(P<0.01),而在多样性中,C对于A存在显著差异(P<0.01)。各样品文库的覆盖率 (Coverage)范围为 99.04%—99.65%,说明土样中基因序列被检出的概率很高,本次测序结果能够代表湿地土壤细菌群落的真实情况。
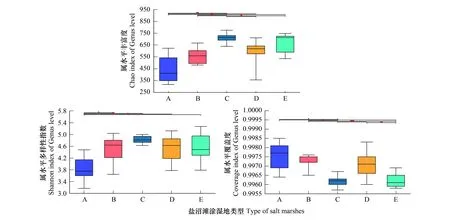
图4 5种盐沼滩涂样地土壤菌群Alpha多样性分析Fig.4 Analysis of Alpha diversity of soil community in 5 salt marsh samples*代表所选两组样本间的显著性差异情况,* P ≤ 0.05为,**P ≤ 0.01,*** P ≤ 0.001
2.4 结构差异分析
基于Bray Curtis距离的主坐标分析(PCoA)显示了不同盐沼滩涂湿地及土壤盐分等相关参数对微生物群落β-多样性的综合影响(图5)。细菌PCoA结果显示第一轴和第二轴的贡献率分别为20.77%和12.92%。C、D、E的土壤OTU置信区间均相交,表明其细菌群落结构相近;其中D均与B、C以及E的土壤 OTU 组成相近;A只与B距离相近,和其它3种盐沼滩涂湿地土壤 OTU 组成的差异都较大。空间位置相近的土壤细菌群落结构也相近。
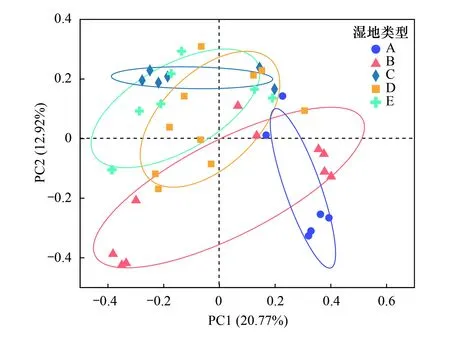
图5 群落结构差异分析(PCoA)Fig.5 Analysis of community structure differences (PCoA)
2.5 细菌与土壤盐分指标的关系
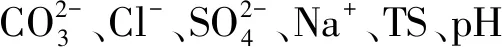
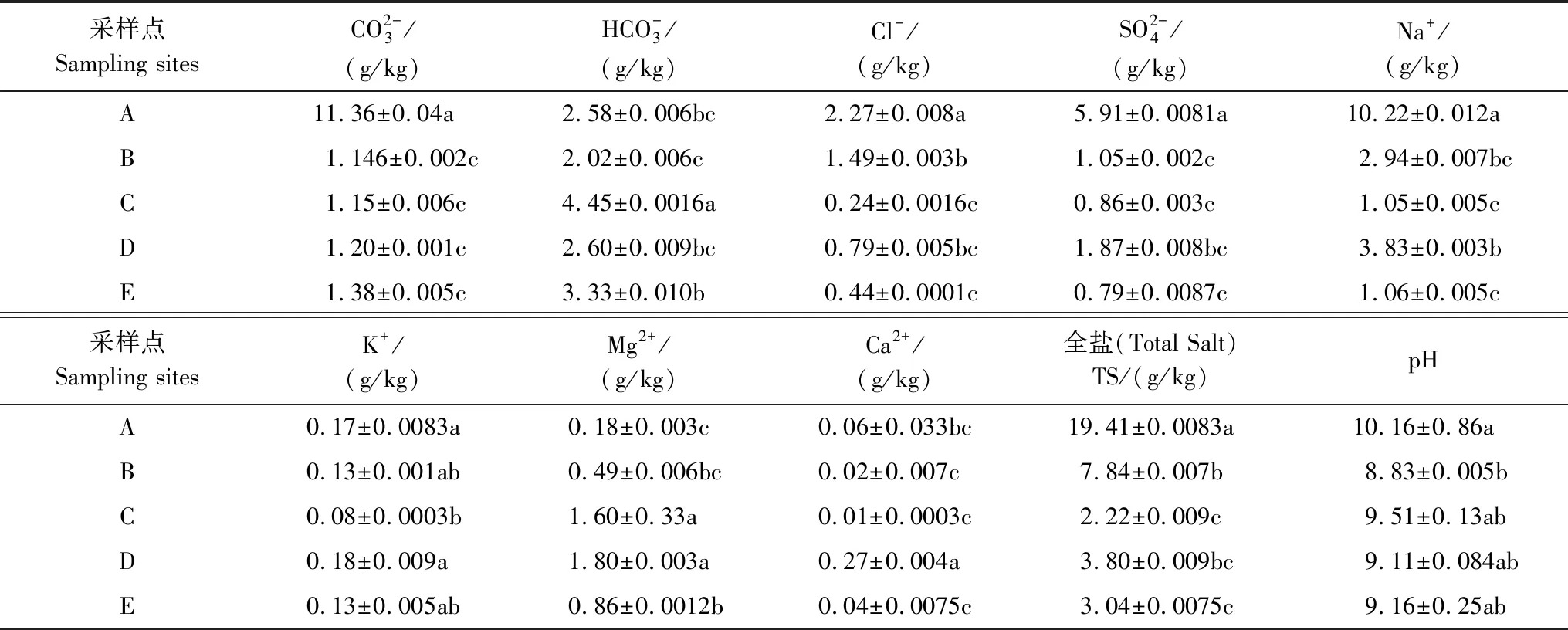
表1 植被群落土壤盐分指标Table 1 Soil salinity index of vegetation community
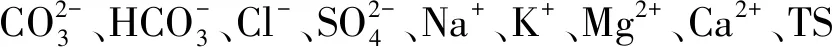
图6 盐沼滩涂湿地土壤细菌门分类群落与土壤盐分指标的冗余分析Fig.6 Redundancy analysis of soil bacteriophyta taxonomic community and soil salinity index in salt marsh tidal wetlandCO:碳酸根离子碳酸氢根离子氯离子 Cl-;SO:硫酸根离子钠离子 Na+;K:钾离子 K+;Mg:镁离子 Mg2+;Ca:钙离子 Ca2+;TS:全盐 Total Salt;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Chloroflexi:绿弯菌门;Gemmatimonadetes:芽单胞菌门;Bacteroidetes:拟杆菌门;Acidobacteria:酸杆菌门;Firmicutes:厚壁菌门;Deinococcus-Thermus:异常球菌-栖热门菌;Rokubacteria:Rokubacteria菌门;Planctomycects:浮霉菌门;红色箭头表示数量型环境因子;蓝色箭头表示样地丰度前十的物种。环境因子箭头的长短可以代表环境因子对于物种数据的影响程度(解释量)的大小;环境因子与物种箭头间的夹角代表正、负相关性(锐角:正相关;钝角:负相关;直角:无相关性)
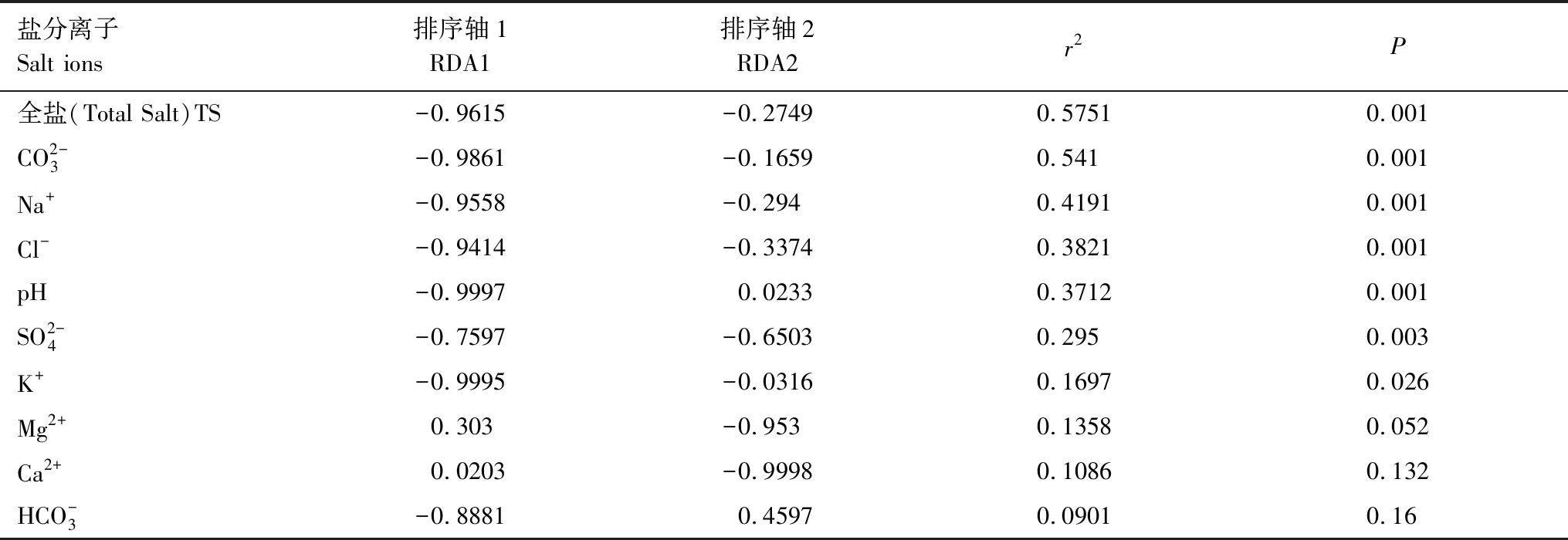
表2 各维度对结果的解释权重比Table 2 The interpretation weight ratio of each dimension to the result
3 讨论
样地细菌丰度前三的为变形菌门(26.19%)、放线菌门 (17.15%)和绿弯菌门(12.62%),这是因为在盐碱环境中,不同植物根系对其周围的土壤微生物有一定的选择性,其可以利用自身根系的生命活动,选择性地改变某些细菌的相对丰度或多样性来形成更有利于其自身生长发育的细菌群落结构[26]。5种盐沼滩涂湿地相对丰度最高的都是变形菌门,这与李新等[27—29]人的研究结果相同。在盐碱湖中,土壤细菌主要类群是变形菌门,这是因为变形菌门具有很强的耐盐碱性,并且部分变形菌门的细菌能够利用有机物分解产生的氨气、甲烷等营养物质进行生长代谢活动[30],自生固氮与共生固氮微生物中一大部分都属于变形菌门。从空间位置上看,A和E的细菌群落结构差异最明显,除变形菌门外,A相对丰度最高的是拟杆菌门,由于A具有极高的盐分含量,而拟杆菌门细菌具有较高的耐盐性;E相对丰度最高的是绿弯菌门,这是因为E为杂类草草甸,其植物种类组成丰富,大量植物具有固碳功能,而绿弯菌门是一类通过光合作用,以CO2为碳源产生能量的细菌优势[31]。另外也有研究表明绿弯菌门在水位频繁变化的潮间带土壤含量较高[32],并且绿弯菌门的这种光合特性可能使其在SOC含量较低的土壤中具有竞争。
虽然酸杆菌具有嗜酸的特点,但此次取样点pH均在8以上,特别是在D、E中土壤酸杆菌门相对丰度在所有检出门中排名靠前,Liu[33]的观点与本研究相符,发现在中性或碱性环境中也会被检测到。并且酸杆菌门具有降解植物残体的生态功能[34],这可能也与D、E中植物生物量大,物种丰富度强有关。
土壤细菌群落的丰富度和多样性在湿地营养盐循环、有机物降解、重金属转化等方面起着重要的生态功能[35—36]。本研究中,5种盐沼滩涂湿地的土壤细菌的丰富度与多样性结果相同,均为C>E>D>B>A。并且,C的丰富度与A、B、D的菌群丰富度呈显著差异(P<0.01)。这是因为在野外植被调查中发现,群落植被覆盖度呈现出C>D>E>B,并且C的土壤含水量最大。由于土壤含水量不同,导致土壤微生物活性存在较大差异,而土壤容重又通过影响土壤孔隙度、通气状况直接对土壤微生物(特别是好氧微生物)产生影响[37],地上植被覆盖度影响土壤含水量[38],土壤含水量、氮磷比又通过限制植物生长,影响植物覆盖度、生物量及丰富度[39],进而间接影响土壤微生物活性,Gordon[40]等研究发现,较高的土壤含水量可提高土壤微生物活性,从而增加土壤微生物的丰富度以及多样性。通过表1中土壤TS的变化,发现细菌群落的丰度和多样性受土壤盐度的影响,细菌群落随盐度梯度的增加而呈下降趋势,这一发现与Canfora 等[41]研究结果相同。
通过群落结构差异性分析,发现5类盐沼滩涂的土壤OTU置信区间均分别与其邻近的细菌群落相交。其中D均与B、C以及E的土壤 OTU 组成相近,表明其细菌群落结构相对相近;而A只与B距离相近,和其它3种植被类型土壤 OTU 组成的差异都较大,空间位置相近的土壤细菌群落结构也相近。同时,图3的Veen 图也验证了上述群落结构差异情况。
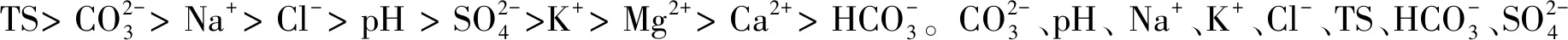
4 结论
(1)鄂尔多斯盐沼湿地5种类型土壤细菌样品共12213条 OTUs,属于45个门,122个纲,365个目,663个科,1375个属。且样品中包括大量未分类和未培养细菌,需对其进一步进行相关研究。
(2)变形菌门是鄂尔多斯盐沼滩涂湿地平均相对丰度最高的门,其次为放线菌门,绿弯菌门,芽单胞菌门,拟杆菌门,酸杆菌门,厚壁菌门。芽单胞菌纲中的一部分属水平的未定细菌(norank_c_ Gemmatimonadetes)是丰度最高的属,平均丰度为5.75%。
(3)空间位置相近的盐沼滩涂土壤细菌群落结构具有更大的相似性,鄂尔多斯盐沼滩涂湿地自西南向东北,随着土壤盐分变化,变形菌门相对丰度存在先增大,后减小的趋势,与异常球菌-栖热门菌的变化趋势相反;绿弯菌门、酸杆菌门相对丰度大致呈不断增大的趋势;拟杆菌门和厚壁菌门大体呈逐渐减少的趋势。
(4)土壤细菌群落丰度与多样性的排序是一致的:C(苔草草甸)>E(杂类草草甸)>D(禾草草甸)>B(肉质耐盐草甸)>A(盐沼裸地)。