天降血栓通丸抑制动脉粥样硬化小鼠主动脉斑块形成的作用及其机制
2022-05-20赵聪娜韩鹏飞张宝楠王居平
赵聪娜,韩鹏飞,张宝楠,王居平
1 天津市北辰区中医医院肾病科,天津 300400;2 天津市北辰区中医医院检验科;3 天津市北辰区中医医院心病科
动脉粥样硬化(AS)以动脉壁脂质沉积产生病理性斑块为病理特征,是冠心病、脑梗死等缺血性心脑血管疾病的主要病理基础。AS的发生机制复杂,涉及氧化应激、炎症反应等多种病理过程[1]。研究表明,Toll 样受体4(TLR4)介导的信号通路是AS 炎症反应的主要炎症信号通路[2-3]。髓样分化因子88(MyD88)和核转录因子κB(NF-κB)是TLR4 的关键下游分子,也是炎症反应中重要的炎症因子,TLR4/MyD88/NF-κB 信号通路已被证实是炎症反应中最重要的炎症信号通路[4]。因此,以TLR4/MyD88/NF-κB 信号通路为治疗靶点有可能在抑制AS 炎症反应中发挥关键作用。天降血栓通丸是以补阳还五汤为基本方加减化裁而成,具有活血化瘀、益气养血的功效[5]。动物实验表明,天降血栓通丸能够抑制ApoE-/-小鼠的脂质代谢紊乱,减轻炎症反应,从而抑制AS 的发生发展;在2 型糖尿病肾病动物模型中,天降血栓通丸被证实具有调节血脂、保护血管内皮功能和抑制炎症反应的作用[6]。但目前关于天降血栓通丸对AS 的作用机制研究尚少。2020 年7月—2021 年9 月,我们通过饲喂高脂饮食建立ApoE-/-小鼠AS 模型,观察天降血栓通丸对AS 小鼠主动脉斑块形成的抑制作用,并探讨其作用机制与TLR4/MyD88/NF-κB 信号通路的关系,为临床治疗AS提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级C57BL/6 雄性小鼠12 只与ApoE-/-雄性小鼠62 只,8 周龄,体质量(20±2)g,购自北京维通利华实验动物技术有限公司。饲养于北京大学SPF 级实验动物房,饲养温度20~25 ℃,相对湿度50%~60%,昼夜时长1∶1,自由饮水采食。用普通饲料适应性饲喂1周后用于实验。
1.1.2 药物与试剂 高脂饲料(含20%蔗糖、15%猪油、2%胆固醇、0.2%胆酸钠,购自北京华阜康生科技股份有限公司);天降血栓通丸(天津市北辰区中医医院门诊),阿托伐他汀片(辉瑞制药有限公司);脂多糖(LPS,TLR4 激动剂,北京康瑞纳生物科技有限公司)。总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)、单核细胞趋化因子1(MCP-1)、细胞间黏附分子1(ICAM-1)、血管细胞黏附分子1(VCAM-1)检测试剂盒(上海酶研生物科技有限公司),白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)检测试剂盒(南京建成生物研究所),油红O 染色液(武汉纯度生物科技有限公司),BCA 蛋白浓度测定试剂盒、RIPA蛋白裂解液(北京索莱宝公司),TLR4、MyD88、NF-κB、β-actin抗体(英国Abcam公司)。
1.1.3 实验仪器 BS-280全自动生化分析仪(南京贝登医疗股份有限公司);Applied Biosystems PCR 仪(美国Thermo公司);WD-9417B酶标检测仪(上海易汇生物科技有限公司);CX21光学显微镜(日本奥林巴斯);GelDoc Go凝胶成像系统(美国Bio-Rad公司)。1.2 模型制备与实验分组 C57BL/6小鼠饲喂普通饲料作为正常对照组,ApoE-/-小鼠饲喂高脂饲料制备AS模型。喂养8周后,随机选取2只ApoE-/-小鼠观察主动脉病理变化,以出现AS斑块为建模成功。将剩余60只ApoE-/-小鼠采用随机数字表法分为模型组、阿托伐他汀组、天降血栓通丸低剂量组、天降血栓通丸高剂量组、天降血栓通丸+LPS组,每组12只。
1.3 药物制备与干预 天降血栓通丸加工浓缩制成含生药2.25 g/mL 的药液;阿托伐他汀片用0.9%氯化钠溶液制成1.5 mg/mL混悬液。阿托伐他汀组灌胃400 μL 阿托伐他汀混悬液,天降血栓通丸低剂量组和高剂量组分别灌胃含生药4.5、9.0 g/mL 的天降血栓通丸药液400 μL。天降血栓通丸+LPS 组先后给予200 μL 天降血栓通丸药液(18.0 g/mL)和10 g/mL LPS 200 μL 灌胃。正常对照组与模型组给予生理盐水400 μL灌胃。每天1次,连续灌胃8周。1.4 主动脉斑块面积观测算 采用油红O染色法。处死小鼠,分离主动脉,取一段加入4%多聚甲醛固定,脱水,透明,石蜡包埋,制作病理切片。加入油红O 染色液染色,50%乙醇分化,蒸馏水冲洗返蓝,甘油明胶封片。光学显微镜下观察组织形态学变化并拍照,采用Image J 软件测定斑块面积和血管面积,计算主动脉斑块面积占总血管面积的比值。剩余主动脉置于-80 ℃冰箱保存备用。
1.5 血脂、血清炎症因子及细胞黏附分子水平检测 给药结束后,小鼠禁食12 h,使用3%戊巴比妥钠腹腔注射麻醉,打开腹腔,腹主动脉取血,置于抗凝管中,4 ℃下3000 r/min离心10 min,收集血清。采用全自动生化分析仪检测TC、TG、LDL-C、HDL-C 水平,ELISA 法检测IL-6、IL-1β、TNF-α 及MCP-1、ICAM-1、VCAM-1水平,严格按照试剂盒说明书进行操作。
1.6 主动脉组织中TLR4/MyD88/NF-κB 信号通路相关基因表达检测 采用RT-PCR 法。取冻存的主动脉,研磨成粉末,加入TRIzol 提取总RNA,逆转录合成cDNA。采用Primer Premier 6.0 和Beacon designer 7.8 软件进行荧光定量PCR 引物的设计。引物序列:TLR4 上游5'-CCAGCCTCCTCAGAAACAGA-3',下 游 5'-TCCCTCCAGCAGTAAGAAG-3';MyD88上游5'-TGGCATGCCTCCATCATAGTTAACC-3',下游5'-GTCAGAAACAACCACCACCATGC-3';NFκB 上 游5'-ATAGAAGAGCAGCGTGGGGACT-3',下游5'-GGATGACGTAAAGGGATAGGGC-3';β -actin上 游5'-GCCAACCGTGAAAAAGATG-3',下 游5'-CCAGGATAGAGCCACCAAT-3'。扩增条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火25 s,共45个循环。以β-actin 为内参基因,采用2-ΔΔCt法计算TLR4、MyD88、NF-κB mRNA的相对表达量。
1.7 主动脉组织中TLR4/MyD88/NF-κB 信号通路相关蛋白表达检测 采用Western blotting 法。取冻存的小鼠主动脉,研磨成粉末,加入RIPA 蛋白裂解液,提取总蛋白。BCA 法测定蛋白浓度,得出样品总浓度后进行上样、电泳、转膜、封闭。加入TLR4、MyD88、NF-κB 一抗(稀释浓度均为1∶1000)4 ℃孵育过夜;清洗,加入二抗(稀释浓度1∶3000)孵育。按照ECL 化学发光试剂盒说明书进行显色,应用凝胶成像系统扫描图像测定条带灰度值,以β-actin 为内参蛋白,计算TLR4、MyD88、NF-κB 蛋白的相对表达量。
1.8 统计学方法 采用SPSS24.0统计软件。符合正态分布的计量资料以±s表示,两组间比较采用t检验,多组间比较进行单因素方差分析,进一步两两组间比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组主动脉斑块面积比较 正常对照组、模型组、阿托伐汀组、天降血栓通丸低剂量组、天降血栓通丸高剂量组、天降血栓通丸+LPS 组的斑块面积占主动脉总面积的比例为0、33.08% ± 3.03%、15.14 %±1.23%、22.73%±2.34%、16.39%±1.66%、20.33% ± 1.94%。与模型组比较,阿托伐汀组、天降血栓通丸低剂量和高剂量组主动脉斑块面积减少,且天降血栓通丸高剂量组少于低剂量组(P均<0.05);天降血栓通丸+LPS 组斑块面积较天降血栓通丸高剂量组增加(P均<0.05)。
2.2 各组血脂水平比较 与正常对照组比较,模型组TC、TG、LDL-C 水平升高(P均<0.05);与模型组比较,阿托伐他汀组以及天降血栓通丸低、高剂量组TC、TG、LDL-C 水平降低(P均<0.05);天降血栓通丸高剂量组TC、TG、LDL-C 水平低于天降血栓通丸低剂量组(P均<0.05),但与阿托伐他汀组比较无统计学差异(P均>0.05);与天降血栓通丸高剂量组比较,天降血栓通丸+LPS 组TC、TG、LDL-C 水平升高(P均<0.05)。各组血清HDL-C 水平比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组血清TC、TG、LDL-C、HDL-C水平比较(mmol/L,±s)
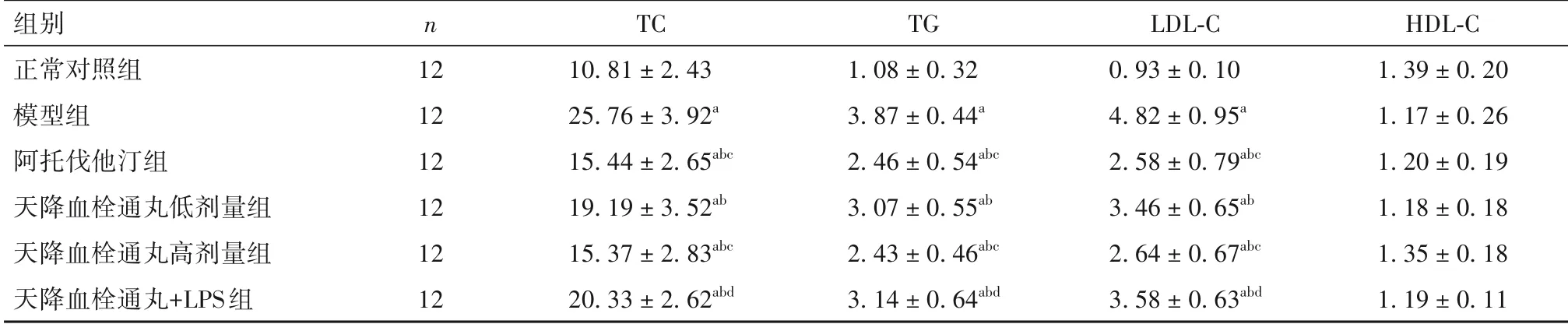
表1 各组血清TC、TG、LDL-C、HDL-C水平比较(mmol/L,±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与天降血栓通丸低剂量组比较,cP<0.05;与天降血栓通丸高剂量组比较,dP<0.05。
组别正常对照组模型组阿托伐他汀组天降血栓通丸低剂量组天降血栓通丸高剂量组天降血栓通丸+LPS组n 121212121212 TC 10.81±2.4325.76±3.92a 15.44±2.65abc 19.19±3.52ab 15.37±2.83abc 20.33±2.62abd TG 1.08±0.323.87±0.44a 2.46±0.54abc 3.07±0.55ab 2.43±0.46abc 3.14±0.64abd LDL-C 0.93±0.104.82±0.95a 2.58±0.79abc 3.46±0.65ab 2.64±0.67abc 3.58±0.63abd HDL-C 1.39±0.201.17±0.261.20±0.191.18±0.181.35±0.181.19±0.11
2.3 各组血清IL-6、IL-1β、TNF-α 水平比较 见 表2。
表2 各组血清IL-6、IL-1β、TNF-α水平比较(ng/L,±s)

表2 各组血清IL-6、IL-1β、TNF-α水平比较(ng/L,±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与天降血栓通丸低剂量组比较,cP<0.05;与天降血栓通丸高剂量组比较,dP<0.05。
组别正常对照组模型组阿托伐他汀组天降血栓通丸低剂量组天降血栓通丸高剂量组天降血栓通丸+LPS组n 121212121212 IL-68.97±1.4417.79±2.76a 12.33±1.81abc 15.03±2.11ab 12.35±1.18abc 15.17±1.26abd IL-1β 4.47±1.0913.92±3.25a 7.79±1.77abc 10.63±2.09ab 7.82±1.23abc 10.98±2.55abd TNF-α 5.38±1.2219.67±3.92a 12.13±2.55abc 15.39±2.32ab 11.91±2.52abc 15.65±2.74abd
2.4 各组血清MCP-1、ICAM-1、VCAM-1 水平比 较 见表3。
表3 各组血清MCP-1、ICAM-1、VCAM-1水平比较(±s)

表3 各组血清MCP-1、ICAM-1、VCAM-1水平比较(±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与天降血栓通丸低剂量组比较,cP<0.05;与天降血栓通丸高剂量组比较,dP<0.05。
组别正常对照组模型组阿托伐他汀组天降血栓通丸低剂量组天降血栓通丸高剂量组天降血栓通丸+LPS组n 121212121212 MCP-1(pg/mL)11.26±1.3726.42±3.43a 17.39±1.98abc 21.57±2.28ab 17.28±2.57abc 21.26±1.81abd ICAM-1(ng/mL)8.52±1.0419.88±2.52a 11.85±1.24abc 14.82±1.26ab 12.12±1.64abc 15.03±3.25abd VCAM-1(ng/mL)16.74±2.1534.96±6.33a 22.11±2.67abc 28.64±3.23ab 22.79±2.25abc 30.23±3.66abd
2.5 各组主动脉组织中TLR4/MyD88/NF-κB 信 号通路相关基因表达量比较 见表4。
表4 各组主动脉组织中TLR4、MyD88、NF-κB mRNA表达量比较(±s)

表4 各组主动脉组织中TLR4、MyD88、NF-κB mRNA表达量比较(±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与天降血栓通丸低剂量组比较,cP<0.05;与天降血栓通丸高剂量组比较,dP<0.05。
组别正常对照组模型组阿托伐他汀组天降血栓通丸低剂量组天降血栓通丸高剂量组天降血栓通丸+LPS组n 121212121212 TLR4 mRNA 1.00±0.003.52±0.87a 1.86±0.47abc 2.53±0.45ab 1.82±0.53abc 2.56±0.62abd MyD88 mRNA 1.00±0.003.97±0.66a 2.03±0.81abc 3.11±0.73ab 2.07±0.66abc 3.13±0.54abd NF-κB mRNA 1.00±0.004.55±0.56a 2.38±0.46abc 3.02±0.33ab 2.32±0.52abc 3.17±0.64abd
2.6 各组主动脉组织中TLR4/MyD88/NF-κB 信号 通路相关蛋白表达量比较 见表5。
表5 各组主动脉组织中TLR4、MyD88、NF-κB蛋白表达量比较(±s)

表5 各组主动脉组织中TLR4、MyD88、NF-κB蛋白表达量比较(±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与天降血栓通丸低剂量组比较,cP<0.05;与天降血栓通丸高剂量组比较,dP<0.05。
组别正常对照组模型组阿托伐他汀组天降血栓通丸低剂量组天降血栓通丸高剂量组天降血栓通丸+LPS组n 121212121212 TLR40.72±0.071.96±0.53a 1.19±0.12abc 1.52±0.25ab 1.15±0.14abc 1.54±0.14abd MyD880.68±0.081.83±0.49a 1.08±0.07abc 1.37±0.19ab 1.07±0.11abc 1.36±0.12abd NF-κB 0.79±0.071.63±0.36a 1.06±0.12abc 1.34±0.18ab 1.08±0.10bc 1.32±0.21abd
3 讨论
AS是心脑血管疾病发生的主要病理基础,多发于血管内皮,是由免疫炎症反应介导的一类慢性炎症反应疾病。AS的发生与机体多种病理活动有关,研究发现,在AS 的发展过程中,机体出现血脂代谢异常、免疫炎症反应异常以及单核细胞黏附等病理过程[7-8]。目前由于AS 发生机制尚不清晰,其治疗与预后仍存在一些问题,研究发现他汀类西药治疗AS 迅速有效,但因其作用单一,长期服用也会造成耐药性或其他不良反应[9]。近年来,中医药在AS 的防治方面取得了一定的效果,中药复方在AS中具有显著优势,罗朵生等[10]采用田黄方、麻莉等[8]使用景虎通脉方改善AS都取得了较好的效果。
天降血栓通丸由蝮蛇、地龙、黄芪、丹参、赤芍、安息香、降香、山楂、天麻、水蛭、石菖蒲等药物组成,具有活血化瘀、益气养血的功效。现代药理研究表明,丹参的活性成分丹参素可以通过调节CD36 和ATP 结合盒转运子A1蛋白的表达来抑制脂质沉积,达到及时分解过多胆固醇和降低LDL-C 水平的作用[11];山楂的活性成分山楂黄酮可以通过下调肝脏胆固醇生物合成酶羟甲基戊二酰辅酶A 还原酶(HMGCR)的表达,抑制胆固醇的合成,同时通过上调肝脏低密度脂蛋白受体的表达,促进胆固醇的代谢,从而起到调节脂质代谢紊乱的作用[12];另外石菖蒲和黄芪等药物的有效成分也具有降低血脂的作用[13]。本研究对AS小鼠给予天降血栓通丸治疗,观察其对斑块形成的抑制效果。
AS 主要病理特征为脂质沉积或纤维沉积引起的粥样硬化斑块的生成,并伴随血脂异常,研究发现炎症反应的活化是加快AS 发展并促进周洋硬化斑块破裂的主要原因[14]。IL-6、IL-1β、TNF-α 等炎症因子可通过多种通路参与早期炎症反应,IL-6、IL-1β、TNF-α 过度表达引起炎症反失调,导致AS的发生与发展[15-16]。MCP-1 是一种促炎细胞因子,参与细胞趋化与迁移过程,能够诱导炎症反应过表达[17];ICAM-1 在机体炎症以及AS 过程中发挥关键作用[18];VCAM-1 作为一种免疫球蛋白,参与机体免疫应答、促进炎症反应[19]。本研究通过饲喂高脂饮食建立ApoE-/-小鼠AS模型,发现模型组小鼠动脉组织中出现AS 斑块,提示模型建立成功。AS 小鼠血清中血脂代谢指标TC、TG、LDL-C 和炎症因子IL-6、IL-1β、TNF-α 以及MCP-1、ICAM-1、VCAM-1 水平显著升高,提示AS小鼠脂代谢异常伴随炎症反应的激活。给予天降血栓通丸干预后,小鼠主动脉中的AS斑块明显减少,血清中TC、TG、LDL-C 水平以及IL-6、IL-1β、TNF-α 含量显著降低,MCP-1、ICAM-1、VCAM-1 水平明显下降,提示天降血栓通丸具有调节血脂水平、减轻炎症反应的作用,从而改善AS。
TLR4 是公认的经典炎症反应信号通路转导受体,参与机体炎症反应、免疫反应以及脂质代谢过程,在AS 病变过程中起到关键作用[20]。NF-κB 是TLR4 下游重要的信号转导因子,有研究证明,TLR4/MyD88/NF-κB 信号通路与AS 的发生发展有着密切的联系[21-22]。血管内皮细胞受损介导免疫反应发生,激活TLR4信号通路,从而激活NF-κB,调节下游更多炎症因子的表达与释放,从而引起炎症反应,进一步加重组织损伤,导致AS 发生[23-24]。研究发现,TLR4 介导的下游信号MyD88 缺失时能够减轻机体炎症反应,使AS斑块面积明显减少[25]。以上研究表明,TLR4/MyD88/NF-κB 信号通路是血管炎症反应和AS发生的主要原因,抑制该通路的激活与传导可能有效减轻AS 的病理发展过程。本研究结果显示,AS 小鼠主动脉组织中TLR4/MyD88/NF-κB信号通路相关基因的相对表达明显升高,而天降血栓通丸高剂量组和低剂量组主动脉组织中该通路相关基因的相对表达量明显降低,且TLR4/MyD88/NF-κB信号通路相关蛋白表达量的变化趋势与基因表达一致,提示天降血栓通丸能够有效抑制TLR4/MyD88/NF-κB 信号通路激活。此外,TLR 激动剂LPS 可部分逆转天降血栓通丸对AS 的改善作用,表明天降血栓通丸可通过抑制TLR4/MyD88/NF-κB信号通路激活,从而减轻AS 导致的免疫炎症反应,抑制血脂异常代谢和单核细胞黏附以及减少AS 斑块形成。
综上所述,天降血栓通丸可以通过抑制TLR4/MyD88/NF-κB 信号通路激活,达到抑制AS 小鼠主动脉斑块形成的作用,且高剂量天降血栓通丸能够发挥更显著的效果。本研究为天降血栓通丸应用于治疗AS引起的脑血管疾病提供了重要指导意义。
