微生物组技术分析犬子宫蓄脓宫内菌群特征
2022-05-20张玉珠郑慧华刘祥雨杨泞毓杜崇涛谢光洪
张玉珠,郑慧华,刘祥雨,2,杨泞毓,2,杜崇涛*,谢光洪*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.谢博士动物医院,吉林 长春 130062)
作为临床上的常见疾病,犬子宫蓄脓是指犬子宫腔内有大量的脓液并伴有子宫内膜炎和子宫内膜异常增生,是未绝育母犬常见的子宫疾病[1]。子宫蓄脓是一种潜在的威胁生命的疾病,若治疗不及时,可能会有致命的后果。临床上对犬子宫蓄脓最常见的治疗方法是卵巢子宫切除术。尽管该方法可降低患犬的死亡率,但有研究表明绝育(即卵巢子宫切除)对犬的健康存在潜在威胁,甚至激发某些疾病,如癌症[2-3]、骨科疾病[4-5]和肥胖[6]等。犬子宫蓄脓可能是机体内激素和细菌共同作用造成的[7],但迄今为止,其发病机制和规律尚不清晰。
在人类生殖道系统的研究中,子宫作为重要的生殖器官,临床上伴发各种疾病如慢性子宫内膜炎,子宫内膜异位症、子宫内膜癌等,严重影响女性的生殖和身心健康。随着高通量测序技术的出现,发现子宫类疾病发生时,其子宫内部存在丰富的微生物组,如子宫内膜炎患者的子宫内主要菌群有酸杆菌门、厚壁菌门、拟杆菌门、变形菌门和放线菌门[8]。而与人类生活息息相关的伴侣动物犬在子宫蓄脓时是否有子宫内菌群的参与,这一研究在国际上是空白的。因此,本研究首次通过16S rRNA 测序技术分析犬子宫蓄脓病例的子宫内脓液和子宫内膜组织的菌群特征,为该病的预防和治疗提供了微生物学新思路。
1 材料与方法
1.1 样本的采集
19 份子宫脓液和9 份子宫内膜均来自长春市谢博士动物医院的确诊病例,通过卵巢子宫切除术将切除的组织立马在无菌操作台,将子宫表面用碘伏擦拭干净,用手术刀片切开子宫,在相同位置取适量的脓液放于1.5 mL 无菌Ep 管中,编码为PB001-PB011,PBB001-PBB008,即为PB 组;用无菌手术刀在采取脓液的相同位置刮取适量子宫内膜组织放于1.5 mL 无菌Ep 管中,编码为PP001-PP009,即为PP 组;并迅速放入-80℃冰箱保存。
1.2 总DNA 提取与检测
采用TIANGEN 试剂盒对犬子宫蓄脓病例的子宫内脓液和子宫内膜组织样本提取细菌总DNA,具体的操作步骤严格按照TIANGEN 试剂盒说明书,之后使用琼脂糖凝胶电泳检测了DNA的浓度和纯度。
1.3 PCR 扩增与高通量测序
样本DNA 通过检测合格之后,用无菌用水将适量DNA 样本稀释至1 μg·μL-1并放置于离心管中,作为扩增模板。以515F 和806R为引物选取细菌16S rDNA V4 区进行扩增:(热循环包括98 ℃预变性1 min;30个循环(98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s);72 ℃终延伸5 min),然后在1.5%琼脂糖凝胶上进行电泳检测。将PCR 产物以等密度比例进行混合,然后用Qiagen 凝胶提取试剂盒(Qiagen,Germany)进行纯化,混合PCR 产物。使用建库试剂盒进行文库构建,构建好的文库经检验合格之后,使用NovaSeq PE250 进行上机测序,以上均由诺禾致源生物科技有限公司完成。
1.5 数据分析
对测序所得到的原始数据进行拼接、过滤后,会得到有效数据,从而使信息分析的结果更加准确和可靠。然后在有效数据的基础上,默认以97%的一致性将序列聚类成操作分类单元(Operational Taxonomic Units,OTUs),使用Qiime 软件(Version 1.9.1)计 算Shannon、Simpson、Chao 1、ACE、Coverage 数据进行Alpha 多样性指数分析样本犬子宫蓄脓子宫内脓汁菌群和子宫内膜菌群的丰富度和多样性。使用Beta 多样性来分析不同样本间的差异程度。用LEfSe 分析寻找两组间显著差异性物种。
1.6 统计分析
使用SPSS18.0 软件统计和分析数据。计数资料用例数或百分率表示。P<0.05为差异有统计学意义。
2 结果与分析
2.1 犬子宫蓄脓宫内菌群OTUs 分析
为研究犬子宫蓄脓子宫内脓液和子宫内膜组织菌群情况,通过16S rRNA 基因测序方法对19例患犬的子宫内脓液(PB 组)和9 例患犬子宫内膜组织(PP 组)的细菌进行测序,从而比较分析两者菌群特征。PB 组和PP 组共有28 份样本,经Illumina NovaSeq 测序得到的下机数据进行拼接和质控,得到2 243 247 条优化序列,再进行嵌合体过滤,得到1 697 886 条有效数据。为了研究各样本的物种组成,以97%的一致性进行了OTUs 聚类分析(图1),发现PB 组OTU 数量有5738个,PP 组OTU 数量有3788个,2 组一共有7741个OTU 数量,其中1785个OTUs 是2 组共有的,PB 组特有的OTU 数 量为3953个,PP 组 特 有 的OTU 数 量为2003个。
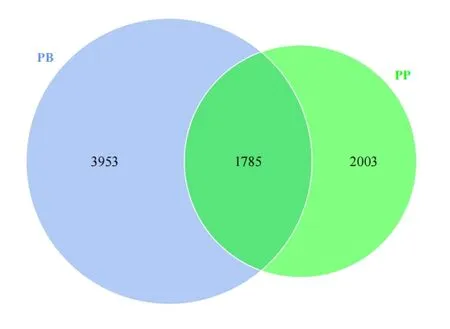
图1 PB 组和PP 组组间韦恩图Fig.1 Venn diagram in different groups
2.2 犬子宫蓄脓宫内菌群Alpha 多样性比较
PB 组和PP 组2 组样本在97%一致性阈值下的Alpha Diversity 多样性分析表明,指数Shannon、Simpson、Chao1、Ace 在2 组之间均无显著性差异(P>0.05),指数Coverage(即样本菌群覆盖率)均大于99%,说明样本中没有被测出来的概率极低。稀释曲线(A)的绘制,可以直观反应测序样本数量的合理性(图2)。Rank Abundance 曲线(B)的绘制,直观反应了样本中物种的丰富度和均匀度。2者表明,本试验测序取样数量合理。
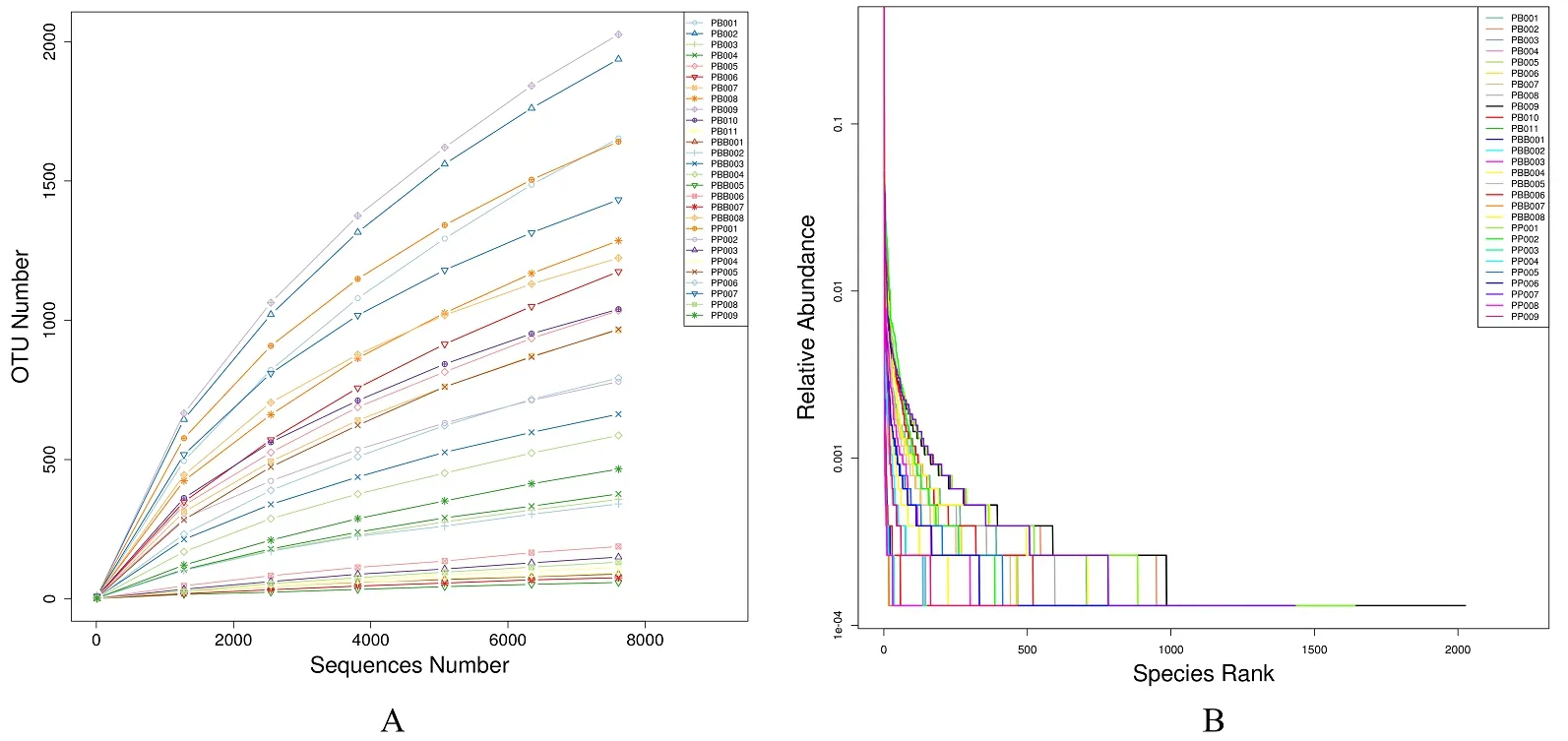
图2 犬的子宫蓄脓样本稀释曲线(A)和等级聚类曲线(B)Fig.2 Rarefaction Curve(A)and Rank Abundance(B)of canine pyometra samples
2.3 犬子宫蓄脓宫内菌群的物种相对丰富度
根据物种注释结果,选取PB 组19 份样本和PP 组9 份样本(图3A)以及PB 组和PP 组(图3B)在门水平上细菌丰富度排名前10 的物种,结果发现PB 组优势物种有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteriota)和脱硫菌门(Desulfobac⁃terota),丰富度依次为0.611、0.229、0.042、0.010和0.003;PP 组优势物种有变形菌门(Proteobacte⁃ria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroide⁃tes)、脱 硫 菌 门(Desulfobacterota)和A放 线 菌 门(ctinobacteriota),丰 富 度 依次为0.696、0.074、0.026、0.014 和0.012。其 中,PB 组 变 形 菌 门(Proteobacteria)显著低于PP 组,而厚壁菌门(Fir⁃micutes)显著高于PP 组(P<0.05)。
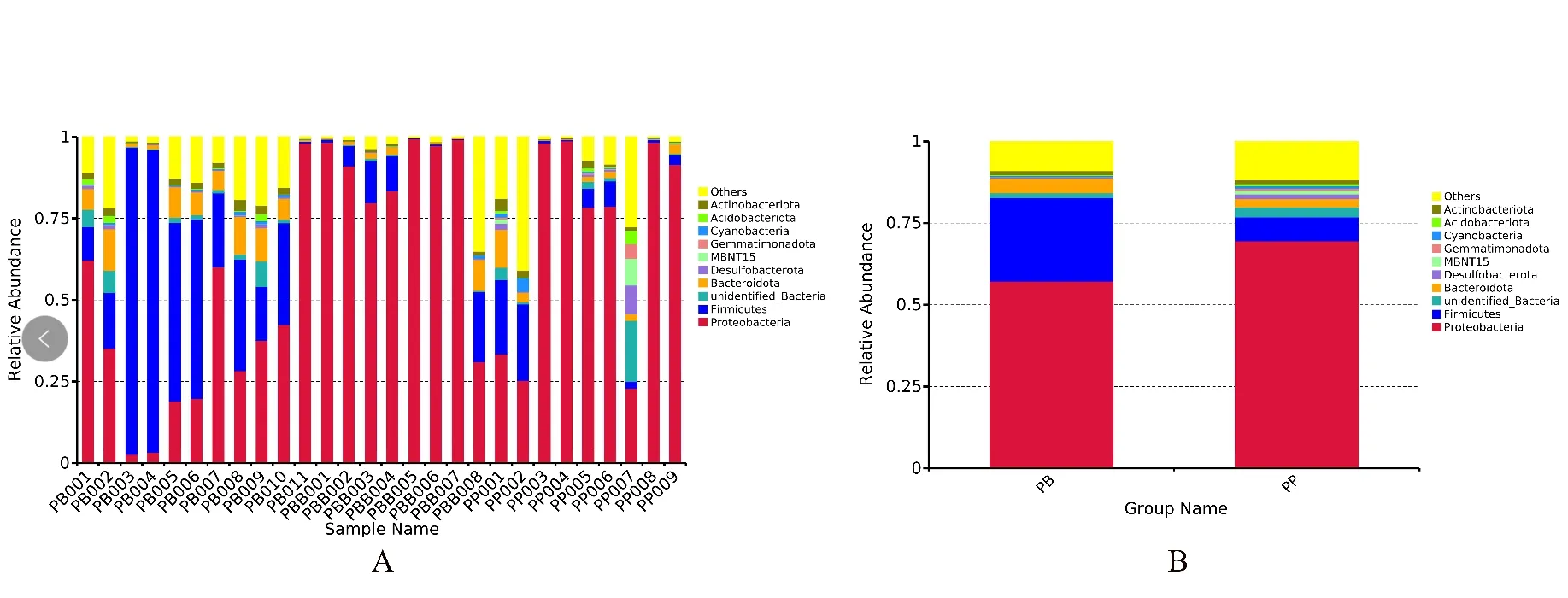
图3 PB 组和PP 组在门水平上相对丰度比较Fig.3 Comparison of phylum horizontal relative abundance of PB group and PP group
2.4 犬子宫蓄脓宫内菌群Beta 多样性比较
主 坐 标 分 析(principal co-ordinate analysis,PCoA)是在空间中,不同组样本间在二维平面上呈现出来的相似的距离。而样本间的距离是通过在二维平面坐标轴上所进行的不同角度的投影,从而找出最可以反应出原始距离分布的前2个坐标轴的值,常用于微生物的Beta 多样性分析。结果表明,如果在二维平面上两组样本的距离越接近,表明两组样本的物种组成结构是越相似的,因此群落结构相似度高的各样本就会在二维平面上倾向于聚集在一起,而群落差异很大的各样本就会远远分开。由图4可知,PB 组与PP 组样本菌群群落结构存在一定的差异。
2.5 犬子宫蓄脓宫内菌群LDA 差异贡献分析
LDA Effect Size 分析是一种用于发现和解释高纬度数据生物标识的分析工具。LDA 值分布柱状图中展示了LDA Score(线性判别分析影响值)大于4 的显著差异物种,如图5A所示,LDA Score大于4 的biomarker 共有30个,包括:脱硫菌属(De⁃sulfuromonadia)、志贺氏杆菌属(Escherichia_Shi⁃gella)、大肠埃希菌属(Escherichia_coli)、潘多拉菌属(Pandoraea)、支原体目(Mycoplasmatales)、支原体科(Mycoplasmataceae)、绿脓杆菌属(Pseudo⁃monas_aeruginosa)、嗜 血 杆 菌 属(Haemophilus)等。进化分支图圆圈由内向外代表了由门至属的分类级别,小圆圈的直径大小代表了相对丰富度,红色节点表示犬子宫蓄脓宫内脓汁组中起到重要作用的微生物,主要有支原体科(Mycoplasmatace⁃ae)、支 原 体 目(Mycoplasmatales)、希 万 氏 菌 科(Shewanellaceae)、交替单胞菌目(Alteromonad⁃ales),绿色节点表示犬子宫蓄脓子宫内膜组中起重要作用的微生物,黄色节点表示无显著差异的物种。
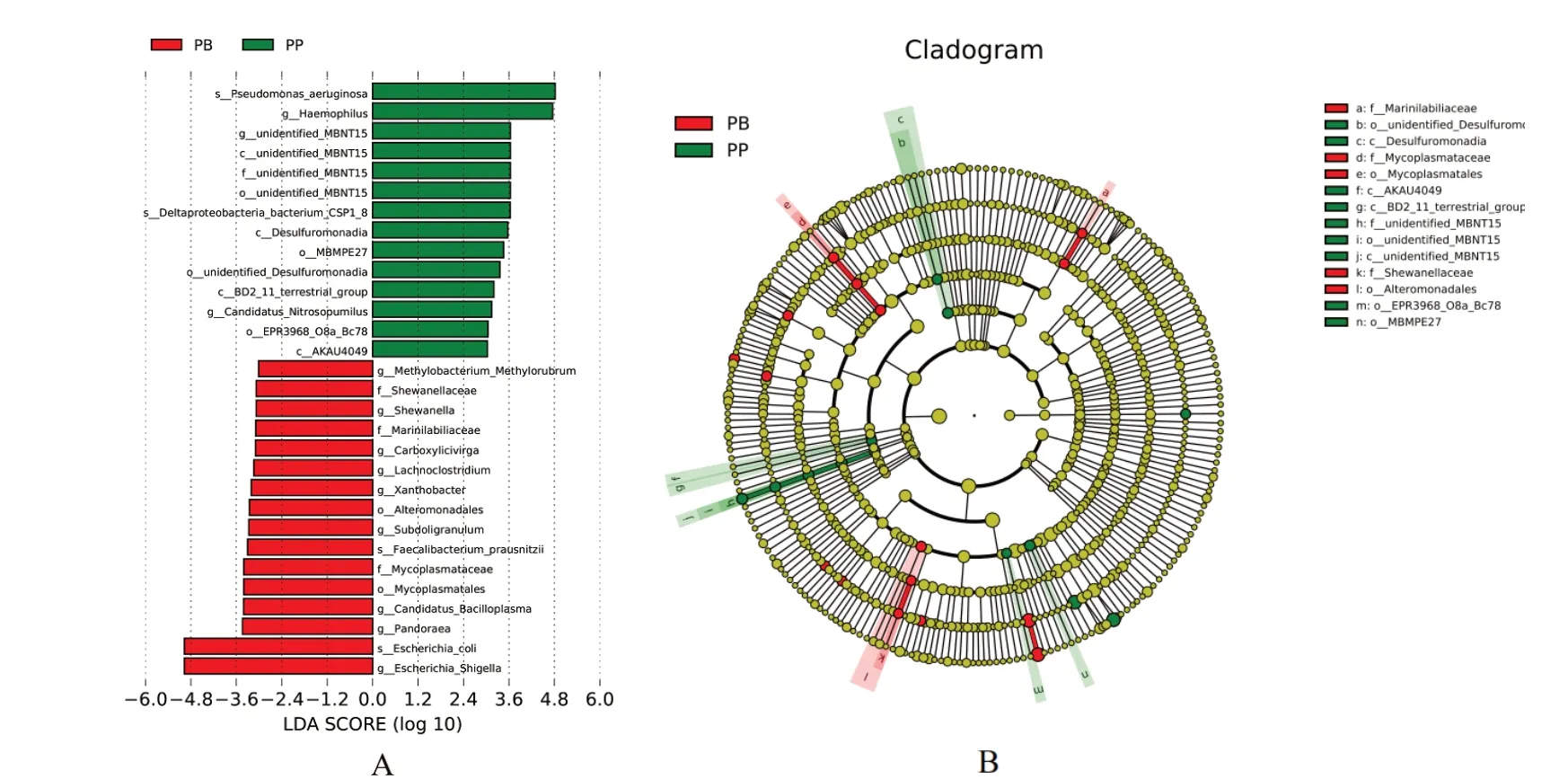
图5 PB 组与PP 组LDA 值分布柱状图(A)和进化分布图(B)Fig.5 LDA bar(A)and evolutionary(B)of PB group and PP group
3 讨论
近几十年,与伴侣动物犬繁殖有关的子宫类疾病逐渐增多,这给犬的健康造成了严重的威胁,同时给饲养犬的宠主带来了极大的身心和经济损失[9]。母犬是最容易诊断出严重的子宫病理变化的物种,而且诊断的患病率明显更高,这表明可能存在一些特定的机制可以导致犬的子宫内膜功能紊乱[9]。犬子宫蓄脓常发生于中老年母犬[9-10],但更年轻化的犬中也偶有发生[11]。激素和细菌因素对子宫蓄脓的发展起着重要作用。大肠杆菌是犬子宫蓄脓中最易分离出来的细菌,主要粘附在孕激素刺激的子宫内膜受体上,可导致感染[12]。目前,尽管学者对犬子宫蓄脓进行了广泛研究,但该疾病的发病机制仍是不清楚的。
子宫作为哺乳动物的生殖器官,临床上伴发各种疾病如慢性子宫内膜炎、子宫内膜异位症、子宫内膜癌等,且患者的子宫内存在丰富的微生物组。目前关于犬生殖道微生物群的信息很少,所有可用的数据都是通过培养技术获得的。有研究已证实,标准培养技术未能检测到90%的优势菌群,低估了多样性[13]。迄今,16S rRNA 高通量测序技术已被广泛用于肠道[14]、口腔[15]、乳房[16]、胰腺[17]、阴道[18]病变部位等的菌群组成结构研究。而子宫中的微生物群在化脓性子宫发育中的作用是怎么样的,可以用新的测序方法进行更详细的研究。在以往的研究中,对人的子宫内菌群研究较少,有关犬子宫蓄脓的子宫内菌群的特征分析在尚未报道。本研究通过16S rRNA 基因测序技术对犬子宫蓄脓的子宫内脓液和子宫内膜组织的菌群进行对比分析,发现患犬的子宫内脓液和子宫内膜组织均存在菌群且无明显差异,在门水平上主要是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteriota)和脱硫菌门(Desulfobacterota);发现患犬子宫内脓液和子宫内膜组织的Alpha 多样性无明显差别(P>0.05)。但通过Beta 多样性分析发现两组样本的菌群群落结构存在差异。其中,患犬子宫内脓液中的变形菌门(Proteobacte⁃ria)丰富度明显低于子宫内膜组织,而厚壁菌门(Firmicutes)明显高于子宫内膜组织,另外放线菌门(Actinobacteriota)和 脱 硫 菌 门(Desulfobacte⁃rota)在2 者内的丰富度也存在差异。为进一步筛选出2 组间显著差异的特异性细菌,进行了LDA差异贡献分析,结果发现2 组有30个物种存在显著性差异,其中患犬子宫内脓液中的志贺氏杆菌属(Escherichia_Shigella)、大肠埃希菌属(Esche⁃richia_coli)显著高于患犬子宫内膜组织,而绿脓杆菌 属(Pseudomonas_aeruginosa)、嗜 血 杆 菌 属(Haemophilus)显著低于患犬子宫内膜组织。因此,本研究通过对犬子宫蓄脓子宫内脓液和子宫内膜组织菌群的对比分析,以期为小动物临床子宫疾病微生物学防治提供参考。
4 结论
本研究发现子宫蓄脓患犬的子宫内脓液和子宫内膜组织均存在特异的微生物菌群和差异性物种,为小动物临床子宫疾病的微生物学防治提供了新思路,而目前犬子宫蓄脓的发病机理尚不清晰,还需进一步的研究。
