环境微生物的资源挖掘、代谢机制及其群落代谢功能的研究进展
2022-05-20林筱岚杨姝悦
林筱岚,杨姝悦,田 蕴
(厦门大学生命科学学院,滨海湿地生态系统教育部重点实验室,福建 厦门 361102)
微生物多样而灵活的代谢方式在其与无机世界和较高等生物之间的相互作用中不断进化,在生态系统中发挥不可替代的作用,参与生物群落及其自然环境的自我调控.早期环境微生物研究主要依赖于纯培养技术,在过去的30年中,依靠纯培养技术所进行的研究获得了一些有关自然生境中微生物的组成、物种多样性及其代谢活性等信息.然而,环境微生物仅有不到1%是可培养的,大多数为未培养微生物[1].大量微生物的不可培养性成为经典微生物学研究自然环境中微生物遗传多样性及其代谢功能的一大障碍.微生物通常是以群落方式共生于自然环境中,它们的很多特性和代谢功能均基于整个群落环境及个体间的相互影响,微生物群落作为一个整体其作用是不可忽视的[2].由于传统研究方法以及环境微生物本身(低丰度、未培养)等因素的限制,研究者们在试图打开微生物群落这个“黑匣子”揭示并利用微生物群体生态功能的研究上显得困难重重.
幸运的是,近年来分子生物学技术的发展,以及环境组学、微量分析技术、生物标记和同位素示踪等技术的进步,为人们认识环境微生物提供了有利的支持,新的微生物谱系及其新颖的代谢方式不断被发现和阐明.2005年第一株氨氧化古菌(ammonia-oxidizing archaea,AOA)纯培养株——NitrosopumilusmaritimusSCM1被分离获得,打破了自Winogradsky分离得到氨氧化细菌(ammonia-oxidizing bacteria,AOB)和亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)以来对氮循环的中心环节且是限速步骤的硝化过程仅由AOB与NOB介导的固有认知,NitrosopumilusmaritimusSCM1至今仍是海洋AOA生理研究的模式菌株[3];而厌氧氨氧化(anaerobic ammonium oxidation,Anammox)菌的发现则改变了人们对传统氮的生物地球化学循环的认识,即反硝化菌并不是唯一的产氮生物类群[4],并改写了全球氮循环模型;2006年,Raghoebarsing等[5]首次报道了厌氧甲烷氧化(anaerobic methane oxidation,AMO)偶联反硝化(denitrifying-AMO,DAMO)的富集物,并首次发现了偶联NO2-还原和AMO的NC10门细菌(CandidatusMethylomirabilisoxyfera)[6-7].DAMO是以甲烷作为电子供体,还原硝酸盐或亚硝酸盐而脱除氮素的新型生物反应.该反应的发现是对全球氮循环的一个补充,也是氮循环的一个新环节,偶联了自然界的碳素和氮素循环,作为碳、氮循环的重要桥梁,在自然生态系统中起着巨大的作用,其发现对加深全球碳、氮循环的理解亦具有重要的意义.另外,由于甲烷是地球大气中仅次于二氧化碳的第二号温室气体,它引起的温室效应是同等质量二氧化碳的20~30倍,DAMO作用对于减少甲烷排放、降低温室效应具有明显的效果.因此,在自然生态系统中,DAMO作用必定是碳、氮循环都将重点关注的内容.而DAMO作用可以实现甲烷与NO3-/NO2-的同时去除,其在环境工程领域中也极具应用价值[8].第一株降解二噁英细菌Sphingomonassp.strain RW1的分离[9],第一株苯并芘(benzo[a]pyrene,BaP)降解菌NovosphingobiumpentaromativoransUS6-1的获得[10],使得揭示微生物降解高生物毒性污染物的代谢途径和调控机制,以及通过基因操作来调控代谢途径、优化细胞功能、构建微生物细胞工厂进而高效去除有机污染物成为可能.自然界中的微生物可能还隐藏着许多未知的生理过程和功能,加上其极为庞大的生物量,其一举一动都将深刻影响着全球的环境变化.因此,对自然生境中微生物尤其是对反映其生存与进化潜力的分子机制的探索具有重大意义.
本研究团队致力于从生态学、生理学以及遗传学层面揭示自然环境中重要的微生物过程.早期的研究主要聚焦于环境因子如何影响微生物代谢驱动的碳、氮循环及有机污染物降解过程;随着分子生物学技术的发展,开始利用微生物靶向培养组、基因组、转录组、代谢组以及生物信息等技术,在物种水平、基因表达网络以及群落代谢功能水平上鉴别和预测微生物种群、群落驱动碳、氮循环及典型有机污染物降解的生理功能,以期应用于水域富营养化的控制、温室气体的减排以及污染环境的生物修复等实践中.
1 特殊代谢功能微生物资源的挖掘
微生物因其代谢多样性和遗传变异性使它们的酶体系能够以最快的速度适应外界环境的变化,能在各种不同的自然环境中生长.同时,微生物具有资源丰富、生长快速且容易改造等独特优势,具有分解代谢污染物和生物合成目标化合物的巨大潜能,已经在农业、工业、食品、制药、环境工程等领域有广泛的应用[11].尽管自然环境中仅有不到1%的微生物是可培养的,其余大多数为未培养微生物,但是实验室富集分离的传统纯培养方法对微生物生理生态功能的认识和利用做出了巨大贡献,提供了重要的遗传学分子资源.
本研究团队致力于从有害藻华防治、石油烃降解及氮污染物转化等方面开展特殊代谢功能微生物资源的挖掘工作,截至目前,已从近海、河口、滨海湿地以及大洋(印度洋)、极地等10余种生境的环境样品中分离得到超过500株的可培养菌,涵盖120个属,其中以芽孢杆菌(Bacillus)为优势菌属,假交替单胞菌(Pseudoalteromonas)、海杆菌(Marinobacter)和微杆菌(Microbacterium)紧随其后(图1).在这些菌株中,23株已经以新属(10株)或新种(13株)发表[12-34],涉及21个属,如交替赤杆菌(Altererythrobacter)、Chitinimonas和Mangrovitalea等.这些菌株在环境中分布广泛,从内陆至海洋涉及湖泊、近海、湿地及印度洋等生境,样品来源囊括表层水体、深海海水、沉积物、藻际及实验室条件的靶向富集培养体系等.从代谢功能上看,本研究团队基于定向分离手段获得了一批在污染物降解、环境净化等领域展现出应用前景的菌株:具有杀/抑藻能力的C.prasina等,具有烷烃降解能力的Sphingosinithalassobacterportus和Litorivitapollutaquae,具有PAHs降解能力的Muricaudazhangzhouensis、Algoriphaguszhangzhouensis和Sphingomonaspolyaromaticivorans,以及代谢方式灵活多样的兼性营养菌Nitrogeniibactermangrovi等.基于以上发现的微生物新种,本研究团队进一步联合多基因串联的基因组系统进化分析,系统性地阐明了细菌界中最大的一个纲γ-变形菌纲中4个目的进化关系,并提出2个新目以及3个新科,将Cellvibrionales和 海洋螺菌目(Oceanospirillales)整合至假单胞杆菌目(Pseudomonadales)中,这是迄今为止对γ-变形菌纲系统进化关系最大规模的梳理和调整[35].
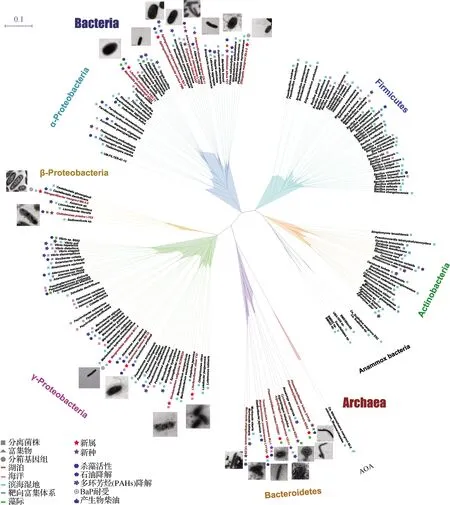
图1 分离菌株的样品来源、系统发育进化关系及代谢功(潜)能
1.1 杀/抑有害赤潮藻的功能微生物资源
随着工业化进程速度加快,海洋富营养化引发的赤潮问题日益突出.本研究团队针对有害藻华治理的问题,立足于“菌藻关系”,提出“以菌治藻”的策略,致力于杀藻菌株的分离筛选与杀藻机制的研究.目前已报道的杀藻微生物多通过分泌胞外杀藻物质的方式间接杀藻,国内外已对细菌间接杀藻开展了较多的研究,获得了大量杀藻活性物质[36-39],但这些活性物质在赤潮治理领域的应用中存在投入原位环境后杀藻生物有效性、生物安全性等问题.而与藻细胞直接接触的藻际微生物往往对藻类的生长具有更加密切且直接的影响,但直接杀藻的机制不明、分子背景不清楚等问题大大限制了杀藻菌的实际应用.本研究团队前期分离得到了一株具有杀藻活性的菌株C.prasinaLY03[21],且杀藻谱检测表明其对甲藻门的微小亚历山大藻(Alexandriumminutum)、东海原甲藻(Prorocentrumdonghaiense)、锥状斯氏藻(Scrippsiellatrochoidea),黄藻门的赤潮异弯藻(Heterosigmaakashiwo)及绿藻门的亚心型扁藻(Tetraselmissubcordiformis)等均具有杀藻效果.值得注意的是,菌株LY03表现出了对藻细胞的趋化特性,并可能通过直接作用方式杀藻[40].进一步以假微型海链藻(Thalassiosirapseudonana)细胞为研究对象,通过生理生化检测及基因组、转录组分析发现菌株LY03的直接接触可使藻细胞的光合作用及抗氧化系统等严重受损,细胞内容物流失,最终导致藻细胞裂解死亡.
此外,本研究团队从有害赤潮原因种塔玛亚历山大藻(A.tamarense)的藻际分离得到27株具有杀藻活性的菌株,涵盖气单胞菌(Alteromonas)、盐单胞菌(Halomonas)、假交替单胞菌、弧菌(Vibrio)、科贝特氏菌(Cobetia)和海源菌(Idiomarina)6个属,其中假交替单胞菌、弧菌和气单胞菌为优势菌属.假交替单胞菌对塔玛亚历山大藻的杀藻活性在许多研究中都有报道,如Su等[41]和黄姿等[42]均分离得到隶属于假交替单胞菌的菌株,发现它们能够通过分泌具有杀藻活性的化合物特异性地抑制甚至杀死塔玛亚历山大藻;同时,Sun等[43]发现假交替单胞菌还对红色赤潮藻(Akashiwosanguinea)具有杀藻活性,该菌能通过直接和间接两种模式进行杀藻.在本研究团队分离获得的6株具备杀藻活性的弧菌菌株中,Vibriosp.BS02对许多有害藻种表现出不同程度的杀藻活性,并进一步获得了Vibriosp.BS02分泌的杀藻活性物质,在有害藻华的控制和治理方面展现出应用潜能[44].
1.2 海洋兼性营养细菌新物种的发现
微生物的代谢模式远比人们想象的复杂,其代谢途径多样,除了光合自养和有机异养之外,还有化能自养(chemoautotrophy)、化能异养(chemoheterotrophy)、光能异养(photoheterotrophy)和兼性营养(mixotrophy)等.其中,兼性营养微生物由于其代谢方式灵活多样,在寡营养且多变的水域环境中占据着重要的生态位.目前,对海洋兼性营养微生物的研究主要集中于鞭毛虫、微藻、螺旋藻(Spirulina)等真核生物,而对兼性营养细菌的研究却屈指可数.蓝细菌是较早被发现的具有兼性营养特性的细菌,一般认为这一类群在海洋环境中主要进行光合自养代谢[45],而许多研究证实它们也具有利用有机物的能力[46].此外,研究者们还发现了少数无光合色素而依靠化能产能的兼性营养细菌,代表菌株包括具有反硝化能力的脱氮副球菌(Paracoccusdenitrificans)[47]、可氧化硫代硫酸盐的硫杆菌(Thiobacillus)[48]和Xanthobactertagetidis[49],以及可氧化铁离子的酸小杆菌(Acidimicrobium)[50]等.由于兼性营养菌具有代谢灵活性,它们面对环境变化表现出的适应性要比其他专性营养菌高得多.因此,在生存环境发生变化时,它们仍可以维持自身生长,甚至为其他微生物提供营养来源.然而,由于缺乏来源于不同生态环境的具有代表性的纯培养模式菌株,人们对于这些兼性营养微生物的多样性和生理功能的鉴别、代谢方式转换的调控机制及生态相关性还知之甚少.因此,兼性营养微生物对生态系统中生物量的贡献及其对生物地球化学循环的重要性可能一直被低估.
本研究团队通过对红树林湿地沉积物进行BaP胁迫下的富集培养,分离得到大量可培养菌株.其中菌株M9-3-2的16SrRNA基因的最大序列相似度仅为93.6%,系统发育分析及生理生化特征检测结果表明其为红环菌目动胶菌科的新属,命名为NitrogeniibactermangroviM9-3-2[30].进一步的全基因组分析及生理生化特征检测发现,菌株M9-3-2与动胶菌科其他种属的微生物相比分类地位新颖,生理代谢方式更为灵活多样,兼具化能无机自养和化能有机异养特征:其具有完整的CO2自养固定途径,可以NaHCO3为唯一碳源自养生长,同时还具有氰化物裂解酶、乙腈裂解酶以及硝基烷烃单加氧酶,可利用有机碳源异养生长;通过对注释基因的进一步分析发现,菌株M9-3-2兼具固氮和反硝化代谢通路,并且通过实验验证该菌株为兼性厌氧菌,能够应对多种生存环境,在极端环境下能够通过聚集的方式维持自身生存,对BaP具有耐受性及潜在的降解能力,在好氧和厌氧的条件下都具有反硝化活性,显示出其代谢方式灵活多变以应对不同的生存环境.海洋兼性营养细菌新物种的发现丰富了兼性营养微生物模式菌株资源,有利于兼性营养微生物的分布和生理功能的鉴别、代谢方式转换的调控机制及其在自然生态系统和环境工程系统中生态功能等研究工作的开展.
1.3 石油烃降解菌的定向富集与分离
随着经济发展,石油已成为全球海洋环境中数量最大、危害严重的最主要的有机污染物.鉴于微生物修复在石油污染治理中的应用前景,本研究团队基于石油污染富集体系对石油降解微生物进行定向驯化与分离,目前得到50余株具有石油降解能力的细菌,隶属于食烷菌(Alcanivorax)、芽孢杆菌、Castellaniella、鞘氨醇单胞菌(Sphingomonas)、假单胞菌(Pseudomonas)、海旋菌(Thalassospira)、海杆菌、赤杆菌(Erythrobacter)及交替赤杆菌等22个属,其中食烷菌、芽孢杆菌、交替赤杆菌和Castellaniella为优势菌属.食烷菌是专性石油降解菌,具有广泛降解石油烷烃的代谢功能[31,51].本研究团队分离得到的6株食烷菌与柴油食烷菌(A.dieselolei)、海洋食烷菌(A.marinus)、A.profundi等菌种的系统发育进化地位最相近,后经实验证实,这6株菌均对柴油具有降解能力,能够降解C14~C28的中长链烷烃.芽孢杆菌也是常见的石油降解菌[52],本研究团队分离获得的4株芽孢杆菌菌株均能够降解C14~C22的中等长度烷烃.隶属于交替赤杆菌的4株菌和食烷菌展现出相当的降解能力,同样能够降解C14~C28的中长链烷烃.
无论是历史遗留还是新生污染,PAHs的环境残留一直是持续危害人类健康和生态安全的全球性问题.微生物介导的生物降解被认为是彻底去除PAHs污染最重要的途径.本研究团队采用改进的平板升华技术,分别从近海海域的表层海水、表层沉积物、河口海岸红树林湿地沉积物以及深海沉积物中筛选获得多株高效的PAHs降解菌,隶属于30个属,其中芽孢杆菌、弧菌、Limnobacter和Labrenzia为优势菌属.芽孢杆菌因其强大的环境适应性广布于各种生境中,经常从污染环境中分离得到,该类群中的许多菌株已被证实具有PAHs降解能力:如B.cereus在甲烷营养条件下可降解120 mg/L荧蒽,B.subtilis能够通过不同代谢路径降解高分子量PAH-BaP[52-53];同时,许多芽孢杆菌还能够产生、分泌表面活性剂,进一步促进疏水性强的PAHs的生物降解[54].这些代谢特征使得芽孢杆菌成为生物修复领域的热门工具.此外,本研究团队还分离获得来自于鞘氨醇单胞菌、假单胞菌和新鞘氨醇杆菌(Novosphingobium)等常见降解菌属的菌株.这3个属内包含许多芳烃降解者,具有很高的分解代谢多样性,底物广泛[55],包括极难降解的高分子量PAHs[56-58].通过实验验证,从厦门博坦油码头分离得到的S.polyaromaticivorans能够降解2~4环的PAHs[17].这些纯培养降解微生物的地理分布、分类地位以及对PAHs的降解特性均不同,可以作为开发PAHs污染生物修复技术的菌源,更重要的是可以作为研究PAHs生物降解机制的模式菌株,为深入探究PAHs降解代谢通路、挖掘新颖的降解酶系、解析菌间关系,甚至构建高效降解高分子量PAHs的微生物群组提供宝贵的资源,为开发具有普遍意义及应用价值的生物修复技术奠定基础.
2 降解功能微生物对高生物毒性PAHs胁迫的响应与降解机制
PAHs是一类由两个或两个以上的苯环以线形排列、弯接或簇聚的方式构成的有机物.随着苯环数量的增加,其脂溶性越强而水溶性越低,且致癌、致畸、致突变效应也随之增强.作为最早发现且数量最多的致癌物,目前已发现的致癌性PAHs及其衍生物已超过400种.作为持久性有机污染物,PAHs还具有生物蓄积性、长距离迁移性等特性,是全球普遍存在的污染物,严重威胁着人类健康和生存[52].微生物分解代谢是PAHs污染物自然消除的主要方式.微生物是自然界经过漫长的进化过程而最终选定的分解者,具有强大的降解能力,几乎能降解世界上所有的有机物,包括人工合成的有机化合物,这使其在处理典型环境有机污染物方面具有巨大的潜力.然而,土著微生物的降解能力和底物作用范围十分有限,通过基因工程优化降解菌,可以更有效地修复PAHs污染[55].PAHs污染在环境中以多种形式存在,在不同的环境中需要微生物具有降解不同类型污染物的能力.这不是简单地改造一个或几个基因就能够解决的,需要对微生物进行系统全面的改造,并针对不同的环境设计和构建不同的工程菌.因此,从全局水平上寻找分解代谢功能基因资源及构建难降解化合物代谢菌株的代谢网络是解决这些问题的关键.
目前,人们对PAHs的微生物降解机制更多的是关注代谢途径的解析,而对于微生物如何与PAHs分子相互作用,通过何种方式介导PAHs进入细胞,以及如何响应PAHs污染的降解机制的研究较少,特别是对其分子基础的研究十分欠缺.为此,本研究团队以一株能降解2~5环PAHs的海洋细菌N.pentaromativoransUS6-1为模式菌株,以5环的PAH-BaP为研究对象,采用比较转录组学、关键基因敲除和回补、代谢产物分析、蛋白质与小分子相互作用以及蛋白质与蛋白质相互作用等研究手段,探究菌株US6-1感应、转运和分解代谢PAHs的分子机制(图2),旨在为定向优化微生物功能,提高微生物转化和降解高分子量PAHs(尤其是高生物毒性的BaP)的能力奠定分子基础.
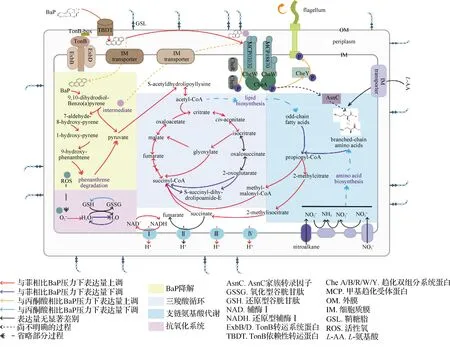
图2 BaP胁迫下菌株US6-1的细胞代谢重构
2.1 外膜转运蛋白TBDT参与菌株US6-1对PAHs的跨膜转运[59]
底物的摄取与跨膜运输是微生物分解代谢有机污染物的起始步骤,揭示微生物捕获PAHs的分子转运机制是实现有机物污染生物修复的重要前提.环境中的PAHs以多组分存在,并具有疏水性、难降解性和痕量性等特性,给生物降解技术的实际应用带来很大困难.由于PAHs的热稳定性与疏水性随着苯环数的增加而逐渐增强,加上它们紧密吸附于颗粒物上,4环及4环以上的高分子量PAHs的生物降解难度大大高于低环PAHs.而PAHs的高度疏水性无疑成为微生物吸收和降解PAHs时需首先解决的问题.本研究团队对菌株US6-1在PAHs胁迫下的转录组测序分析发现,在5环PAH-BaP胁迫下,有38个TBDT基因表达显著上调.为探明TBDT是否参与菌株US6-1中BaP的摄取和转运,本研究团队构建了关键的TBDT基因缺失的突变株.结果发现,这些突变株的生长状态与野生型菌株没有明显差异,但其对PAHs的降解能力下降,特别是缺失了编码tbdt-11基因的突变株Δtbdt-11,几乎丧失了对PAHs的降解能力.同时发现,在BaP胁迫下,Δtbdt-11的细胞表面疏水性明显低于野生型菌株.此外,在Δtbdt-11中,编码PAHs降解酶的基因转录活性显著降低.通过共聚焦显微镜观察发现,菌株US6-1可以通过外膜转运BaP,但经质子动势解偶联剂处理后,野生型菌株US6-1的转运能力显著降低,进一步证实了tbdt-11基因与PAH主动运输相关.这是目前获得的首个关于外膜蛋白TBDT参与疏水性PAHs跨膜主动转运的生物学实验的证据,为实现疏水性PAHs跨膜转运元件的设计与构建奠定了分子基础.
2.2 MCPs在菌株US6-1趋化和降解BaP过程中的功能[60]
细菌的趋化性(chemotaxis)能够增强细菌在自然界中降解污染物的效果,已知细菌对芳香化合物有趋化能力,但具体是如何感知化合物的并不清楚.细菌趋化性是指有运动能力的细菌对有利环境的趋附和对有害环境的避离运动,此行为是通过感应环境信号和调整鞭毛旋转方向获得的.微生物不能依赖传质强化手段获取烃,尤其是在常温下保持固态的PAHs,因此这一运动性尤为重要.以前有关微生物对烃的摄取和烃降解菌的生长模型,很少考虑细菌趋化性的影响,这显然是需要改进的.在本研究团队的研究中:趋化性检测结果显示,菌株US6-1不仅对3环PAH菲(phenanthrene,Phe)、4环PAH芘(pyrene,Pyr)和5环PAH-BaP具有趋化性,对它们的代谢产物也具有趋化性;基因组分析发现,菌株US6-1中有4个MCPs含有配体结合域,可能与菌株US6-1趋化PAHs及其代谢产物相关;通过突变体构建、细菌双杂交实验、表面等离子共振等分析,首次发现菌株US6-1甲基趋化受体MCP03030和MCP18870能特异性地识别和结合PAHs及其代谢产物,触发菌株US6-1对PAHs尤其是高分子量PAH-BaP的趋化,并通过趋化双组分系统的下游信号通路在菌株US6-1转运、适应与降解BaP过程中发挥重要作用.
2.3 菌株US6-1降解BaP的代谢路径
微生物降解有机污染物的能力来源于微生物自身的基因组以及与之相对应的具有生物学功能的蛋白质等功能大分子,它们构成了微生物基本的代谢网络,决定了利用微生物解决有机物污染的范围和能力.近年来,对微生物降解PAHs技术应用领域的研究已经取得了初步的发展,但是对微生物分解代谢的理论研究总体上还十分欠缺,尚未发现足够丰富的PAHs降解基因资源,尤其是4环以上的PAHs降解基因,对PAHs分解代谢的调控研究也不够深入.由于PAHs由多个苯环以平面、角环或簇状组合而成,微生物可多位点攻击相应的苯环,这使得PAHs分解代谢具有复杂和多样的PAHs降解酶系和调控机制.要解决这些问题,就必须从微生物分解代谢的分子基础入手,解析微生物分解PAHs的代谢途径,寻找具有特定催化降解能力的酶,表征各种降解酶系并阐明其催化机制.此外,微生物代谢途径之间还存在相互联系和作用,它们构成受环境因子调控和影响的复杂代谢网络,因此,以微生物降解PAHs的调控为模式,明确基因型与代谢表型的关系,从分子水平上阐明细胞调控网络和代谢网络之间的关系,从而逐步解析细胞代谢有毒污染物的调控机制.本研究团队首先通过比较转录组筛选出菌株US6-1中可能参与PAHs代谢的功能基因,然后利用基因敲除、蛋白表达等手段逐步验证基因功能,再通过构建报告质粒、基因敲除、凝胶迁移率实验等方法研究了PAHs降解和细胞响应BaP压力的分子调控机制.同时,利用气相色谱-质谱联用检测菌株US6-1降解BaP过程中的代谢产物,推测出菌株US6-1中PAHs的降解通路:BaP在C-7,8位开环时,下游产物可以通过Pyr和Phe的路径进一步降解;Pyr会通过C-4,5位的开环,代谢进入Phe的降解路径;Phe则可以在C-3,4位进行开环反应,进入已发现的降解路径.这些结果为指导通过基因操作来调控代谢途径及代谢功能进而高效地降解环境有机污染物提供了理论基础.
3 微生物群落水平代谢功能的甄别与利用
微生物在生态系统中并不是独自发挥功能的,通常是以群落方式共生于环境中,它们的很多特性和代谢功能均基于整个群落环境及个体间的相互影响.微生物群落水平的代谢功能是不同菌群之间合作、竞争、捕食等交互作用的结果,而这些菌间关系有些是生态水平上的(例如拮抗关系),有些是代谢水平上的(例如偏利共生关系).但由于微生物之间相互作用关系的复杂性及其对环境因子变化的敏感性,在自然环境中直接找寻目标微生物与相应功能的关系十分困难,因此需要集成高通量分析和生物网络技术,深入研究微生物群落的结构和相互关系[61].近几年,微生物分子生态学和宏组学技术的蓬勃发展,以及计算机技术和数学模型的崛起,加速了人们对微生物群落水平功能和菌群相互作用的理解.
红树林湿地位于河口入海处,是阻止陆地污染向海洋生态系统扩散的一道坚固的大门,是海洋污染净化工程的重要参与者,而红树林湿地微生物则是肩负这一重要使命不可替代的“特种兵”.红树林湿地微生物与系统内的其他因素共同作用,使得地处河口海岸潮间带的红树林在减少滨海地区污染、净化水域环境、减少污染物在水域生态系统食物网中的积累上有着重要作用.红树林湿地中丰富而又不失特色的微生物资源及其活跃而又多样的生理活性,是研究微生物群落代谢功能的天然宝库.为了探究红树林湿地微生物群落结构和功能特征,本研究团队以福建省云霄县红树林湿地为研究区域,通过理化参数分析、16SrRNA基因高通量测序及宏基因组分析,揭示该生境的环境理化特征、微生物群落的多样性、结构及其功能特征[62].结果发现,漳江口红树林湿地呈现出富碳、多硫而氮限制的特征.基于16SrRNA基因及宏基因组的系统发育进化分析发现:绿弯菌门、硝化螺旋菌门以及变形菌门中的δ-和ε-变形菌纲在该生境中的优势十分明显,而这些类群的微生物大多与硫代谢有关,它们的优势与生境多硫的特点相呼应,展现出具有环境适应性的微生物群组结构特征.在功能代谢层面上,宏基因组结果显示,红树林微生物群落驱动的关键地球化学循环具有明显的方向性:在氮代谢通路中,氨化、硝酸盐异化还原路径的优势最为显著;而在硫代谢中,硫酸盐还原占绝对优势.这些研究结果表明:微生物群组对红树林生态系统的高生产力及高效的元素循环具有重要的贡献,对红树林生态系统的健康及多样性具有指示作用;此外,微生物群落能够在特定的环境条件下对结构和功能进行重新组装,展现出强大的环境适应性和代谢灵活性.那么,在高毒性污染物输入时,微生物群落是否也会重新组装自身结构与功能以应对环境变化?这是否能够为污染物生物修复提供有价值的信息?
自然环境中的微生物往往是以群落方式共生的,而PAHs的降解大多是通过不同菌株之间合作完成的,且PAHs环数越高,菌间合作也越明显.与单菌相比,微生物群落能够通过菌群的代谢交联获得单菌无法比拟的代谢可能性,例如有效地利用结构复杂的底物,或获得更高的环境胁迫抵御能力等[2].因此,利用微生物群落去除污染物,已成为环境污染生物修复的有效手段之一.然而,自然环境中的微生物群落多样性极高,菌群之间的相互作用关系错综复杂,并且原位修复的效率往往较低,可控性差,难以达到理想的去除效果.因此,相对自然菌群和单菌而言,基于对微生物群落结构与功能的理解,定向筛选功能微生物并进行组合,形成功能型微生物群组,是高效完成一些单一菌种或自然微生物群落难以完成的工作的有效手段.目前,微生物群组已应用于许多生物修复案例中.Mishra等[63]基于Aspergilluslentulus、A.terreus和Rhizopusoryzae3株菌构建了人工菌群,实现了金属-染料复合型污染的修复;而Wanapaisan等[64]也通过人工菌群的构建实现了PAH-Pyr的高效降解.因此,从群落水平上探究微生物降解高分子量PAHs的代谢机制、解析菌群之间的合作关系,并以此为线索构建降解功能微生物群组,是突破高分子量PAHs降解瓶颈的有效手段.鉴于红树林生境蕴藏了丰富微生物资源的天然优势,针对高环PAHs的降解难题,本研究团队以5环PAH-BaP作为代表污染物,以红树林沉积物中的微生物群落作为研究对象,运用16SrRNA基因扩增子、鸟枪法宏基因组测序及生物信息分析等研究手段,从微生物群落的多样性、结构演替、菌间关系、功能代谢等方面入手,解析微生物群落对BaP的响应和降解代谢过程,识别潜在的关键菌种.
关键物种(keystone taxa)是微生物群落的指挥者,驱动着微生物群组的结构与功能[65],从菌间关系水平上识别BaP压力下的关键物种,解析关键物种间关系的变化,是理解微生物群落响应和BaP降解过程的重要切入点.因此,在16SrRNA基因数据集基础上,本研究团队构建了时序性共现菌间关系网络,对红树林微生物群落中不同菌群之间的相互关系及其动态变化进行解析.结果发现,在BaP压力下,红树林微生物群落形成了复杂程度更高、更致密的合作共生模式,说明BaP污染刺激了更多菌间关系的产生.被刺激产生的合作共生主要发生在变形菌门、酸杆菌门和拟杆菌门这3个类群之间.根据拓扑角色鉴定,隶属于拟杆菌门的Robiginitalea、变形菌门的新鞘氨醇杆菌和Marinicella被鉴别为关键物种.本研究团队进一步基于鸟枪法宏基因组测序从功能水平上解析了红树林微生物群落对BaP污染的适应与降解代谢过程.结果发现,除PAHs降解通路外,过氧化物酶、硫醇化合物等氧化胁迫抵御机制[66]及生物膜形成[67-68]等抗逆相关功能基因也被显著富集,这很可能是微生物群落抵抗BaP氧化胁迫的响应机制之一,说明帮助群落抵御BaP胁迫的辅助成员可能在BaP降解代谢过程中起着重要作用(图3).这些结果为合理设计和构建高效降解BaP的微生物群组奠定了基础.

图3 红树林沉积物中微生物群落对BaP污染的响应与降解过程
4 自然生境中微生物群落代谢驱动元素循环功能的表征
生物地球化学循环主要由碳、氮、硫、磷和金属元素等循环组成,在地球环境不断改变的漫长历史中,微生物在其中发挥着关键性作用[69].近年来,随着分子生物学技术的飞速发展,研究者发现了很多新的微生物谱系.新的微生物代谢方式的阐明,使得关键生物地球化学循环理论不断被修正和完善.如Anammox菌的发现,改变了人们对传统氮的生物地球化学循环的认识,反硝化菌并不是唯一的产氮生物类群[70];而好氧反硝化菌的发现更新了人们对反硝化过程在有氧条件下也可以进行的认识.最近Rabus等[71]报导了一株分离自海洋微氧区的新固氮菌,其在底物利用和能量获取机制方面具有很高的多样性和灵活性,预测其可能广泛分布于较大的地理范围内,对海洋氮的输入有很大的贡献.
滨海湿地红树林生态系统的生产力极高,这归功于它所拥有的高效营养循环系统,其中微生物活动起着非常重要的作用,是驱动红树林生态系统中营养转化的主要引擎,在元素循环过程中具有极其重要的意义.红树林湿地中丰富而又不失特色的微生物资源还隐藏着许多未知的生理过程和功能,加上其极为庞大的生物量,深刻影响着海洋乃至地球的环境.因此,揭示全球变化背景下,微生物在红树林沉积物碳流的形成、氮的转化、硫的还原等过程中的作用及其与红树植物之间的营养关系机制,为进一步开发利用特殊环境功能的微生物资源,理解和表征红树林湿地元素循环的机制和规律的意义重大.本研究团队通过野外长期观测和控制实验,采用传统培养技术结合宏组学等现代方法系统研究了红树林湿地沉积物及根际微生物群落的多样性和代谢特征,采用分子标记探针和稳定同位素示踪技术,探讨了人类活动影响下红树林湿地微生物群落如何通过碳、氮、硫等循环过程维持其自身及系统内生物多样性的机制.如图4所示,研究获得了大量红树林生境特异性微生物种质和富集物资源.以红树林湿地沉积物中的微生物群落尤其是参与氮循环的功能微生物为研究对象,以16SrRNA基因和功能基因(氨单加氧酶基因amoA、肼氧化酶基因hzo、硝酸盐还原酶基因narG和亚硝酸盐还原酶基因nirS)为标记,采用功能基因文库和定量PCR等技术手段,研究红树林湿地沉积物中参与氮循环功能的微生物的分布、丰度及功能,结果发现,红树林湿地沉积物中AOA对硝化作用的贡献高于AOB,存在丰富的Anammox菌;来自氮转化功能微生物DNA和RNA水平的数据显示,红树林湿地沉积物中的硝化作用、Anammox作用和反硝化作用具有潜在的协同脱氮功能[72].采用稳定同位素示踪技术、系统发育和功能基因分子标记等方法,首次在红树林沉积环境中发现了氮循环的新环节N-DAMO,沉积物中的NO2--AMO活性贡献了红树林湿地系统中2%~6%甲烷的氧化,是以往湿地系统中被忽视的甲烷汇,也是潜在的链接碳、氮循环的桥梁[73].同样采用稳定同位素示踪技术、系统发育和功能基因分子标记等方法,对漳江口红树林湿地沉积物垂直剖面Anammox菌的多样性、丰度和反应活性进行了评估,观察到Anammox菌在红树林沉积物的不同深度广泛分布,并在深层驱动大规模的Anammox反应,发现漳江口红树林沉积物中的Anammox过程能够减少5.4%的外源氮负荷,是湿地系统中重要的无机氮汇[74].这些研究结果可为全球氮循环模型的升级提供具有区域特色的数据支撑.
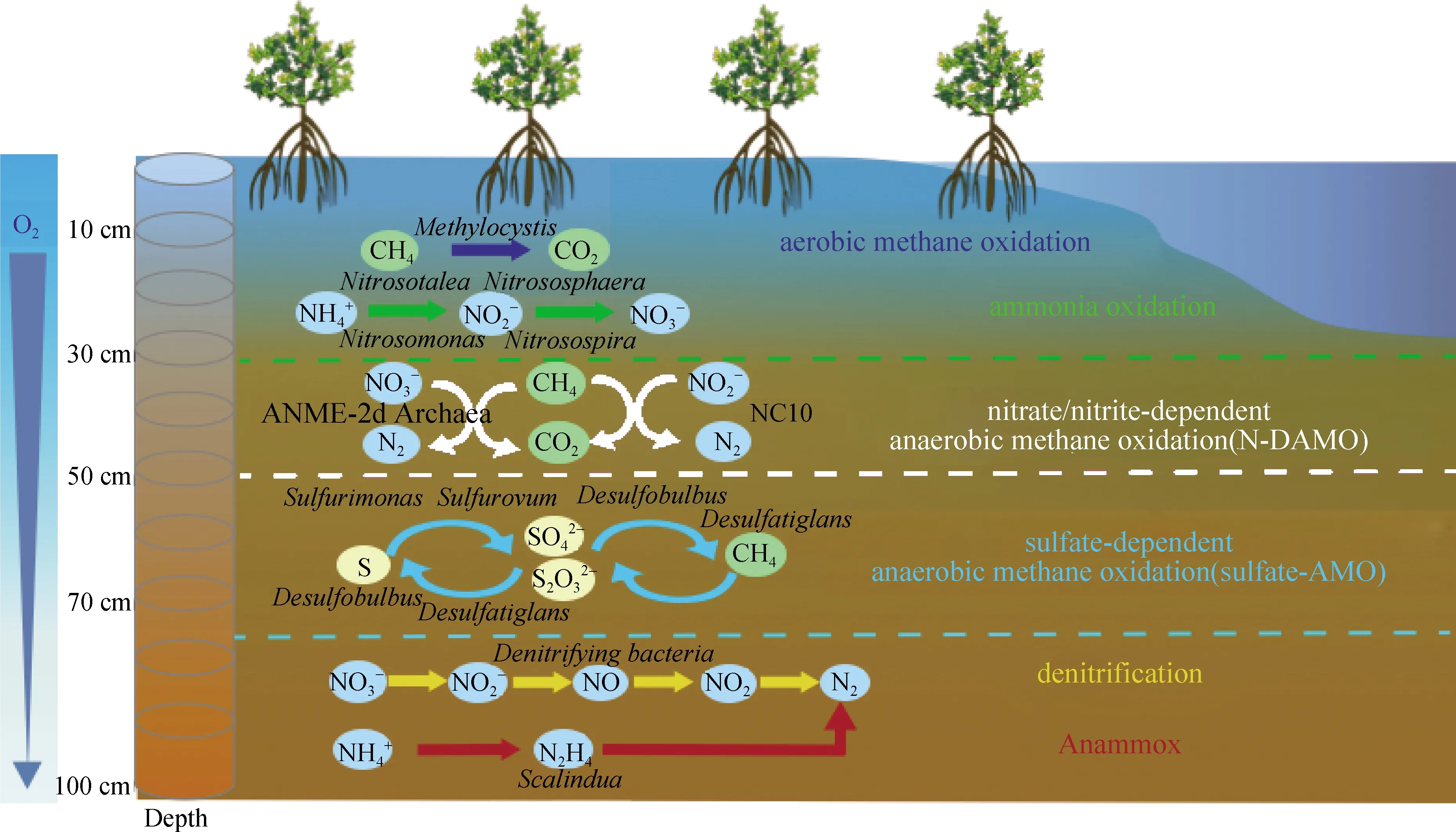
图4 红树林沉积物中微生物群落驱动的碳、氮、硫代谢路径
5 总结与展望
随着分子生物学、环境组学以及生物信息学工具和技术的发展,环境微生物学研究已进入一个崭新的时代,研究者对微生物角色的认识已从传统生态系统的生产者(producer)和分解者(degrader)拓展到关键生物地球化学循环的驱动者(driver)、链接者(linker)以及环境变化的指示者(indicator)和调控者(regulator),并可能还有许多未知的角色功能有待发现.对微生物纯培养资源的研究,有望在分子和细胞水平发现和阐明微生物代谢的新途径和新机制,为优化微生物细胞功能提供分子元件和改造策略,实现环境污染物在模式生物中的智能降解以及目标化合物的绿色合成;同时也为在自然生态系统和工程系统(生物修复、工业处理、发酵工程等)中跟踪、鉴别和优化微生物功能提供分子标记和强化方案.深入开展微生物群落水平代谢机制的研究,有望推动元素循环新环节的发现,揭示不同元素循环之间的偶联机制,从时空维度上理解微生物之间、微生物与环境之间的相互作用模式,实现全球变化背景下生物地球化学循环的微生物表征以及生态系统功能的诊断和预测.而二者的有机结合有望为解决人类目前面临的食品与医药短缺、环境污染、能源危机和水资源匮乏等重大问题,实现国民经济的可持续发展战略提供理论与技术支撑.
