大口黑鲈肿瘤坏死因子-α诱导蛋白2基因克隆及免疫相关基因表达
2022-05-20聂一帆马艳平冯国清刘振兴曹俊明
聂一帆,吴 静,马艳平,郝 乐,冯国清,刘振兴,曹俊明
大口黑鲈肿瘤坏死因子-α诱导蛋白2基因克隆及免疫相关基因表达
聂一帆1,2,吴 静2,4,马艳平2,郝 乐2,冯国清2,刘振兴2,曹俊明1,3
(1. 仲恺农业工程学院动物科技学院,广东 广州 510225;2. 广东省农业科学院动物卫生研究所 / 广东省畜禽疫病防治研究重点实验室农业农村部兽用药物与诊断技术广东科学观测实验站,广东 广州 510640;3. 广东海洋大学,广东 湛江 524088;4. 华南农业大学兽医学院,广东 广州 510642)
【】克隆大口黑鲈() 肿瘤坏死因子-α诱导蛋白2 (Tumor necrosis factor-alpha induced protein 2,TNFAIP2) 基因,命名为,探究在大口黑鲈免疫应答中的作用。根据转录组中编码序列(CDS)设计引物并克隆该基因;利用DNAMAN等软件和SMART等预测并分析MsTNFAIP2氨基酸序列理化性质和结构;用实时荧光定量PCR分析在鱼诺卡氏菌() 和脂多糖刺激前后及、、和的mRNA表达变化。成功克隆CDS序列,长度为1 932 bp,共编码644个氨基酸,有一个Sec6超家族结构域;与鳜 () TNFAIP2氨基酸序列同源性最高,为74.84%;鱼诺卡氏菌和脂多糖刺激后,及、、和mRNA表达水平在头肾、脾脏和淋巴细胞中显著上调 (< 0.05)。参与了大口黑鲈免疫应答。
大口黑鲈;肿瘤坏死因子-α诱导蛋白2;基因克隆;基因表达;脂多糖;鱼诺卡氏菌
肿瘤坏死因子(Tumour-necrosis factor, TNF) 是主要由单核巨噬细胞产生的多效性细胞因子,参与调节机体的炎症反应、先天和获得性免疫应答、细胞凋亡和坏死等生理及病理过程[1-3]。由肿瘤坏死因子α (TNF-α) 诱导产生的肿瘤坏死因子α诱导蛋白 (Tumor necrosis factor-alpha induced protein,TNFAIP) 是TNFAIP1 - TNFAIP9等,有物质运输、细胞凋亡、细胞分化、炎症应答、信号转导等调节功能[4]。TNFAIP2亦称B94或EXOC3L3,在内皮细胞中由TNF-α诱导[5],其基因主要表达于哺乳动物内皮细胞[6]、外周血单核细胞和成熟精子[7],有激活Toll样受体(TLR) 家族基因的特性[8],也是一种蛋白酶激活受体(Protease activated receptors, PARS) 依赖蛋白,是激活PARS下游炎症因子之一[9]。TNFAIP2通过核因子-κB (Nuclear factor kappa-B, NF-κB)、丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK) 信号通路[10]调控感染细菌后的炎症反应,可缓解细菌在宿主内复制[11]。在脂多糖(Lipopolysaccharide, LPS) 刺激下,人体TNFAIP2可协同TNF-α、白介素1β (IL-1β) 和干扰素α2(IFN-α2) 等促炎性细胞因子抵抗病原入侵[11-12]。在硬骨鱼中,仅见草鱼()相关研究[10,13-15],可作为miR-142a-3p的直接靶基因调控细胞活力,促进细胞凋亡以及介导炎症反应,未见其他硬骨鱼类感染病原后TNFAIP2参与免疫调控的研究。
大口黑鲈() 又名加州鲈,是我国重要养殖鱼种[16],目前面临鱼诺卡氏菌() 的严重威胁[17]。本研究克隆大口黑鲈,分析该基因在大口黑鲈中的组织表达以及脂多糖(Lipopolysaccharide, LPS) 与鱼诺卡氏菌 (,N.S) 感染后、、、与的mRNA表达,为探讨对大口黑鲈的免疫调控提供基础。
1 材料与方法
1.1 实验材料
大口黑鲈幼鱼[(22 ± 5) g]、成鱼[(500 ± 50) g]分别购自广东省罗非鱼良种场与广州市五山菜市场,分别于30 cm×40 cm×40 cm玻璃缸、容积为160 L圆桶中暂养1周,溶氧>5.0 mg/L,水温(26 ± 2)℃,每天8:00、18:00按鱼体质量2%~3%投喂商品料(福建天马科技集团股份有限公司),每天换水50%。高保真扩增酶(MCLAB, I5HM-200)和pClone007 Versatile Simple Vector Kit购自北京擎科生物技术有限公司,RNA提取试剂盒(R6934-02)购自OMEGA公司,反转录试剂(R323-01) 和实时荧光定量PCR (Quantitative real-time PCR, qRT-PCR) 试剂(Q712-02)购自南京诺唯赞生物科技股份技术有限公司,鱼组织淋巴细胞分离试剂盒(LTS1080FZ) 购自天津灏洋生物制品科技有限责任公司,70μm细胞筛网(15-1070)购自巴罗克集团有限公司,LPS (BS007) 购自biosharp公司,鱼诺卡氏菌与大肠杆菌(DH5α感受态细胞由本实验分离制备、保存。
1.2 鰤鱼诺卡氏菌的制备
鱼诺卡氏菌培养基配方:葡萄糖2 g,酵母粉1.5 g,磷酸氢二钾0.075 g,氯化钙0.02 g (单独灭菌),氯化钠0.5 g,加去离子水100 mL,调pH至6.5 ± 0.2,121 ℃高压灭菌20 min。按照体积比1∶100向新鲜培养基中加入鱼诺卡氏菌菌种,于30 ℃恒温振荡培养箱200 r/min培养4 d左右。
1.3 组织样品采集与保存
取健康大口黑鲈幼鱼3尾,实验前24 h停喂,用丁香酚麻醉,剖取脾、头肾、皮肤、鳃、肝脏、肌肉、脑、肠于无菌无酶的冻存管,立即放入液氮,转至-80℃冰箱保存,以检测组织分布。
大口黑鲈幼鱼随机分为3组,每组40尾,分别腹腔注射磷酸盐缓冲液(PBS,pH 7.2)、50 ng/μL LPS、1 × 108CFU/mL 鱼诺卡氏菌各100 μL,在注射0、3、6、12、24、48、72 h时取脾和头肾,每组每次取3尾,所有样品均置无菌无酶冻存管,置液氮中速冻,于-80 ℃冰箱保存,以检测基因表达量。
1.4 细胞样品的采集与保存
在无菌条件下分别取大口黑鲈成鱼3尾,剖取头肾,剪碎,研磨,组织匀浆液过70 μm细胞筛网,离心,清洗,样品稀释液重悬后小心地沿管壁加在细胞分离液液面,于20 ℃、450条件下离心20 min,小心吸取中间的白环层,用清洗液清洗2次,以RPMI-1640 (含100 mL/L胎牛血清,1 000 U/mL青霉素和链霉素) 重悬细胞。吉姆萨、台盼蓝染色鉴定(图1),计数,将每尾分离到的淋巴细胞分成24组,每组3个生物学重复,铺于96孔板中(5×105个/孔),于25℃培养箱静置培养12 h。分别用LPS (50 ng/μL)、鱼诺卡氏菌(1×108CFU/mL)和PBS刺激。分别于刺激后0、3、6、12、24、36、48、72 h收集细胞,于液氮中速冻,-80 ℃下保存,以鱼组织淋巴细胞分离试剂盒分析细胞基因表达量。
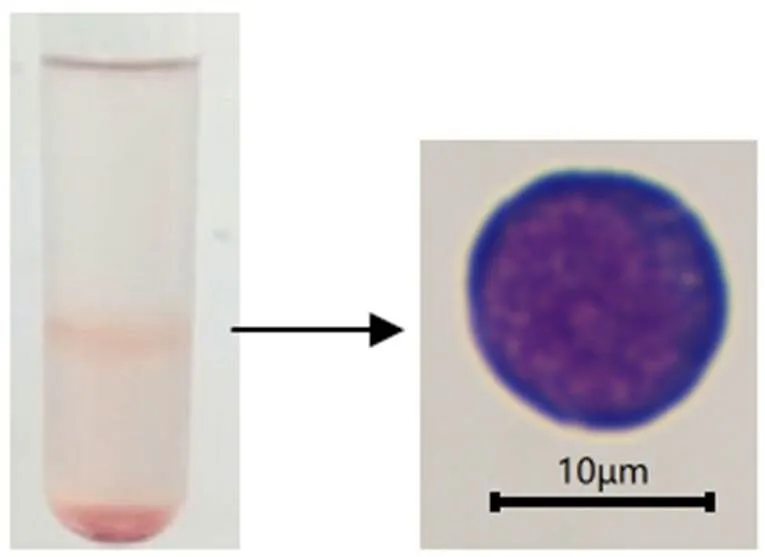
图1 大口黑鲈头肾淋巴细胞
1.5 引物及序列验证
根据大口黑鲈脾脏转录组数据库(登录号:PRJNA806622)编码序列(Coding sequence, CDS),用Primer Premier 5.0设计引物(表1)。以大口黑鲈脾脏组织cDNA为模板,扩增得目的片段,胶回收,与pClone007 Versatile Simple Vector Kit载体连接,转化入DH5α感受态细胞,涂布于LB (含100 μg/mL氨苄霉素) 固体平板,于37 ℃下倒置培养12 ~ 18 h,挑取10个单克隆菌株,于液体LB(含100 μg/mL氨苄霉素)培养基,以37℃、200r/min条件扩大培养4 h,挑选阳性克隆送公司测序。引物合成和序列测序均由生工生物工程(上海)股份有限公司完成。
1.6 MsTNFAIP2 CDS序列分析
用clustalX软件进行序列比对,DNAMAN软件进行序列分析及同源比对,用TMHMM (https://servi ces.healthtech.dtu.dk/service.php?TMHMM-2.0) 分析有无跨膜结构,用ExPASy的ProtParam(https://web. expasy.org/protparam/)分析理化性质,用MEGA X邻接法 (bootstrap = 1 000) 构建系统发育进化树,用SMART (http://smart.embl-heidel berg.de/) 分析基因结构域,用SignalP (http://www.cbs.dtu.dk/ services/Si gnalP/)分析有无信号肽,用SOPMA (https://npsa-pra bi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 预测蛋白质二级结构,用SWISS-MODEL (https:// swissmodel.expasy.org/) 预测蛋白三级结构。
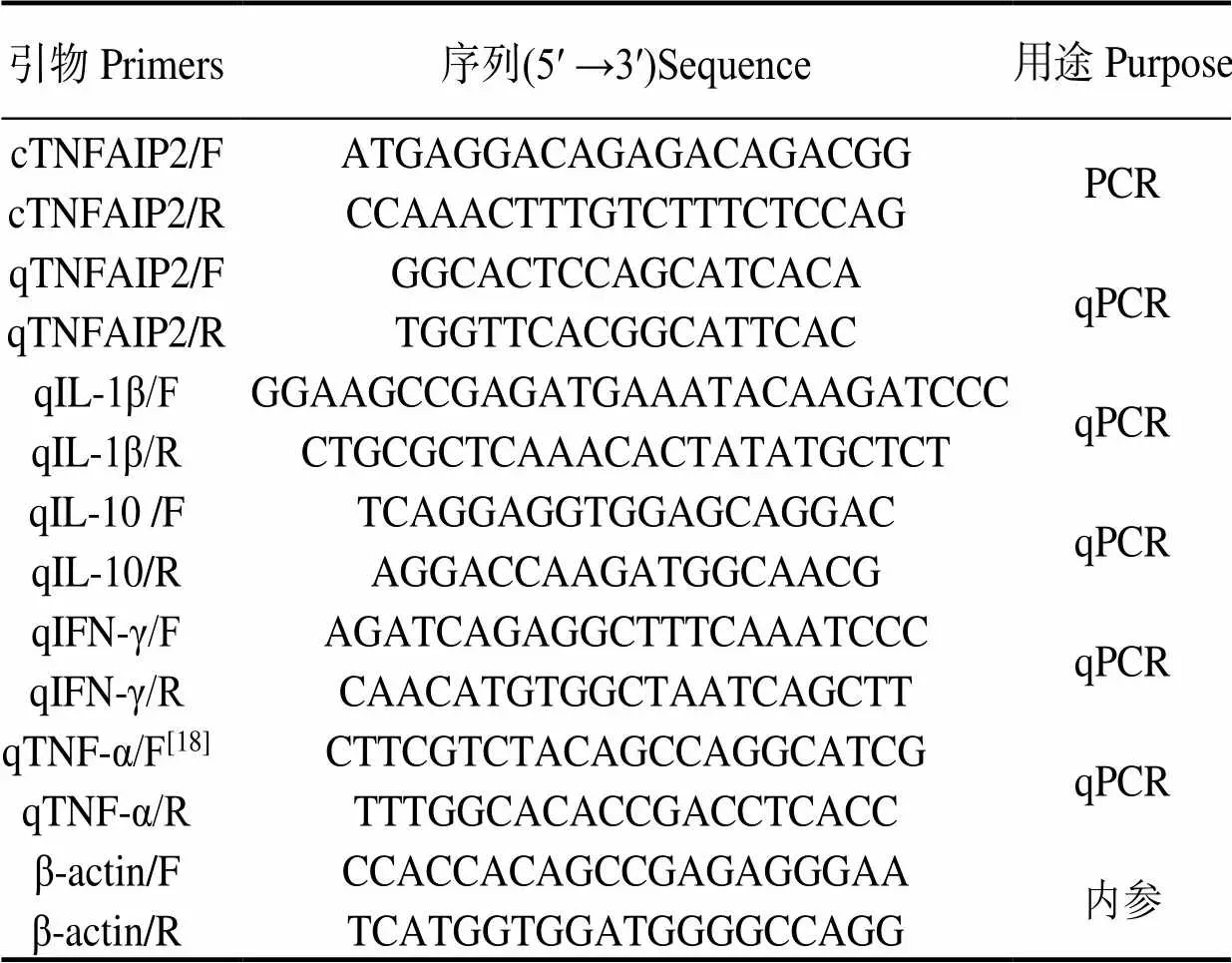
表1 引物序列
1.7 RNA提取和cDNA合成
所有组织样品总RNA均按照RNA提取试剂盒(OMEGA) 说明书提取,使用NanoDROP LITE Spectrophotometer (Thermo Fisher Scientific)测定RNA浓度,用琼脂糖凝胶电泳检测RNA质量,将合格的RNA样品参照反转录试剂盒说明书进行逆转录成cDNA,置于-20 ℃保存待用。
1.8 qRT-PCR检测与数据分析
用诺唯赞SYBR qPCR酶进行qRT-PCR,所用引物见表1。反应体系:2×Taq Pro Universal SYBR qPCR Master Mix 10 μL,上下游引物(10 μmol/L) 各0.4 μL,模板1 μL,加ddH2O至20 μL。反应程序:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环。溶解曲线采集以仪器默认为准。以[19]为内参,所有样品均设置3个重复孔,用2-△△CT方法计算相对表达量[20],用SPSS 23.0中单因素方差分析进行显著性分析,<0.05和<0.01分别代表差异显著和差异极显著,用Graphpad prism 8作图。
2 结果与分析
2.1 MsTNFAIP2克隆结果和序列分析
全长2 357 bp,克隆的CDS区域长度为1 932 bp,共编码644个氨基酸(图2),理论分子质量约73.9 ku,等电点为5.58,说明该蛋白为酸性蛋白,其中含量最多的是亮氨酸(12.7%),谷氨酸(9.6%) 和赖氨酸(7.8%) 次之,含量最少的是半胱氨酸(1.1%) (表2),带负电荷的残基总数为100,带正电荷的残基总数为84,不稳定指数为48.18,为不稳定蛋白,该蛋白N端为蛋氨酸(甲硫氨酸),其在哺乳动物体外网状细胞系中的半衰期为30 h,脂肪系数和总体亲水性分别为89.75和-0.544,表明该蛋白为亲水性蛋白(图3)。

加粗ATG代表起始密码子,加粗TGA代表终止密码子,下划线区域代表卷曲螺旋,阴影区域代表低复杂程度区
Bold ATG and TGA indicate translation initiation and termination codon; Underlined and shadow region represent coiled coil and low complexity area, respectively
图2 大口黑鲈TNFAIP2及其推导的氨基酸序列
Fig.2 MsTNFAIP2and its deduced amino acid sequence
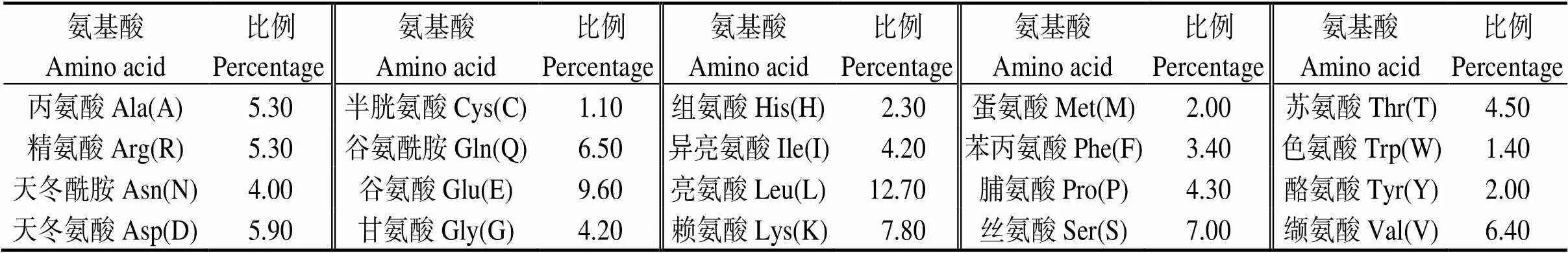
表2 MsTNFAIP2氨基酸数量组成
SignalP分析显示,该蛋白无信号肽;TMHMM分析显示,该蛋白质无跨膜结构;SMART分析显示,该蛋白存在一个卷曲螺旋(第92~120位氨基酸)、一个低复杂程度区(第288~304位氨基酸) (图2)、一个Sec6超家族结构域(第103~636位氨基酸) (图4)。
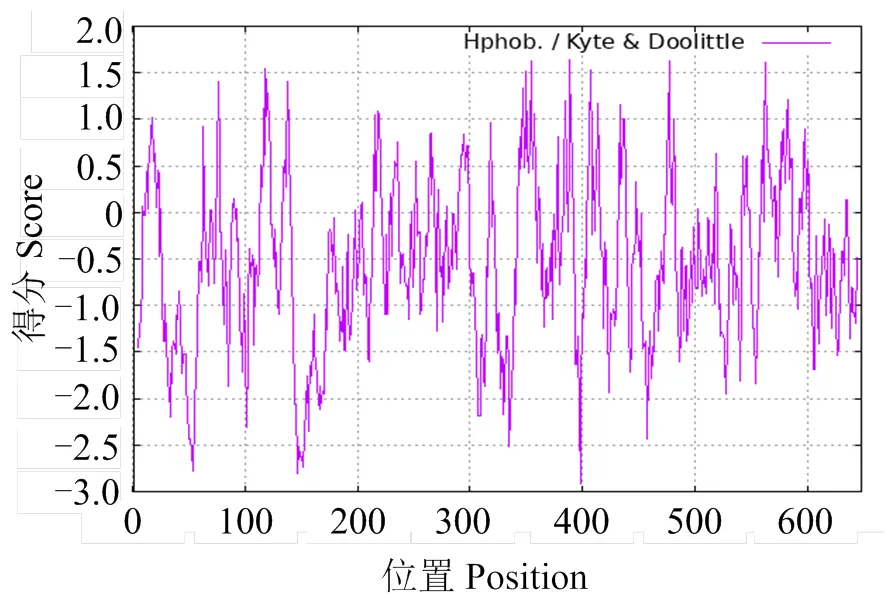
图3 MsTNFAIP2蛋白质亲/疏水性分析
2.2 同源性比对及系统进化树分析
MsTNFAIP2氨基酸序列同鲈形目鱼类TNFAIP2同源较高(图5),为69.17%,与鳜 () TNFAIP2 (XP_044022203.1) 同源性最高,达74.84%,与鞍带石斑鱼(,XP_033497952.1)、尖吻鲈 (,XP_018559497.1)、奥利亚罗非鱼(,XP_039459252.1)、花斑鳃棘鲈(,XP_042357203.1)、黄鳍棘鲷 (,XP_036928404.1)、大黄鱼(,TMS20990.1)的同源性分别为69.89%、67.11%、66.96%、66.88%、64.81%、63.07%。
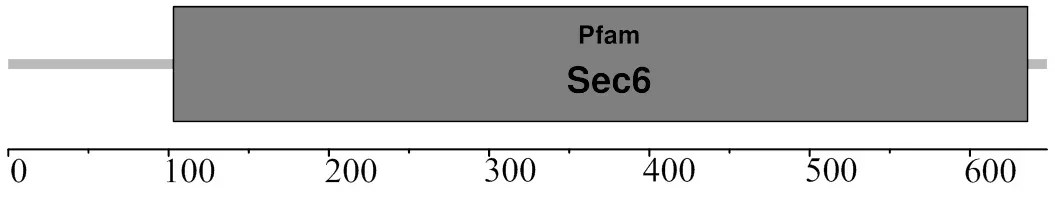
图4 MsTNFAIP2 结构域分析
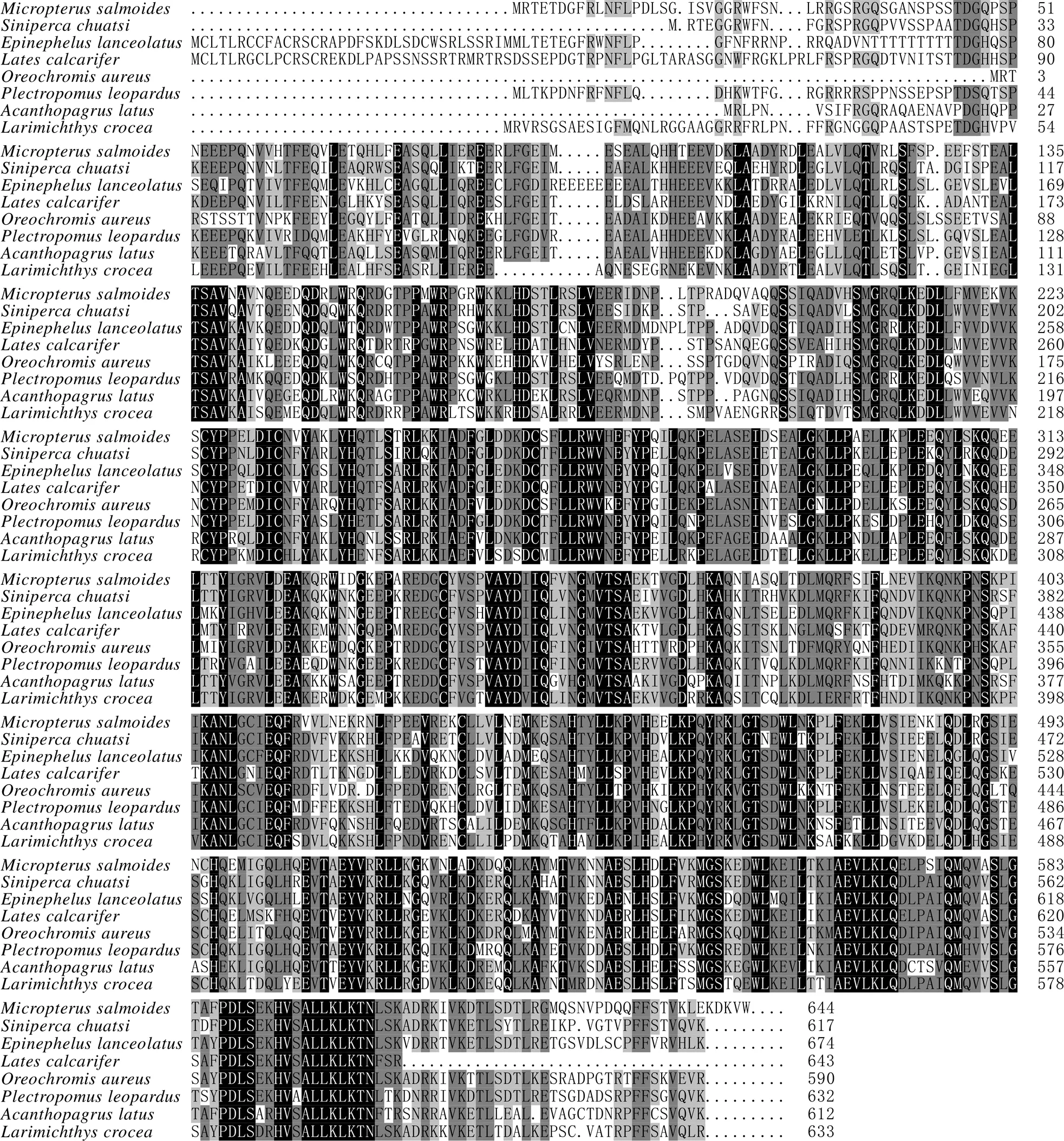
黑色,深、浅灰色,白色部分相似性分别为100%、75%、50%、33%
进化树结果(图6) 显示,大口黑鲈与鳜在同一小分支中,且所有鱼类聚为同一大分支,与哺乳动物和两栖动物分开,证明鱼类之间亲缘关系最近,与哺乳动物关系最远,表明MsTNFAIP2在鱼类当中稳定遗传且比较保守,符合物种进化理论。
2.3 MsTNFAIP2二级和三级结构预测
预测结果表明,大口黑鲈TNFAIP2蛋白二级结构中α-螺旋比例最高,为69.72%,无规则卷曲为27.02%,延伸链为1.55%,β-转角为1.71% (图7);该蛋白三级结构(图8) 由α-螺旋配合多个β-转角卷曲盘旋形成,与二级结构预测结果吻合。
2.4 MsTNFAIP2组织分布
组织表达结果表明(图9),在所有组织中均有表达,相对于肠道组织,脾脏表达量最高,其次是头肾、皮肤、鳃、肝脏、肌肉、脑。
图6 基于邻接法的TNFAIP2氨基酸系统进化树

h, α-螺旋; c, 无规则卷曲; e, 延伸链; t, β-转角
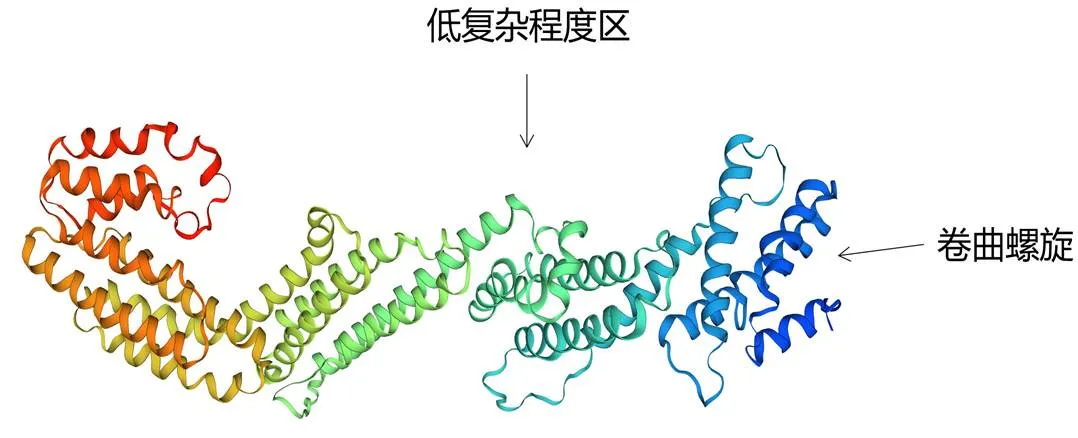
图8 MsTNFAIP2蛋白三级结构预测结果
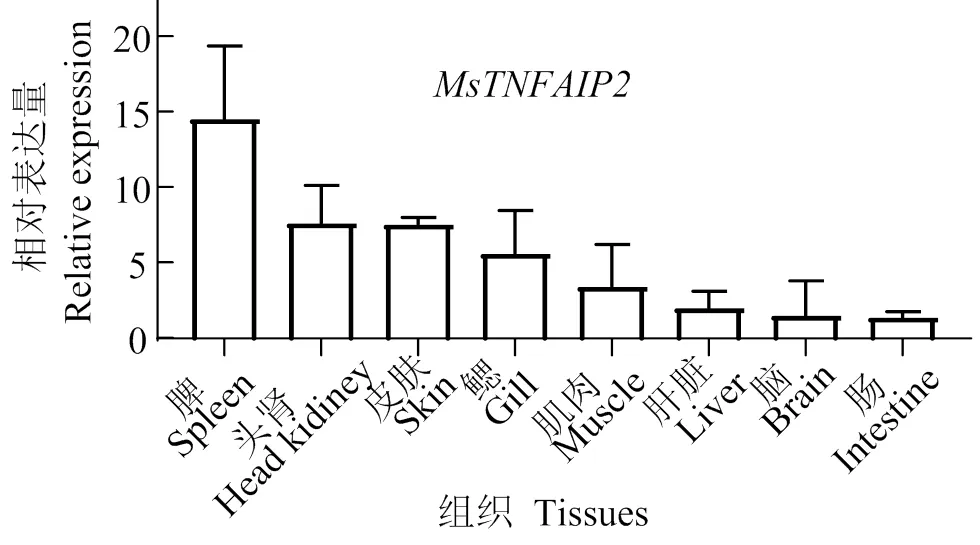
图9 大口黑鲈MsTNFAIP2的组织表达
2.5 刺激后脾脏和头肾中MsTNFAIP2、TNF-α、IL-1β、IL-10和IFN-γ的表达
头肾和脾脏中及其相关的免疫基因、、和在LPS和鱼诺卡氏菌刺激后均上调表达(图10)。LPS刺激后,在脾脏中,、和均在48 h表达量平均值最大,分别为各自同时段PBS组的31.96、45.28、124.79、122.66倍(< 0.01),表达量平均值在6 h最大,为6 h PBS组的32.33倍(< 0.01) ;在头肾组织中,和在24 h表达量平均值最大,与同时段PBS组相比分别上调14.84、16.01、49.15倍(< 0.01),和表达量平均值分别在3 h和12 h最大,分别为同时段PBS的466.57、221.36倍(< 0.01)。鱼诺卡氏菌刺激后,在脾脏中,和表达量平均值均在24 h最大,分别为同时段PBS组的50.40、10.10、21.49倍(< 0.01),则分别在48 h 和72 h表达量平均值最大,分别为同时段PBS组的17.33、63.98倍(< 0.01);在头肾中,和在24 h表达量平均值最大,分别为同时段PBS组18.26和61.00倍(< 0.01),在刺激6 h时,和表达量平均值最大,分别为6 h PBS组的618.86、67.86倍(< 0.01),在12 h表达量平均值最大,为同时段PBS组的16.48倍(< 0.01)。
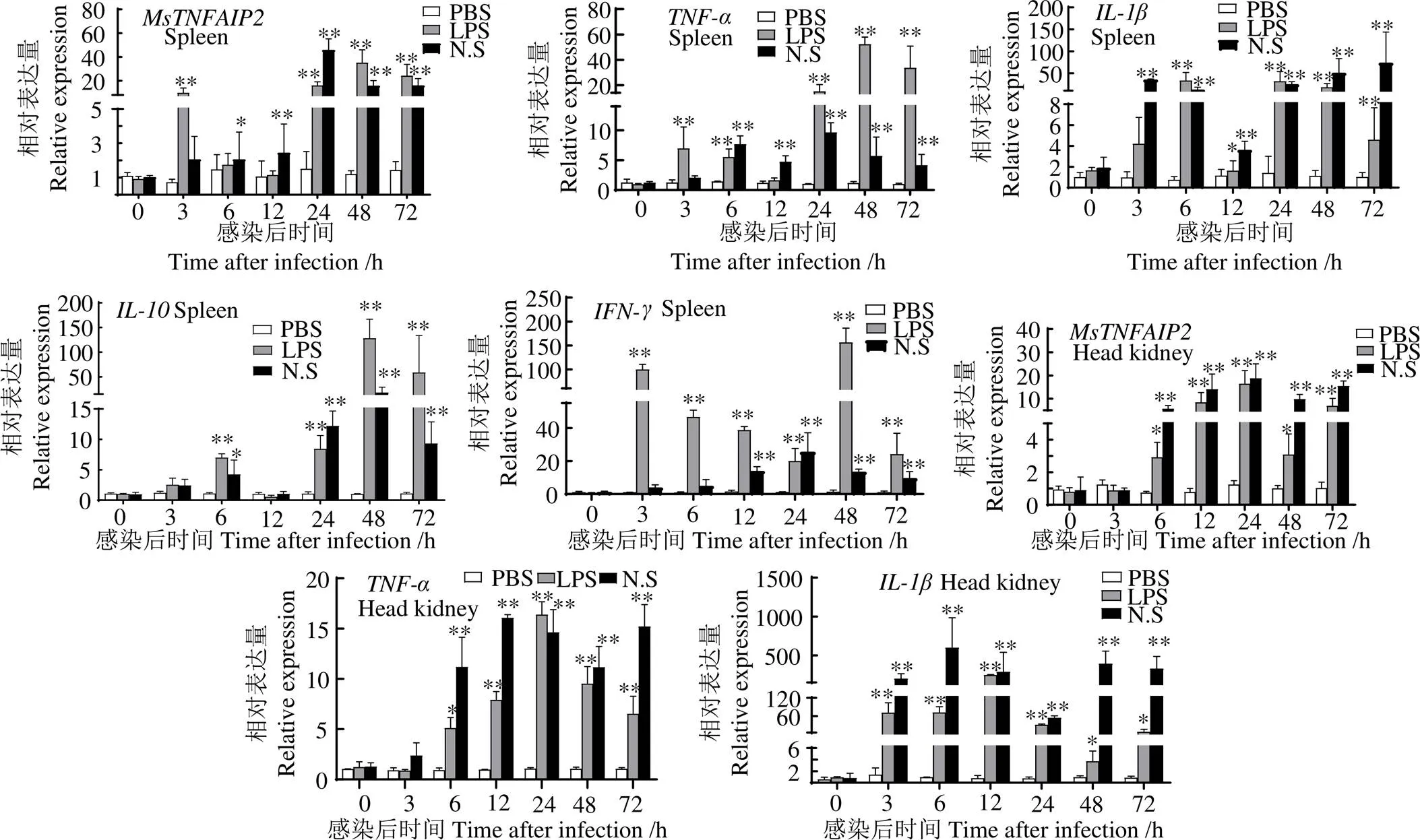
*,与同时段PBS组相比,差异显著(< 0.05);**,与同时段PBS组相比,差异极显著(< 0.01)
*, significant difference compared with time-matched PBS at level of< 0.05; **, significant difference compared with time-matched PBS at level of< 0.01
图10 PBS、LPS和鱼诺卡氏菌刺激后脾和头肾中、、、和的表达变化
Fig. 10,,,andexpression in spleen and head kidney ofafter injecting PBS, LPS and
2.6 刺激后头肾淋巴细胞中MsTNFAIP2、TNF-α、IL-1β、IL-10和IFN-γ的表达
图11显示,鱼诺卡氏菌刺激淋巴细胞后和表达量平均值均在6 h最大,分别为6 h PBS组的9.7、8.82、7.56倍(0.01),表达量平均值在3 h时最大,为3 h PBS组的4.33倍(0.01),在72 h时表达量平均值最大,为72 h PBS组的39.17倍(0.01)。在LPS刺激后,表达量平均值在6 h最大,为6 h PBS组的3.39倍(0.01),均在72 h表达量平均值最大,分别为72 h PBS组的3.79、7.10、95.87、14.14倍(0.01)。
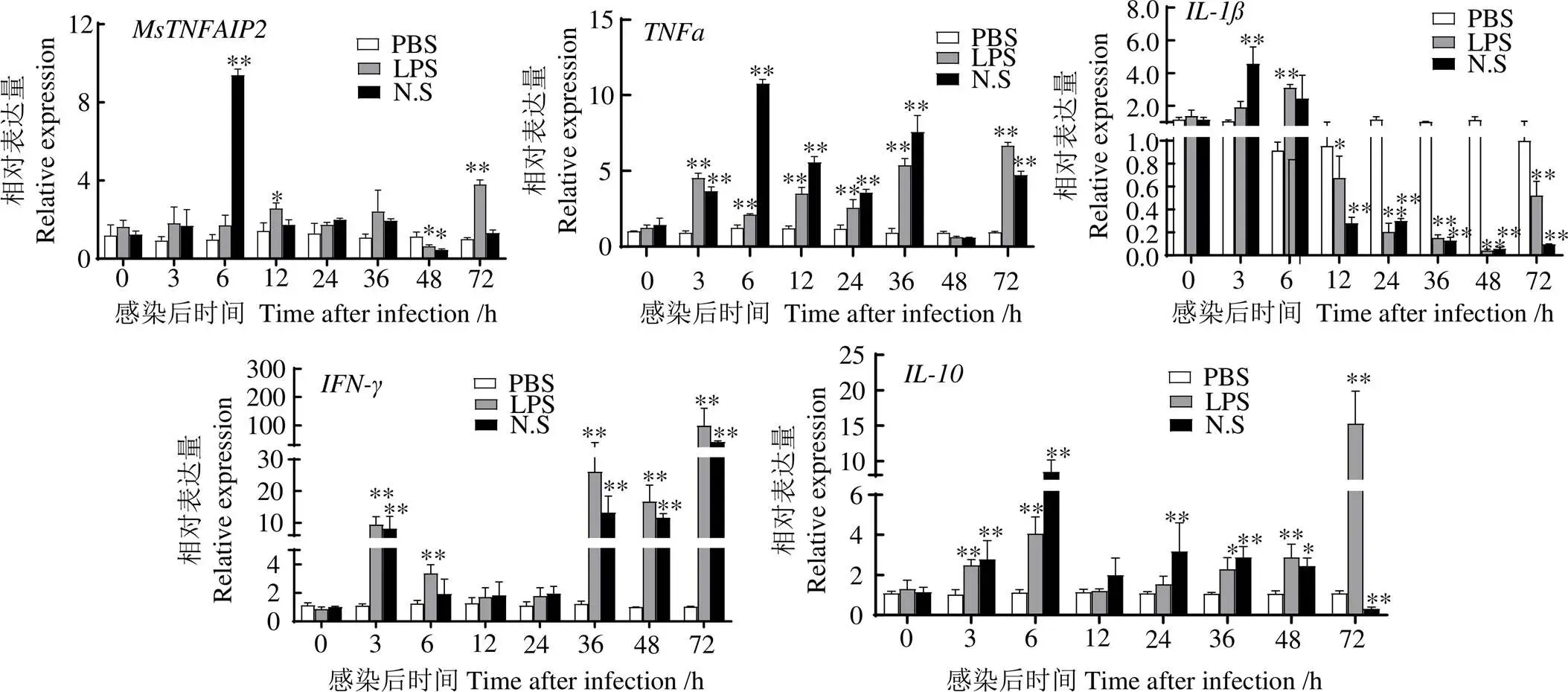
*,与同时段PBS组相比,差异显著(P < 0.05);**,与同时段PBS组相比,差异极显著(P < 0.01)
3 讨论
在细胞凋亡分化及炎症反应中起重要调节作用[21],主要分布在细胞质膜外侧,可与EXOC1、EXOC2、EXOC4、EXOC7和EXOC8等25种蛋白发生交互作用[22]。但硬骨鱼TNFAIP2研究仍处于起始阶段。本研究从大口黑鲈脾脏转录组数据中得到CDS全长序列。MsTNFAIP2与鳜TNFAIP2氨基酸序列同源性最高,在系统进化树中与鳜TNFAIP2聚为一支,与同源比对结果一致,与所有鱼类均聚为同一大分支,表明TNFAIP2蛋白在鱼类遗传中较为保守。MsTNFAIP2在结构上同哺乳动物一样,编码一个Sec6结构域,属于Sec6超家族成员,与草鱼TNFAIP2结构一致[13]。
目前未见在硬骨鱼中表达水平的相关研究本研究表明,在大口黑鲈头肾、脾脏、鳃、肌肉、肠道、皮肤、肝脏和脑中均有表达,在脾脏中表达量最高,属于组成型表达[23]。腹腔注射LPS和鱼诺卡氏菌后,表达量在脾脏和头肾中均显著上调,但不同组织上调水平以及达到峰值时间点均不同,因此,在感染机体中又呈诱导型表达。
、和是典型的免疫反应相关的急性炎性细胞因子[24-26]也是一种炎症相关因子[21]。本研究表明,在LPS和鱼诺卡氏菌刺激下的表达量变化与较为相似,表明受的调控[5],证实MsTNFAIP2是由TNF-a诱导产生[6],还有研究表明TNFAIP2也可被[27][28]和LPS[6]等其他细胞因子诱导分泌。此外,本研究中、、和的表达趋势与已报道的相关研究一致[29-32]。在感染早期(3 h),脾脏作为硬骨鱼免疫器官的主要靶器官,其免疫相关细胞因子在应激反应下共同发挥免疫应答,导致mRNA表达显著上调。因此,本研究克隆的基因能协同其他细胞因子参与免疫调节,在感染前后表达量变化可作为细菌感染的一个免疫评价指标。
头肾是鱼类最重要的免疫器官之一,含有淋巴细胞和吞噬细胞[33]等多种免疫细胞,是硬骨鱼细胞因子合成和分泌的主要场所之一[34-35]。本研究表明,大口黑鲈分别用LPS和鱼诺卡氏菌刺激3 h后,头肾淋巴细胞中表达都表现出上调趋势,但鱼诺卡氏菌刺激后,仅在感染初期(6 h) 极显著上调,随后降至正常水平,表明大口黑鲈同哺乳动物一样可参与急性炎症反应[36];随着感染时间增加(36 ~ 48 h),淋巴细胞中上调的同时伴随着、和的下调,表明抗炎症因子对炎症因子和有一定抑制作用;感染后期(36 ~ 72 h),促炎因子一直处于极显著上调表达的状态,与军曹鱼()在感染美人鱼发光杆菌杀鱼亚种 (subsp.) 后变化趋势相似[30]。文献[30]认为是美人鱼发光杆菌杀鱼亚种诱导感染后引发的一种免疫逃避机制,本研究和促炎因子在感染后期同时上升可能是鱼诺卡氏菌诱导IL-10,而作为一种免疫逃逸方式。
综上,本研究首次克隆CDS序列,在健康大口黑鲈不同组织中均有表达,脾脏表达量最高;在腹腔注射LPS和鱼诺卡氏菌后,脾脏和头肾中、、和mRNA表达显著上调;大口黑鲈头肾中分离的淋巴细胞在与LPS、鱼诺卡氏菌共同孵育后,均能导致、、和显著上调。这些结果揭示,鱼诺卡氏菌感染诱导了大口黑鲈的炎症反应,其中、、、和均参与这一过程。该研究结果为进一步揭示TNFAIP2在鱼类免疫应答机制中的作用奠定基础。
[1] AGGARWAL B B. Signalling pathways of the TNF superfamily: a double-edged sword[J]. Nature Reviews Immunology, 2003, 3(9): 745-756.
[2] CABAL-HIERRO L, LAZO P S. Signal transduction by tumor necrosis factor receptors[J]. Cellular Signalling, 2012, 24(6): 1297-1305.
[3] DUBRAVEC D B, SPRIGGS D R, MANNICK J A, et al. Circulating human peripheral blood granulocytes synthesize and secrete tumor necrosis factor alpha[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(17): 6758-6761.
[4] 李涛, 李敏, 姬新颖, 等. 肿瘤坏死因子α诱导蛋白家族与疾病的关系[J]. 细胞与分子免疫学杂志, 2014, 30(4): 433-436.
[5] CHEN L C, CHEN C C, LIANG Y, et al. A novel role for TNFAIP2: its correlation with invasion and metastasis in nasopharyngeal carcinoma[J]. Modern Pathology, 2011, 24(2): 175-184.
[6] SARMA V, WOLF F W, MARKS R M, et al. Cloning of a novel tumor necrosis factor-alpha-inducible primary response gene that is differentially expressed in development and capillary tube-like formation[J]. Journal of Immunology (Baltimore, Md: 1950), 1992, 148(10): 3302-3312.
[7] WOLF F W, SARMA V, SELDIN M, et al. B94, a primary response gene inducible by tumor necrosis factor-alpha, is expressed in developing hematopoietic tissues and the sperm acrosome[J]. Journal of Biological Chemistry, 1994, 269(5): 3633-3640.
[8] CHEVRIER N, MERTINS P, ARTYOMOV M N, et al. Systematic discovery of TLR signaling components delineates viral-sensing circuits[J]. Cell, 2011, 147(4): 853-867.
[9] SABAN R, D'ANDREA M R, ANDRADE-GORDON P, et al. Regulatory network of inflammation downstream of proteinase-activated receptors[J]. BMC Physiology, 2007, 7: 3.
[10] LI L Y, JIA X W, LIU Y, et al. lncRNA-SUMO3 and lncRNA-HDMO13 modulate the inflammatory response by binding miR-21 and miR-142a-3p in grass carp[J]. Developmental & Comparative Immunology, 2021, 121: 104082.
[11] DU BOIS I, MARSICO A, BERTRAMS W, et al. Genome-wide chromatin profiling of-infected human macrophages reveals activation of the probacterial host factor TNFAIP2[J]. The Journal of Infectious Diseases, 2016, 214(3): 454-463.
[12] MOOKHERJEE N, BROWN K L, BOWDISH D M E, et al. Modulation of the TLR-mediated inflammatory response by the endogenous human host defense peptide LL-37[J]. Journal of Immunology (Baltimore, Md: 1950), 2006, 176(4): 2455-2464.
[13] 白玉麟,徐晓雁,沈玉帮,等. 草鱼肿瘤坏死因子α诱导蛋白2的克隆与表达分析[C] // 2018年中国水产学会学术年会论文摘要集. 出版地不详: 出版者不详, 2018: 156. https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CPFD&dbname=CPFDLAST2019&filename=OGSB201811001141
[14] TAO L Z, PANG Y F, WANG A Q, et al. Functional miR-142a-3p induces apoptosis and macrophage polarization by targeting tnfaip2 and glut3 in grass carp ()[J]. Frontiers in Immunology, 2021, 12: 633324.
[15] 陶丽竹. 草鱼miR-21及miR-142a-3p在细菌感染过程中对炎症因子调控的研究[D]. 上海: 上海海洋大学, 2020.
[16] CHEN Y J, LIU Y J, TIAN L X, et al. Effect of dietary vitamin E and selenium supplementation on growth, body composition, and antioxidant defense mechanism in juvenile largemouth bass () fed oxidized fish oil[J]. Fish Physiology and Biochemistry, 2013, 39(3): 593-604.
[17] HO P Y, CHEN Y C, MAEKAWA S, et al. Efficacy of recombinant protein vaccines for protection againstinfection in the largemouth bass[J]. Fish & Shellfish Immunology, 2018, 78: 35-41.
[18] ZHAO L L, LIANG J, CHEN F K, et al. High carbohydrate diet induced endoplasmicstress and oxidative stress, promoted inflammation and apoptosis, impaired intestinal barrier of juvenile largemouth bass ()[J]. Fish & Shellfish Immunology, 2021, 119: 308-317.
[19] BYADGI O, CHEN C W, WANG P C, et al. De novo transcriptome analysis of differential functional gene expression in largemouth bass () after challenge with[J]. International Journal of Molecular Sciences, 2016, 17(8): 1315.
[20] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[21] JIA L, SHI Y D, WEN Y, et al. The roles of TNFAIP2in cancers and infectious diseases[J]. Journal of Cellular and Molecular Medicine, 2018, 22(11): 5188-5195.
[22] XU Y, MA H X, YU H P, et al. The miR-184 binding-site rs8126 T>C polymorphism in TNFAIP2is associated with risk of gastric cancer[J]. PLoS One, 2013, 8(5): e64973.
[23] 田佳音, 陈康勇, 张畅, 等. 斑马鱼肿瘤坏死因子(tnfα)及其受体(tnfrsf1a)应答细菌和病毒感染的表达[J]. 上海海洋大学学报, 2020, 29(2): 171-179.
[24] WATERS J P, POBER J S, BRADLEY J R. Tumour necrosis factor and cancer[J]. The Journal of Pathology, 2013, 230(3): 241-248.
[25] SACCHINI F, LUCIANI M, SALINI R, et al. Plasma levels of TNF-α, IFN-γ, IL-4 and IL-10 during a course of experimental contagious bovine pleuropneumonia[J]. BMC Veterinary Research, 2012, 8: 44.
[26] FAWZY EL-SAYED K M, NGUYEN N, DÖRFER C E. Ascorbic acid, inflammatory cytokines (IL-1/TNF-/IFN-), or their combination's effect on stemness, proliferation, and differentiation of gingival mesenchymal stem/progenitor cells[J]. Stem Cells International, 2020, 2020: 8897138.
[27] MCDERMOTT B T, PEFFERS M J, MCDONAGH B, et al. Translational regulation contributes to the secretory response of chondrocytic cells following exposure to interleukin-1β[J]. The Journal of Biological Chemistry, 2019, 294(35): 13027-13039.
[28] HASE K, KIMURA S, TAKATSU H, et al. M-Sec promotes membrane nanotube formation by interacting with Ral and the exocyst complex[J]. Nature Cell Biology, 2009, 11(12): 1427-1432.
[29] GRAYFER L, WALSH J G, BELOSEVIC M. Characterization and functional analysis of goldfish (L.) tumor necrosis factor-alpha[J]. Developmental & Comparative Immunology, 2008, 32(5): 532-543.
[30] TRAN H B, CHEN S C, CHAUNG H C, et al. Molecular cloning of IL-6, IL-10, IL-11, IFN-ɤ and modulation of pro- and anti-inflammatory cytokines in cobia () aftersubsp.infection[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2019, 230: 10-18.
[31] ZHOU Y J, PING O Y, TAO Y, et al. Comparison the function of Cyprinid herpesvirus 3 encoded two viral tumor necrosis factor receptors[J]. Aquaculture Reports, 2021, 21: 100878.
[32] ZHANG F, QIU X M, LIU Y, et al. Expression analysis of three immune genes interferon-gamma, Mx and interferon regulatory factor-1 of Japanese flounder ()[J]. Brazilian Archives of Biology and Technology, 2017, 60.DOI:10.1590/1678-4324-2017160243.
[33] HAO L X, SUN L. Comparative analysis of the expression patterns of eight suppressors of cytokine signaling in tongue sole,[J]. Fish & Shellfish Immunology, 2016, 55: 595-601.
[34] STAFFORD J L, MCLAUCHLAN P E, SECOMBES C J, et al. Generation of primary monocyte-like cultures from rainbow trout head kidney leukocytes[J]. Developmental and Comparative Immunology, 2001, 25(5/6): 447-459.
[35] HONG S, LI R G, XU Q Q, et al. Two types of TNF-α exist in teleost fish: phylogeny, expression, and bioactivity analysis of type-II TNF-α3 in rainbow trout[J]. Journal of Immunology (Baltimore, Md: 1950), 2013, 191(12): 5959-5972.
[36] LI C, ZUO W W. IL-10could enhance IFNγ expression and suppress PD-1 expression in CD8 T cells from esophageal cancer patients[J]. Experimental Cell Research, 2019, 379(2): 159-165.
Molecular Cloning of Tumor Necrosis Factor-alpha Induced Protein 2 Gene and Expression Analysis of Immune-related Genes Associated with It in Largemouth Bass ()
NIE Yi-fan1,2, WU Jing2,4, MA Yan-ping2, HAO Le2, FENG Guo-qing2, LIU Zhen-xing2, CAO Jun-ming1,3
(1.,,510225,; 2.,,,510640,; 3.,524088,; 4.,,510642,)
【】To clone tumor necrosis factor-alpha induced protein 2 (TNFAIP2) gene of, named, and explore the role ofin the immune response of.【】Primer Premier 5 software was used to design the primers according to the sequence ofCDS from largemouth bass transcriptome. The physicochemical properties and structure of MsTNFAIP2 amino acid sequences were analyzed by DNAMAN and SMART online prediction websites. Expression of,,andmRNA were determined by Quantitative real-time PCR (qRT-PCR) afterinfection and LPS stimulation.【】The CDS of, was successfully cloned and the length ofCDS was 1932 bp, encoding 644 amino acids with a Sec6 superfamily domain. MsTNFAIP2 shares an identity of 74.84 % with the TNFAIP2 of.andwere significantly up-regulated in the head kidney, spleen and lymphocytes afterinfection and LPS stimulation. 【】involves in the immune response of largemouth bass.
; tumor necrosis factor-alpha induced protein 2; gene cloning;gene expression; lipopolysaccharide;
聂一帆,吴静,马艳平,等. 大口黑鲈肿瘤坏死因子-α诱导蛋白2基因克隆及免疫相关基因表达[J]. 广东海洋大学学报, 2022, 42(3): 1-10.
Q78;Q959.483
A
1673-9159(2022)03-0001-10
10.3969/j.issn.1673-9159.2022.03.001
2021-12-14
广东省自然科学基金(2022A1515012556, 2021A1515010498);佛山市财政专项资金-2020年度共建广东农业科技示范市项目;广东省农业科学院动物卫生研究所创新基金(CX202113);广东省农业科学院水产协同创新中心项目(XT202232)
聂一帆(1996―),男,硕士研究生,研究方向为水生动物病害。E-mail:yifann66@gmail.com
曹俊明(1962―),男,博士,教授,研究方向为水生动物营养免疫学。E-mail:junmcao@163.com
刘振兴(1981—),男,博士,副研究员,研究方向为水生动物病害防控。E-mail:liuzhenxing@gdaas.cn
(责任编辑:刘庆颖)
