不同褐藻来源岩藻多糖理化性质及其免疫调节作用
2022-05-20太敏瑞蔡泓滢贾学静刘晓菲吉宏武钟赛意
太敏瑞,蔡泓滢,李 瑞,2,贾学静,刘晓菲,吉宏武,2,钟赛意,2
不同褐藻来源岩藻多糖理化性质及其免疫调节作用
太敏瑞1,蔡泓滢1,李 瑞1,2,贾学静1,刘晓菲1,吉宏武1,2,钟赛意1,2
(1. 广东海洋大学食品科技学院 // 广东省海洋生物制品工程实验室 // 广东省海洋食品工程技术研究中心 // 广东省水产品加工与安全重点实验室 // 广东省亚热带果蔬加工科技创新中心,广东 湛江 524008;2. 海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁 大连 116034)
【】探讨不同褐藻来源岩藻多糖(Fucoidan,Fuc)理化性质的差异及其对免疫调节活性的影响。以3种不同褐藻来源(裙带菜、墨角藻、海带)的5个Fuc样品为原料,采用高效凝胶色谱、傅里叶红外光谱仪(FTIR)、扫描电子显微镜(SEM)、纳米粒度电位仪和同步热分析仪(TG-DSC)等测定分子质量、微观形态、粒径和电位、热稳定性等指标以及对RAW264.7细胞NO生成量的影响。5个Fuc样品的总糖含量、硫酸基含量、粒径与电位、糖醛酸含量及单糖组成和含量存在一定差异。5个Fuc样品溶液均带负电荷,均具有明显的含硫基团红外吸收特征峰;SEM结果显示,裙带菜来源的Fuc呈球形或片状形态,墨角藻来源的呈片状形态,而海带来源的Fuc呈絮状结构;TG-DSC分析表明,不同样品分解温度不同,分别在175 ~ 237 ℃之间;5个Fuc样品在质量浓度0.50 ~ 1.00 mg/mL范围内均具有一定程度的免疫调节活性,其中1.00 mg/mL Fuc刺激RAW264.7细胞产生的NO含量显著高于脂多糖LPS组(< 0.05),表明3种来源的Fuc在此浓度下均具有强烈的免疫刺激活性,并与其分子质量具有明显相关性,且以裙带菜来源的3个Fuc样品免疫刺激活性最强。不同来源的Fuc其基本组成总糖含量、硫酸基含量、糖醛酸含量、粒径、单糖组成和种类均存在差异。岩藻多糖的分子质量及硫酸基含量对热稳定性和免疫调节作用存在一定影响。
褐藻;岩藻多糖;理化性质;免疫调节作用
岩藻多糖(Fucoidan,Fuc)又称岩藻聚糖硫酸酯,主要来源于海洋褐藻,是一种含岩藻糖的复杂硫酸化多糖,Fuc的化学组成、结构和生物活性根据其来源、季节变换和提取方法等而有所不同。Fuc的主链由重复的(1→3)---吡喃岩藻糖或交替的(1→3)和(1→4)连接的--吡喃岩藻糖组成[1]。不同褐藻来源的Fuc硫酸基含量和取代度不同,其单糖组成也存在差异,除了主要的岩藻糖外,不同来源的Fuc还可能含有甘露糖、鼠李糖、半乳糖、葡萄糖、木糖、阿拉伯糖和葡萄糖糖醛酸[2]。
目前,关于Fuc的研究主要集中在抗癌[3]、抗肿瘤[4]、抗炎[5]、抗病毒[6]、抗血栓[7]、抗凝血[8]、抗氧化[9]、降血糖[10]、降胆固醇[11]、防辐射[12]、抗脂肪生成[13]及免疫调节[14]等方面。有学者提出,多糖调节免疫活性与其化学结构密切相关,特别是与硫酸基含量、相对分子质量、链构象、糖苷键的类型和位置等有关[15]。目前,不同褐藻来源岩藻多糖化学结构及性质的差异及其对免疫活性影响的研究鲜见报道。因此,本研究以3种不同褐藻来源的5个Fuc样品为原料,研究其理化性质和结构差异,分析不同浓度的5个Fuc样品对免疫活性的影响,以期为不同褐藻来源Fuc相关功能产品的研究与开发提供理论参考。
1 材料与方法
1.1 材料
1.1.1 主要材料 5种岩藻多糖(裙带菜来源Fuc I、裙带菜来源Fuc II购自青岛明月海藻集团,裙带菜来源Fuc III和墨角藻来源Fuc购自Sigma公司,海带来源Fuc购自上海源叶生物科技有限公司)依次记为编号A ~ E;Bradford蛋白浓度测定试剂盒,碧云天生物技术;标准品-甘露糖(-Man)、-鼠李糖(-Rha)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA)、-乙酰氨基葡萄糖醛酸(Glc-NAc)、-葡萄糖(-Glc)、-半乳糖(-Gal)、-木糖(-Xyl)、-阿拉伯糖(-Ara)、-岩藻糖(-Fuc),上海源叶生物科技有限公司;咔唑、1-苯基-3-甲基-5-吡唑啉酮(PMP),Sigma公司;三氯甲烷、甲醇、乙腈(均为色谱纯),赛默飞世尔科技公司;葡聚糖标准品(相对分子质量分别为5 000、11 600、23 800、48 600、80 900、148 000、273 000、409 800、667 800),Sigma公司;RAW 264.7细胞,中国科学院干细胞库;一氧化氮检测试剂盒,碧云天生物技术;DMEM培养基、青霉素、链霉素和胎牛血清(FBS),美国生命技术公司;脂多糖(LPS,大肠杆菌055:B5)购自Sigma公司。
1.1.2 主要仪器与设备 Varioskan Flash 全自动酶标仪,美国Thermo公司;Agilent1200 高效液相色谱仪、ZORBAX Eclipse XDB-C18色谱柱(4.6 mm × 250 mm,5 μm),美国安捷伦公司;BRUKER TENSOR-2 傅里叶变换红外光谱仪,德国Bruker公司;马尔文纳米粒度电位仪,上海马尔文帕纳科公司;同步热分析仪,德国 NETZSCH公司;N-4000 旋转蒸发仪,东京理化器械株式会社。
1.2 方法
1.2.1 岩藻多糖化学组成测定 Fuc总糖含量采用苯酚-硫酸法,以-岩藻糖为标准品[16];硫酸基含量采用氯化钡-明胶比浊法,以硫酸钾为标准品[17];糖醛酸含量用硫酸-咔唑法,以-葡萄糖醛为标准品[18];蛋白质含量采用考马斯亮蓝法,以牛血清白蛋白为蛋白标准品[19]。
1.2.2 岩藻多糖的紫外波长扫描 将Fuc粉末以蒸馏水配成0.1 mg/mL的溶液,以蒸馏水为参比,采用紫外-可见分光光度计在190 ~ 400 nm测定样品的紫外吸收光谱。
1.2.3 岩藻多糖单糖组成分析 称取Fuc样品各 3 mg,置于样品瓶中,加入1 mL的2 mol/L三氟乙酸(TFA)溶液,于110 ℃烘箱水解8 h,得样品水解液。单糖标准品和样品水解液经PMP-柱前衍生高效液相色谱法进行单糖组成分析。色谱条件:色谱柱为安捷伦ZORBAX EclipseXDB-C18色谱柱(4.6 mm × 250 mm,5 μm);流动相为0.1 mol/L磷酸盐缓冲液(pH 6.7)-乙腈溶液(体积比83∶17);柱温30 ℃;流速1 mL/min;检测波长:245 nm紫外检测器;进样体积10 μL[20]。
1.2.4 岩藻多糖的分子质量测定 采用高效凝胶色谱测定样品分子质量。色谱条件为:BRT105-104-102串联凝胶柱(8 mm × 300 mm);流动相:0.05 mol/L NaCl溶液;流速:0.6 mL/min,柱温:40 ℃;进样量:20 μL;检测器:示差检测器RI-10A。
1.2.5岩藻多糖的微观形态分析 取适量不同褐藻来源Fuc样品置于样品台,用导电胶固定后进行镀金,在5 kV电场下用扫描电子显微镜对Fuc的表面形态进行观察并拍照。
1.2.6 岩藻多糖的粒径与电位测定 将Fuc粉末以蒸馏水配成5 mg/mL的溶液,放置于马尔文纳米粒度电位仪样品槽进行测定,每个样品扫描3次。
1.2.7 岩藻多糖的结构分析 取1 ~ 2 mg样品与200 mg溴化钾混匀,充分研磨后压制成半透明薄片,利用傅里叶红外光谱(FTIR)进行扫描,扫描波数范围为4 000 ~ 400 cm-1,扫描时间为32 s。
1.2.8 岩藻多糖的热稳定性测定 将5 ~ 6 mg干燥Fuc粉末放置于专用铝坩埚内,在氮气气氛下升温速率为5 ℃/min,温度范围为30 ~ 300 ℃,用同步热分析仪对不同褐藻来源Fuc进行热稳定性测定。
1.3 细胞培养与免疫活性的研究
1.3.1 细胞培养 RAW 264.7细胞置于37 ℃用含体积分数5% CO2的DMEM培养基(体积分数10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)培养。
1.3.2 一氧化氮NO生产 将细胞悬液(1×104mL-1)接种至96孔板(100 μL/孔),使其在37 ℃、体积分数5% CO2条件的加湿培养箱中培养24 h。使用磷酸盐PBS缓冲液(0.1 mol/L,pH 7.2)洗涤两次去除非贴壁细胞,后向96孔分别加入100 μL不同浓度的五种不同来源的Fuc(用新鲜的完全DMEM培养基溶解,终质量浓度为0.50、0.75和1.00 mg/mL),孵育12 h。最后收集每个孔的培养上清液分析RAW 264.7细胞释放的NO。取上清液用一氧化氮检测试剂盒检测,在540 nm处测量光密度。以脂多糖(LPS,终质量浓度1 μg/mL)用作阳性对照,不含Fuc样品的DMEM培养基作为空白对照。根据NaNO2的校准曲线计算各NO产生量[21]。
1.4 数据处理与分析
采用Excel 2010软件处理数据,结果以3组平行的平均值±标准差表示,采用Origin 2017软件作图,采用SPSS 25.0进行显著性分析(邓肯分析),显著性水平= 0.05。
2 结果与分析
2.1 岩藻多糖的纯度分析
5个样品进行紫外波长扫描结果表明,仅在190 ~ 220 nm处具有糖类特征吸收峰,在260 nm未见核酸吸收峰,在280 nm未见明显的蛋白质吸收峰,其他紫外区域也无明显吸收峰,说明样品中基本不含蛋白质等化合物[22],样品较纯。
2.2 岩藻多糖的化学组成
3种不同褐藻来源的5个Fuc样品的总糖、蛋白质、硫酸基和葡萄糖醛酸含量如表1所示。5个Fuc样品中,裙带菜来源的3个Fuc样品总糖质量分数最高,为89.09% ~ 94.52%,显著高于海带来源Fuc样品(86.93%)和墨角藻来源Fuc样品(76.53%)(< 0.05)。5个样品均几乎不含蛋白质,与2.1节结果一致,说明5个Fuc样品纯化效果较好。5个样品的硫酸基含量有所差异,其中以样品C硫酸基质量分数较高,为57.54%,显著高于其他四个样品(< 0.05),而样品A(42.30%)和D(47.44%)硫酸基质量分数又显著高于样品B(38.5%)和E(38.95%)(< 0.05),样品A、D之间,B、C之间硫酸基质量分数无显著差异(> 0.05)。多糖的硫酸基团是影响其生物活性的关键因素[23],而硫酸基团含量受提取工艺如酸[24]、提取时间[25]等的影响。5个Fuc样品中糖醛酸质量分数差异显著(< 0.05),以样品E最高(20.91%),而同为裙带菜来源的样品A、B和C次之,样品D糖醛酸质量分数最低,为11.32%。3种不同褐藻来源的5个Fuc理化性质分析表明,不同褐藻来源Fuc样品的总糖、蛋白质、硫酸基和葡萄糖醛酸含量存在差异。

表1 不同褐藻来源岩藻多糖理化成分质量分数
注:同列数据凡含一个相同字母表示差异不具统计学意义(> 0.05)。
Note: The same letter in the samecolumn indicates that the difference is not statistically significant(> 0.05).
2.3 岩藻多糖的单糖组成
采用PMP-柱前衍生高效液相色谱法,对5个样品的单糖组成进行分析,5个样品的单糖摩尔百分比如表2所示。5个样品都含有-岩藻糖和-甘露糖,其中-岩藻糖摩尔百分比最高;5个样品均不含半乳糖醛酸、-乙酰-氨基葡萄糖和-半乳糖。结果表明,不同Fuc样品单糖组成及摩尔分数有所差异,可能是由于样品来源,提取方法、采收季节和地理位置等因素不同而引起的[26]。
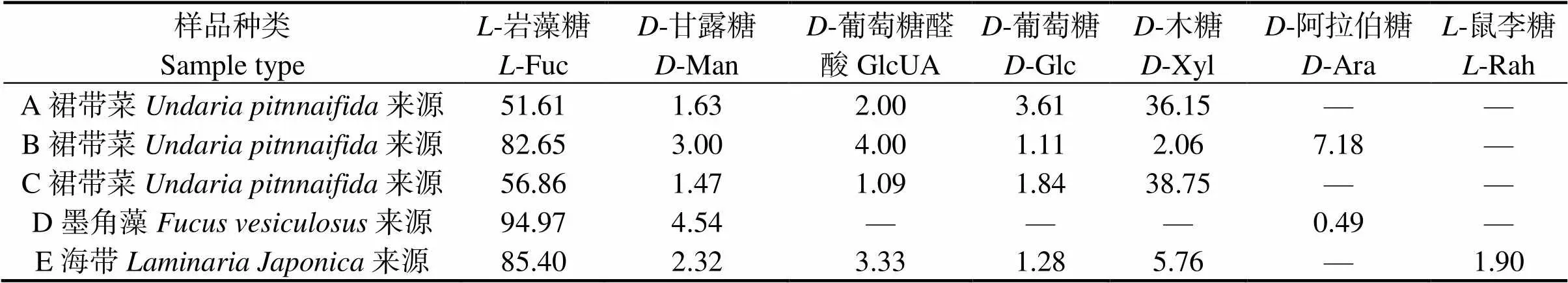
表2 不同褐藻来源岩藻多糖的单糖摩尔分数
注:—表示未检出。Note: —means not detected.
2.4 岩藻多糖的分子质量
图1所示,多糖样品A、B、D和E除了含有一个峰面积占比较大的峰以外,还含有一个占比较小的峰,而多糖样品C为单一色谱峰,说明纯度较高。多分散系数(重均分子质量m/ 数均分子质量m)是用于衡量分子质量的分布广度,m/m值越低,表明其分子质量分布较窄,反之,m/m值越大,说明体系的分子质量分布越宽[27]。由表3可知,样品A和C分散系数约为1.6,样品B、D和E分散系数为1.5,说明5个Fuc分子质量分布差异不大;结果表明,不同褐藻来源的5个Fuc分子质量各不相同。本研究中裙带菜来源的样品A、B、C的重均分子质量分别为23 909、10 331、19 516 u,与Yu等[28]从山东威海市场购买的裙带菜提取的Fuc分子质量明显不同(为103 552 u),可能是因为来源不同[29];海带来源的多糖样品E分子质量为78 580 u,与汤顺清[30]报道的海带岩藻多糖分子质量为69 518 u存在差异,这可能与提取和纯化方法等因素有关。另外,Benslima等[31]研究在4个收获期(12月、来年4月、7月和9月)从席夫纳氏囊链藻()中提取出一种硫酸化褐藻糖胶,其硫酸基质量分数和分子质量随收获季节变化很大,分别从12月的7.8 %和3 745 u变化至7月的34.8 %和26 390 u。
2.5 岩藻多糖的结构
如图2所示,在4 000 ~ 400 cm-1的频率范围内记录了多糖样品的FTIR图谱。5个岩藻多糖样品吸收峰均在3 500 cm-1~ 835 cm-1附近,5个样品在3 500 cm-1~ 2 500 cm-1之间的区域显示出两个主要峰,即所有多糖的特征吸收峰。3 500 cm-1和2 940cm-1处的吸收峰是由O—H和C—H拉伸振动引起的,1 130 ~ 1 180 cm-1处的吸收峰是由糖苷的C—O—C部分或环中的C—O—H拉伸振动引起的[32],1 070 cm-1和960 cm-1附近的吸收峰是吡喃环的伸缩振动[33];5个样品在1 640 cm-1和1 418 cm-1处有羧基(COO—)吸收峰,分别是由于不对称的C==O和对称的C==O伸缩振动产生,证明了糖醛酸的存在[34];在1 265 cm-1和835 cm-1处有硫酸基团(SO3-)的吸收峰[32],1 265 cm-1处的吸收是S==O伸缩振动引起的,830 ~ 840 cm-1附近的吸收峰是由岩藻糖或半乳糖的C-4的轴向位置存在硫酸盐引起的[35];578 cm-1附近的吸收峰是由于O==S==O的弯曲振动引起的[36],说明5个岩藻多糖都存在糖环、羟基、乙酰氨基、羧基和硫酸基等官能团并且多糖为阴离子多糖;同时,5个多糖含硫基团的红外吸收峰强度与硫酸基含量呈正相关。

A,裙带菜来源Fuc I;B,裙带菜来源Fuc II;C,裙带菜来源Fuc III;D,墨角藻来源Fuc;E,海带来源Fuc
表3 不同褐藻来源岩藻多糖分子质量分布

Table 3 Molecular weight distribution of fucoidans derived from different brown algae
注:A,裙带菜来源Fuc I;B,裙带菜来源Fuc II;C,裙带菜来源Fuc III;D,墨角藻来源Fuc;E,海带来源Fuc。表格中显示的均为峰面积占比大的分子质量,在色谱图中标记为1。
Notes: A,source Fuc I; B,source Fuc II; C,source Fuc III; D,source Fuc; E,source Fuc, respectively. All the molecular weights shown in the table are the ones with a large proportion of peak area and marked as 1 in the chromatogram.

图2 岩藻多糖4 000 ~ 400 cm-1范围内FTIR图谱
2.6 岩藻多糖的微观形态
如图3所示,对3种不同褐藻来源的5个Fuc分别进行扫描电子显微镜观察,裙带菜来源的样品A和B微观结构呈球形,但样品A球形直径大于样品B,裙带菜来源样品C呈现片状结构,且表面粗糙;样品D呈现片状结构,表面有不规则气泡状;样品E呈不规则絮凝聚集状。5个Fuc样品微观结构差异可能由于其分子质量或主链构象不同,从而影响多糖分子内的相互作用不同,形成不同结构[37]。

A,裙带菜来源Fuc I;B,裙带菜来源Fuc II;C,裙带菜来源Fuc III;D,墨角藻来源Fuc;E,海带来源Fuc
2.7 岩藻多糖的粒径与电位
从图4(a)中可以看出,5个Fuc样品的粒径分别为296.90、254.00、522.00、506.70和188.60 nm,裙带菜来源的样品A、B和C粒径大小有显著差异(< 0.05)。微观形态同为片状结构的样品C和D粒径明显较大(< 0.05)。结果表明,样品的粒径与分子质量和微观结构均有一定关系。多糖粒径大小对其体内代谢和生物利用度有很大影响,小分子物质比大分子物质更易被人体吸收利用[38]。
从图4(b)中可以看出,质量浓度为5 mg/mL的5个Fuc样品溶液均带负电荷,这与其含大量硫酸基团有关;5个Fuc样品的Zeta电位分别为-28.70、-21.40、-43.80、-45.00和-44.60 mV,Zeta电位绝对值接近或超过30。Zeta电位用于反应溶液表面所带静电荷的数量,一般Zeta电位绝对值大于30时,表明溶液较稳定[39],说明5个样品溶液均具有较好的物理稳定性。Fuc样品的Zeta电位受其浓度、硫酸基含量、葡萄糖醛酸含量及构象等因素影响[39]。

凡含一个相同字母表示差异不具统计学意义(> 0.05)
The same letter indicates that the difference is not statistically significant(> 0.05)
图4 岩藻多糖样品粒径和Zeta电位分布
Fig. 4 Particle size and zeta potential of fucoidans
2.8 岩藻多糖的热稳定性
如图5(a)所示,热重分析(TG)曲线显示Fuc经历两个主要的质量损失过程,第一次质量损失主要发生在39 ~ 140 ℃,这种质量损失主要来源于多糖中水分的损失;第二次质量的损失主要发生在140 ~ 230 ℃。5个Fuc样品(A-E)的最大重量损失速率温度(分解温度)分别为:169、169、186、226、230 ℃,这种快速质量损失可能是由多糖分解或硫酸基损失引起的[40]。
如图5(b)所示,示差扫描量热(DSC)曲线显示,Fuc样品首先在39 ~ 52 ℃发生玻璃化转变;随着温度升高,样品吸热结晶,水分不断蒸发,5个样品质量在173 ~ 244 ℃范围内减少;后样品熔解放热,5个岩藻多糖样品(A-E)的熔点分别为:173、175、193、237、244 ℃,此时样品质量急剧减少;最终趋于稳定。TG-DSC结果表明,裙带菜来源的Fuc样品A、B和C分解温度和熔点相近,而墨角藻和海带来源的Fuc样品的分解温度和熔点较高。不同样品间的热稳定性差异主要取决于它的化学结构,而其化学结构与Fuc来源、处理温度、单糖类型等有关[41]

2.9 不同褐藻来源岩藻多糖对NO产生的影响
利用Griess法测定RAW264.7细胞培养上清液中岩藻多糖对NO产生量的影响如图6所示。结果表明,5个多糖样品当其质量浓度为0.50 和0.75 mg/mL时,NO生成量显著高于空白组,但均显著低于LPS组(< 0.05),说明3种来源的Fuc均具有一定的免疫调节活性;但是当其质量浓度为1.00 mg/mL时,5个Fuc样品组NO生成量显著高于LPS组(< 0.05),表明在此浓度下3种来源的5个Fuc样品表现出非常强的免疫刺激活性[42]。裙带菜来源的Fuc组NO生成量显著高于墨角藻和海带来源的Fuc,表明3个裙带菜来源Fuc产品的免疫刺激活性优于墨角藻和海带来源的Fuc;并且在1.00 mg/mL质量浓度下,5个Fuc样品NO生成量与分子质量大小成正相关,分子质量最大的裙带菜来源Fuc A具有最强的免疫调节活性。巨噬细胞分泌NO在对抗肿瘤细胞和微生物中起着重要作用,可通过测量NO产生来评估岩藻多糖在RAW264.7细胞中的免疫刺激活性[43]。并且来自藻类的硫酸化多糖已被证明具有免疫调节活性,可能在刺激免疫反应或控制免疫细胞活性方面具有潜在应用[44]。Qi等[45]研究发现,椭圆小球藻()多糖的硫酸基含量和分子质量均影响NO的释放,且分子质量是刺激RAW264.7细胞产生NO的关键因素,与本研究结果一致。此外,Fuc硫酸基含量对RAW264.7细胞的刺激能力也有一定影响,因为当多糖脱硫时,对巨噬细胞的刺激能力会减弱,这与硫酸基团产生的负电荷密度水平有关[46];Sun等[32]也发现,海藻石莼()多糖分子中硫酸基基团可以调节RAW264.7巨噬细胞的免疫刺激活性。
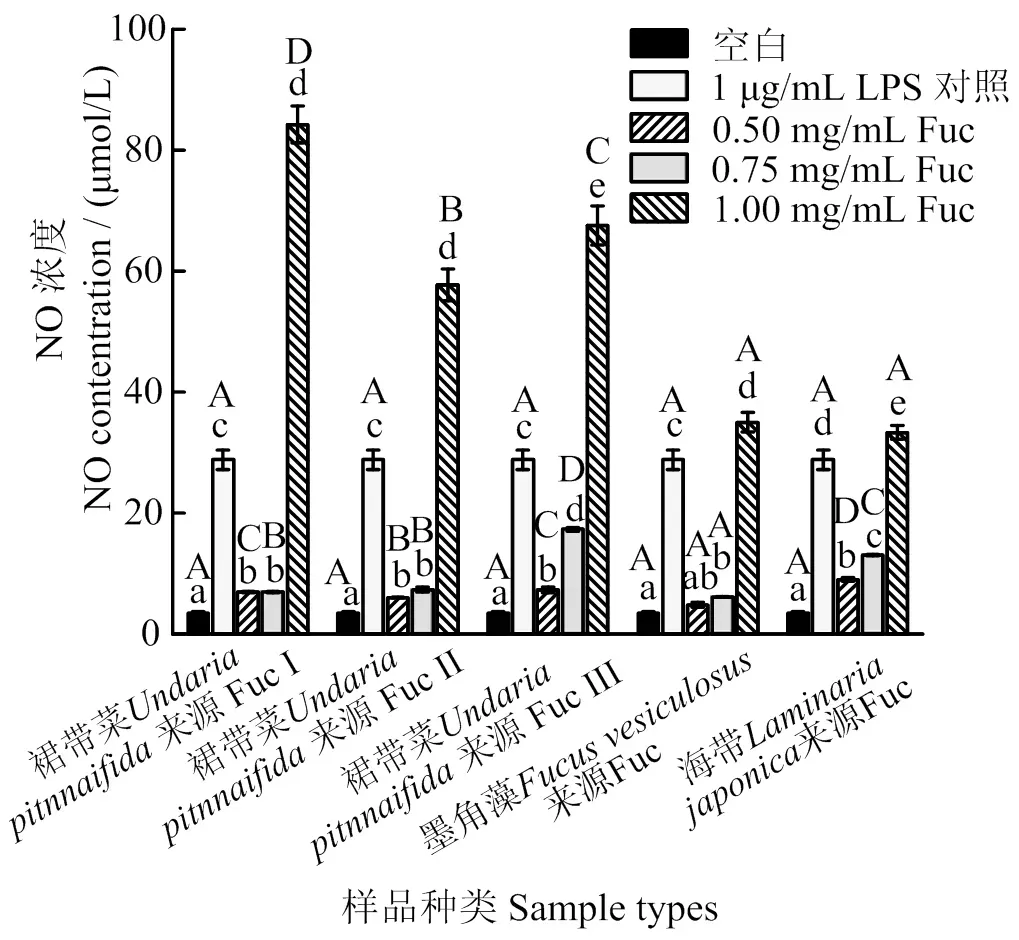
凡含一个相同字母表示差异不具统计学意义(> 0.05),小写字母表示同一样品不同浓度间,大写字母表示同一浓度不同样品间。
Where there is a same letterbetween any two data, the difference is not statistically significant (> 0.05), lowercase letters indicate the same sample with different concentrations, and uppercase letters indicate the same concentration and different samples.
.图6 不同浓度岩藻多糖对RAW264细胞NO浓度的影响
Fig. 6 Effects of different concentrations of fucoidans on NO production in RAW264 cells
3 结论
本研究发现5个Fuc样品的总糖含量、硫酸基含量、葡萄糖醛酸含量、分子质量、粒径和电位分布等存在差异。样品A、B和C(裙带菜来源)总糖质量分数较高(80.09% ~ 94.52%),而样品D(墨角藻来源)总糖含量最低(76.53%);样品C硫酸基含量最高(57.54%),显著高于其他四个样品(< 0.05);样品E(海带来源)糖醛酸含量最高(20.91%),显著高于其他四个样品(< 0.05)。5个样品单糖组成和种类略有不同,但均以-岩藻糖为主。样品A重均分子质量最大(23 909 u),样品E重均分子质量最小(7 858 u)。5个Fuc样品均在1 265 cm-1和835 cm-1处具有含硫基团的红外吸收特征峰,且微观形态也存在球形或片状结构差异。样品C、D粒径和Zeta电位绝对值明显较大。相对于墨角藻和海带来源的Fuc样品,裙带菜来源的样品具有较低的分解温度和熔点。5个Fuc样品其质量浓度为0.50和0.75 mg/mL时具有一定的免疫调节活性,在1.00 mg/mL时表现出非常强的免疫刺激活性,其中裙带菜来源的Fuc相比与墨角藻和海带来源的Fuc具有更强的免疫调节能力,这可能与裙带菜来源的Fuc样品含较高的总糖含量和硫酸基含量、较大的分子质量和球形的微观结构有一定关系。本研究表明不同褐藻来源Fuc其理化性质对免疫活性具有一定影响。
[1] ALE M T, MIKKELSEN J D, MEYER A S. Important determinants for fucoidan bioactivity: a critical review of structure-function relations and extraction methods for fucose-containing sulfated polysaccharides from brown seaweeds[J]. Marine Drugs, 2011, 9(10): 2106-2130.
[2] 陈舒桐, 俞珵, 李瑞, 等. 岩藻多糖的提取、化学改性、降血糖活性及机理研究进展[J]. 天然产物研究与开发, 2022, 34(1): 153-163.
[3] HAN Y, WU J, LIU T T, et al. Separation, characterization and anticancer activities of a sulfated polysaccharide from[J]. International Journal of Biological Macromolecules, 2016, 83: 42-49.
[4] KANG J, JIA X, WANG N F, et al. Insights into the structure-bioactivity relationships of marine sulfated polysaccharides: a review[J]. Food Hydrocolloids, 2022, 123: 107049.
[5] SANJEEWA K K A, JAYAWARDENA T U, KIM S Y, et al. Fucoidan isolated from invasiveinhibit LPS-induced inflammation via blocking NF-κB and MAPK pathways[J]. Algal Research, 2019, 41: 101561.
[6] KIM H, LIM C Y, LEE D B, et al. Inhibitory effects offucoidans against noroviruses[J]. Viruses, 2020, 12(9): 997.
[7] YAO Y, YIM E K F. Fucoidan for cardiovascular application and the factors mediating its activities[J]. Carbohydrate Polymers, 2021, 270: 118347.
[8] OBLUCHINSKSYA E D, MAKAROVA M N, POZHARITSKAYA O N, et al. Effects of ultrasound treatment on the chemical composition and anticoagulant properties of dryextract[J]. Pharmaceutical Chemistry Journal, 2015, 49(3): 183-186.
[9] KUMAGAI M, NISHIKAWA K, MATSUURA H, et al. Antioxidants from the brown alga[J]. Molecules (Basel, Switzerland), 2018, 23(5): 1214.
[10] ZHONG Q W, ZHOU T S, QIU W H, et al. Characterization and hypoglycemic effects of sulfated polysaccharides derived from brown seaweed[J]. Food Chemistry, 2021, 341: 128148.
[11] 廖敏, 谌素华, 王维民, 等. 张氏马尾藻多糖的体外降胆固醇活性[J]. 广东海洋大学学报, 2017, 37(3): 80-85.
[12] ZVYAGINTSEVA T N, USOLTSEVA R V, SHEVCHENKO N M, et al. Structural diversity of fucoidans and their radioprotective effect[J]. Carbohydrate Polymers, 2021, 273: 118551.
[13] WANG S H, HUANG C Y, CHEN C Y, et al. Isolation and purification of brown algae fucoidan fromand the analysis of anti-lipogenesis activity[J]. Biochemical Engineering Journal, 2021, 165: 107798.
[14] BHARDWAJ M, MANI S, MALARVIZHI R, et al. Immunomodulatory activity of brown algaederived sulfated polysaccharide on LPS induced systemic inflammation[J]. Phytomedicine, 2021, 89: 153615.
[15] YANG L Q, ZHANG L M. Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J]. Carbohydrate Polymers, 2009, 76(3): 349-361.
[16] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[17] ZHU Z J, ZHU B W, SUN Y J, et al. Sulfated polysaccharide from sea cucumber modulates the gut microbiota and its metabolites in normal mice[J]. International Journal of Biological Macromolecules, 2018, 120: 502-512.
[18] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330-334.
[19] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[20] DAI J, WU Y, CHEN S W, et al. Sugar compositional determination of polysaccharides fromby modified RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J]. Carbohydrate Polymers, 2010, 82(3): 629-635.
[21] WANG M, YANG X B, ZHAO J W, et al. Structural characterization and macrophage immunomodulatory activity of a novel polysaccharide fromRoxb[J]. Carbohydrate Polymers, 2017, 156: 390-402.
[22] KRICHEN F, BOUGATEF H, SAYARI N, et al. Isolation, purification and structural characterestics of chondroitin sulfate from smooth hound cartilage:anticoagulant and antiproliferative properties[J]. Carbohydrate Polymers, 2018, 197: 451-459.
[23] BILAN M I, USTYUZHANINA N E, SHASHKOV A S, et al. Sulfated polysaccharides of the Vietnamese brown alga(Fucales, Sargassaceae)[J]. Carbohydrate Research, 2017, 449: 23-31.
[24] FLÓREZ-FERNÁNDEZ N, TORRES M D, GONZÁLEZ-MUÑOZ M J, et al. Potential of intensification techniques for the extraction and depolymerization of fucoidan[J]. Algal Research, 2018, 30: 128-148.
[25] LORBEER A J, LAHNSTEIN J, FINCHER G B, et al. Kinetics of conventional and microwave-assisted fucoidan extractions from the brown alga,[J]. Journal of Applied Phycology, 2015, 27(5): 2079-2087.
[26] PTAK S H, HJULER A L, DITLEVSEN S I, et al. The effect of seasonality and geographic location on sulphated polysaccharides from brown algae[J]. Aquaculture Research, 2021, 52(12): 6235-6243.
[27] 左格格, 钟赛意, 陈菁, 等. 罗非鱼加工副产物不同部位硫酸软骨素的制备、理化性质及结构表征[J/OL].食品科学: 1-10 [2022-03-24]. http://kns.cnki.net/kcms/ detail/11.2206.TS.20211221.1433.044.html
[28] YU Y Y, ZHANG Y J, HU C B, et al. Chemistry and immunostimulatory activity of a polysaccharide from[J]. Food and Chemical Toxicology, 2019, 128: 119-128.
[29] MOHD FAUZIEE N A, CHANG L S, WAN MUSTAPHA W A, et al. Functional polysaccharides of fucoidan, laminaran and alginate from Malaysian brown seaweeds (,and)[J]. International Journal of Biological Macromolecules, 2021, 167: 1135-1145.
[30] 娄翠, 汤顺清. 海带岩藻多糖的分离纯化及结构特性的初步研究[J]. 食品工业科技, 2012, 33(4): 135-137.
[31] BENSLIMA A, SELLIMI S, HAMDI M, et al. Brown seaweedas a promising source of sulfated fucans: seasonal variability of structural, chemical, and antioxidant properties[J]. Food Science & Nutrition, 2021, 9(3): 1551-1563.
[32] SUN Y J, GONG G P, GUO Y M, et al. Purification, structural features and immunostimulatory activity of novel polysaccharides from[J]. International Journal of Biological Macromolecules, 2018, 108: 314-323.
[33] 陈菁, 杜振兴, 陈建平, 等. 虾头类肝素的制备、理化性质及抗凝血活性评价[J]. 食品科学, 2021, 42(11): 71-77.
[34] HENTATI F, DELATTRE C, URSU A V, et al. Structural characterization and antioxidant activity of water-soluble polysaccharides from the Tunisian brown seaweed[J]. Carbohydrate Polymers, 2018, 198: 589-600.
[35] CUI Y X, LIU X, LI S F, et al. Extraction, characterization and biological activity of sulfated polysaccharides from seaweed[J]. International Journal of Biological Macromolecules, 2018, 117: 256-263.
[36] LONG H R, GU X Y, ZHOU N, et al. Physicochemical characterization and bile acid-binding capacity of water-extract polysaccharides fractionated by stepwise ethanol precipitation from[J]. International Journal of Biological Macromolecules, 2020, 150: 654-661.
[37] WANG Y, SHEN X Y, YIN K Y, et al. Structural characteristics and immune-enhancing activity of fractionated polysaccharides from(Doll.) Ching[J]. International Journal of Biological Macromolecules, 2022, 205: 76-89.
[38] 东方, 于蕾, 程斌, et al. 刺山柑多糖表征结构研究[J]. 哈尔滨商业大学学报(自然科学版), 2014, 30(5): 558-560.
[39] CARNEIRO-DA-CUNHA M G, CERQUEIRA M A, SOUZA B W S, et al. Influence of concentration, ionic strength and pH on Zeta potential and mean hydrodynamic diameter of edible polysaccharide solutions envisaged for multinanolayered films production[J]. Carbohydrate Polymers, 2011, 85(3): 522-528.
[40] LIM S J, WAN AIDA W M, MASKAT M Y, et al. Characterisation of fucoidan extracted from Malaysian[J]. Food Chemistry, 2016, 209: 267-273.
[41] KOLSI R B A, SALAH H B, JARDAK N, et al. Sulphated polysaccharide isolated from: Characterization and hypolipidemic effects[J]. Carbohydrate Polymers, 2017, 170: 148-159.
[42] WU X Y, LIU Z C, LIU Y, et al. Immunostimulatory effects of polysaccharides fromandand their activation mechanism on RAW246.7macrophages[J]. Marine Drugs, 2020, 18(11): 538.
[43] JIA X J, LIANG Y E, ZHANG C, et al. Polysaccharide PRM3 fromroot enhances immune function through TLR4-NF-κB pathway[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2018, 1862(8): 1751-1759.
[44] XU S Y, HUANG X S, CHEONG K L. Recent advances in marine algae polysaccharides: isolation, structure, and activities[J]. Marine Drugs, 2017, 15(12): 388.
[45] QI J, KIM S M. Effects of the molecular weight and protein and sulfate content ofpolysaccharides on their immunomodulatory activity[J]. International Journal of Biological Macromolecules, 2018, 107: 70-77.
[46] GHLISSI Z, KRICHEN F, KALLEL R, et al. Sulfated polysaccharide isolated fromL.: structural characterization,andanticoagulant activity, and toxicological profile[J]. International Journal of Biological Macromolecules, 2019, 123: 335-342.
Physicochemical Properties and Immunomodulatory Effects of Fucoidan from Different Brown Algae
TAI Min-rui1, CAI Hong-ying1, LI Rui1,2, JIA Xue-jing1, LIU Xiao-fei1, JI Hong-wu1,2, ZHONG Sai-yi1,2
(1.////////,524088,;2.,,116034,)
【】To investigate the differences of physicochemical properties of fucoidans (Fucs) from different brown algae and the effect on immunomodulatory activity. 【】Five Fucs samples from three different brown algaes (,, and) were used as raw materials, Fourier infrared transform spectrometer (FTIR), scanning electron microscopy (SEM), nanoparticle size potentiometry, and simultaneous thermal analyzer (TG-DSC) were used to determine the molecular weight, microscopic morphology, particle size and potential, thermal stability, respectively, and the effect on NO production of RAW264.7 cells was also tested . The difference of the physicochemical properties and the immune activity of Fucs were further analyzed. 【】There was some difference in the total sugar content, sulfate group content, particle size and potential, glyoxylate content and monosaccharide composition and content of the five Fucs. All five Fucs solutions were negatively charged and had obvious infrared absorption characteristic peaks of sulfur-containing groups; SEM results showed that Fuc fromshowed spherical or lamellar shape, Fuc fromshowed lamellar shape, and Fuc fromshowed flocculent structure. The TG-DSC analysis showed that the decomposition temperatures of the five samples were different , which were between 175 ℃ and 237 ℃. All five Fucs had a certain degree of immunomodulatory activity within the concentration range of 0.50 - 1.00 mg/mL; the NO produced by RAW264.7 cells stimulated by Fucs at 1.00 mg/mL was significantly higher than that of the LPS group (< 0.05), indicating that the three sources of Fucs had significantly higher NO production than the LPS group, which had significant correlation with their molecular weight. Among which, the three Fucs fromhad the strongest immunostimulatory activity. 【】The basic composition of Fucs from different brown algae differed in total sugar content, sulfate group content, uronic acid content and particle size, as well as monosaccharide composition and types, and the molecular weight and sulfate group of the samples affect their thermal stability and the immunomodulatory effect.
brown algae; fucoidan; physicochemical properties; immunomodulatory effect
太敏瑞,蔡泓滢,李瑞,等. 不同褐藻来源岩藻多糖理化性质及其免疫调节作用[J]. 广东海洋大学学报,2022,42(3):62-71.
Q26
A
1673-9159(2022)03-0062-10
10.3969/j.issn.1673-9159.2022.03.009
2022-01-17
广东省自然科学基金面上项目(2021A1515010868);广东省普通高校特色创新项目(自然科学)(2020KTSCX051);广东省重点领域研发计划资助(2020B1111030004);国家重点研发计划(2020YFD0901101);广东科技计划“海外名师”项目(2020A1414010069);广东省高等学校科技创新团队项目(2021KCXTD021)
太敏瑞(1997―),女,硕士研究生,研究方向为海洋生物多糖生物制品研究与开发。E-mail:2276854760@qq.com
李瑞(1981―),女,副研究员,博士,研究方向为食品功能因子及生物制品研究与开发。E-mail:liruihn@163.com
(责任编辑:刘朏)
