蒲公英不同部位抑菌作用及代谢物差异的UPLC-MS/MS分析
2022-05-20罗利利薛姑美綦湘帆杜旭泓陈雅玲
罗利利 薛姑美 綦湘帆 杜旭泓 陈雅玲
(江西师范大学生命科学学院,江西 南昌 330000)
中药材蒲公英(TaraxacummongolicumHand.Mazz)是菊科蒲公英属多年生草本植物,别名黄花地丁、婆婆丁、蒲公草、尿床草等,主要包括菊科植物蒲公英、碱地蒲公英及同属植物的干燥全草[1]。蒲公英具有种质资源丰富、种类繁多、分布范围广、适应能力强、易于栽培等特点,是我国传统的中药材植物[2-4]。蒲公英含有黄酮类、酚酸类、多糖类、萜类、植物甾醇类、色素类、香豆素类以及微量元素等多种成分[5-6]。研究发现,蒲公英中的黄酮以及酚酸类成分是蒲公英提取物中的主要抑菌成分[3,7-8];蒲公英多糖对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌具有显著的抑制作用[9];且其中的倍半萜类和香豆素类物质也具有显著的抑菌作用[10-13]。随着人们对蒲公英抑菌作用研究的不断深入,从蒲公英中分离提取出疗效更好、毒副作用更低的生物活性成分,对于降低和控制某些细菌的耐药性具有十分重要的意义。
目前,对蒲公英中化学成分分析主要集中于单一成分的含量及种类测定,而对其整体代谢成分及不同部位的成分差异研究还不够深入。代谢组学主要是应用高通量筛选技术结合化学计量学的方法定量和定性分析生物体内的内源性代谢物[14]。代谢组学分析不仅能检测到一些常规分析方法难以检测到的物质,而且能系统分析主要差异物对生物体生理生化功能的影响,已成为分析生物间生理差异的重要手段[15]。基于代谢组学方法,可分析不同种类人参[16-17]以及不同段位鹿茸[18]中的代谢物成分差异。采用代谢组学可快速全面分析蒲公英不同部位多种具有生物活性代谢物的含量变化,有利于科学评估蒲公英不同部位药用成分的应用价值。
本研究采用打孔法测定蒲公英根、茎叶和花的水提取物以及醇提取物对变形杆菌、枯草芽孢杆菌、嗜根考克氏菌、大肠杆菌、铜绿假单胞菌的生长抑制作用,测定其最小抑菌浓度,获得蒲公英不同部位的抑菌活性差异;基于超高效液相色谱串联质谱(ultra-performance liquid chromatography tandem mass spectrometry, UPLC-MS/MS)方法分析蒲公英不同部位的代谢物差异,探究蒲公英不同部位可能具有的抑菌成分以及特定药用成分,旨在为利用蒲公英不同部位研制和开发抑菌效果更好的新药物提供理论依据。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、乙醇,均为色谱纯,德国Merck公司;标准品(色谱纯),美国BioBioPha/Sigma-Aldrich公司;乙醇(分析纯),西陇科学股份有限公司;LB肉汤,青岛高科技工业园海博生物技术有限公司;蒲公英全株,产地江苏徐州;变形杆菌(Proteushauser)、大肠杆菌(Escherichiacoli)、嗜根考克氏菌(Kocuriarhizophila)、铜绿假单胞菌(Pseudomonasaeruginosa)、枯草芽孢杆菌(Bacillussubtilis),江西省微生物菌种保藏管理中心保存菌株。
1.2 主要仪器
CBM 30A 超高效液相色谱,日本SHIMADZU公司;4500 QTRAP 串联质谱,美国SCIEX 公司;ACQUITY UPLC HSS T3 色谱柱,美国Waters公司;MM 400 研磨仪,浙江省瑞安市飞达药材器械厂;RE-3000C 旋转蒸发仪,上海亚荣生化仪器厂;DNP-9052 电热恒温培养箱,上海精宏实验设备有限公司;UV-3200 分光光度仪,上海美谱达仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 UPLC-MS/MS分析 将蒲公英根、茎叶、花分别干燥,粉碎形成粉末后称取100 mg,溶解于0.6 mL 70%甲醇提取液中,于4℃冰箱过夜,期间涡旋6次,10 000 r·min-1离心10 min,取上清液,用0.22 μm滤膜过滤上清液,保存于进样瓶,用于后续 UPLC-MS/MS 分析。UPLC-MS/MS分析在迈维代谢公司(湖北武汉)进行。
1.3.1.1 色谱条件 色谱柱为Waters UPLC HSS T3 C18柱(2.1 mm×100 mm,1.8 μm);流动相为A相(超纯水-0.04%乙酸溶液)和B相(乙腈-0.04%乙酸溶液)。洗脱梯度:0 min 5%B;0~10.00 min 95%B,维持1 min;11.00~11.10 min,5%B,平衡至14 min;流速0.35 mL·min-1;柱温40℃;进样量4 μL。
1.3.1.2 质谱条件 电喷雾离子源温度550℃,质谱电压5 500 V,帘气30 psi,碰撞诱导电离参数设置为高。在三重四级杆中,每个离子对根据优化的去簇电压和碰撞能进行扫描检测[19]。
1.3.2 蒲公英不同部位初提取物的制备 根据孙长霞等[20]的方法,分别称量蒲公英根、茎叶、花的粉末各100 g,用50%乙醇溶液加热回流提取2次,离心过滤,合并提取液,浓缩至1 g·mL-1,得到醇初提取物,4℃保存备用。
将蒲公英根、茎叶和花的样品粉末分别与超纯水按1∶10(g∶mL)的比例混匀,浸泡1 h,文火加热煎煮2 h,倒出药液,12 000 r·min-1离心 10 min,真空抽滤后去掉滤渣,再将得到的药液进行旋转蒸发浓缩至1 g·mL-1,得到水初提取物,4℃保存备用。
1.3.3 抑菌作用测定 参照谭才邓等[21]的方法,30 mL的LB培养基中加入40 μL细菌的菌悬液,用L型涂布棒将菌悬液涂抹均匀。用已灭菌的打孔器在涂布了菌液的培养基上等距打5个孔,孔中分别注入35 μL 1 g·mL-1的蒲公英不同部位初提取物、无菌水和50%乙醇。28℃倒置培养24 h,取出平板,用游标卡尺采用十字交叉法测量抑菌圈直径,以直径表示抑菌圈的大小。
1.3.4 对细菌生长的抑制作用 参考綦国红等[22]的方法,将变形杆菌菌液和不同浓度的蒲公英茎叶醇提取物按体积比9∶1的比例分装于锥形瓶中,震荡培养,每隔2小时用分光光度仪测定其在600 nm处的吸光度值(OD600),重复3次,计算平均值,绘制生长曲线。
1.3.5 数据分析 基于MVDB V2.0 数据库及代谢物信息公共数据库,根据二级谱信息进行物质定性分析,代谢物定量利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。对定性和定量获得的差异代谢物进行主成分分析(principal component analysis,PCA)、聚类分析,根据偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)预测模型的稳定可靠性。利用多维统计VIP(variable important in projection)值、单维统计P值及差异倍数(fold change, FC)筛选差异代谢物。差异倍数经Log2转化,选取VIP≥1,P<0.05,Log2 FC≥2或Log2 FC≤0.5的代谢物为差异代谢物,将得到的相应差异代谢物提交到KEGG(Kyoto Encyclopedia of Genes and Genomes)网站进行相关通路分析。
2 结果与分析
2.1 蒲公英不同部位初提取物抑菌活性
采用打孔法测定不同提取方法制备的蒲公英根、茎叶和花初提取物对变形杆菌、大肠杆菌、嗜根考克氏菌、铜绿假单胞菌和枯草芽孢杆菌的抑菌活性(表1、图1)。结果表明,蒲公英不同部位的水和醇提取物相比于50%乙醇对变形杆菌、嗜根考克氏菌和枯草芽孢杆菌有显著的抑菌活性,其中对变性杆菌的抑菌活性最强,而对大肠杆菌、铜绿假单胞菌无抑菌活性。由5种细菌的抑菌半径可知,不同部位醇提取物中蒲公英花醇提取物抑菌活性最强,不同部位水提取物中花水提取物抑菌活性最强,根水提取物抑菌活性最弱。
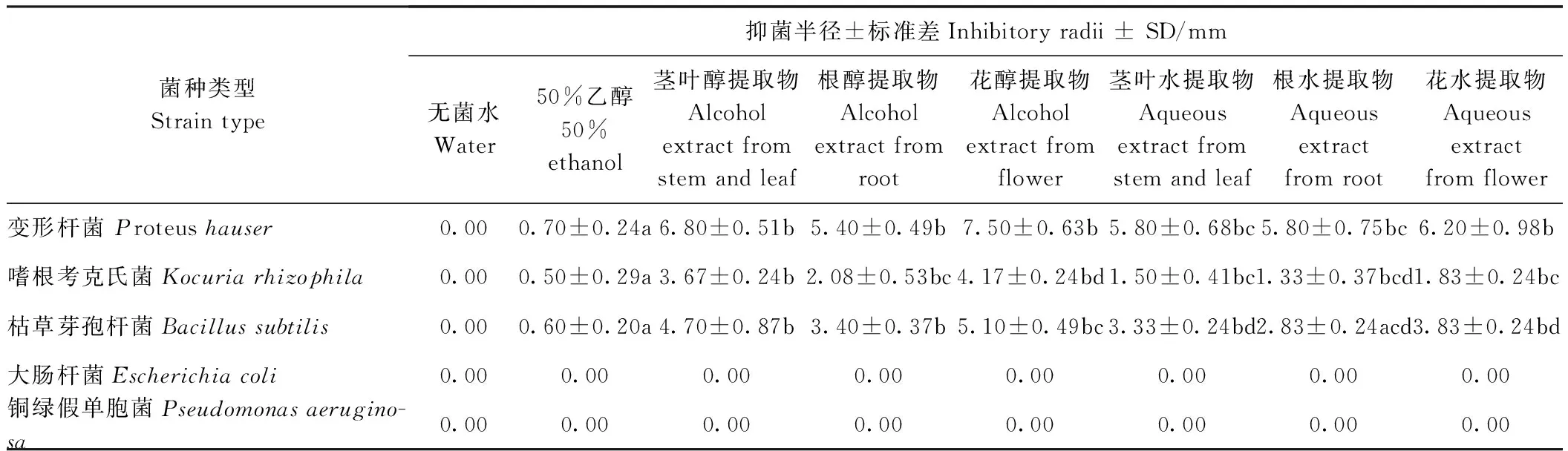
表1 蒲公英不同部位提取物对5种细菌的抑菌半径Table 1 Inhibitory radii of extracts from different parts of dandelion on five kinds of bacteria

注:A:大肠杆菌;B:铜绿假单胞菌;C:嗜根考克氏菌;D:枯草芽孢杆菌;E:变形杆菌。a:水;b:乙醇;c:茎叶;d:根;e:花。Note: A: Escherichia coli. B: Pseudomonas aeruginosa. C: Kocuria rhizophila. D: Bacillus subtilis. E: Proteus hauser. a: Water. b: Ethanol. c: Stem and leaf. d: Root. e: Flower.图1 蒲公英不同部位醇提取物对5种细菌抑菌实验平板Fig.1 The inhibitory effects of alcohol extracts from different parts of dandelion on five kinds of bacteria
2.2 蒲公英最小抑菌浓度
根据蒲公英抑菌活性测定结果,选择测定其茎叶醇提取物对变性杆菌的最小抑菌浓度。由图2可知,不同浓度的蒲公英茎叶醇提取物对变形杆菌均有一定的抑制生长作用,0.125 g·mL-1提取物抑菌效果最弱,随着浓度的逐步增大,对变形杆菌的抑菌效果逐步增强,当浓度增至1 g·mL-1时,对变形杆菌直接有致死的作用。
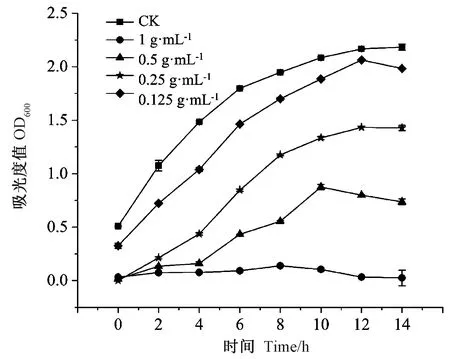
图2 蒲公英茎叶醇提取物对变性杆菌生长的影响Fig.2 Effect of alcohol extract from dandelion stem and leaf on the growth of Proteus hauser
2.3 蒲公英不同部位代谢物的分离与鉴定
基于UPLC-MS/MS检测方法,从蒲公英不同部位的醇提取物中共检测到449种代谢物(表2),包括10种类型:黄酮类(107种)、脂类(69种)、酚酸类(60种)、其他类(51种)、氨基酸及其衍生物(47种)、核苷酸及其衍生物(35种)、有机酸类(34种)、生物碱类(27种)、木脂素和香豆素类(11种)、萜类(7种)以及鞣质类(1种),其中黄酮类化合物种类最多,其次是脂类、酚酸类。
分别对蒲公英根、茎叶和花代谢物含量排名前20的物质进行分析,发现根中脂类占12种、酚酸类占3种、氨基酸及其衍生物和生物碱类各占2种、有机酸类占1种,其中相对含量最高的物质是反油酸(5.95×107,脂类)、其次为异绿原酸B(5.78×107,酚酸类);蒲公英茎叶中脂类占11种,氨基酸及其衍生物占2种,黄酮类占3种,酚酸类和生物碱类各占2种,其中含量最高的物质是γ-亚麻酸(5.79×107,脂类),其次为单酰甘油酯(酰基18∶3)异构1(5.75×107,脂类);蒲公英花中黄酮类占8种,脂类占5种,酚酸类占3种,生物碱类、核苷酸及其衍生物、氨基酸及其衍生物和有机酸类各占1种,其中含量最高的物质是木犀草素(9.25×107,黄酮类),其次是丙戊酸钠(8.87×107,有机酸类)(表3)。
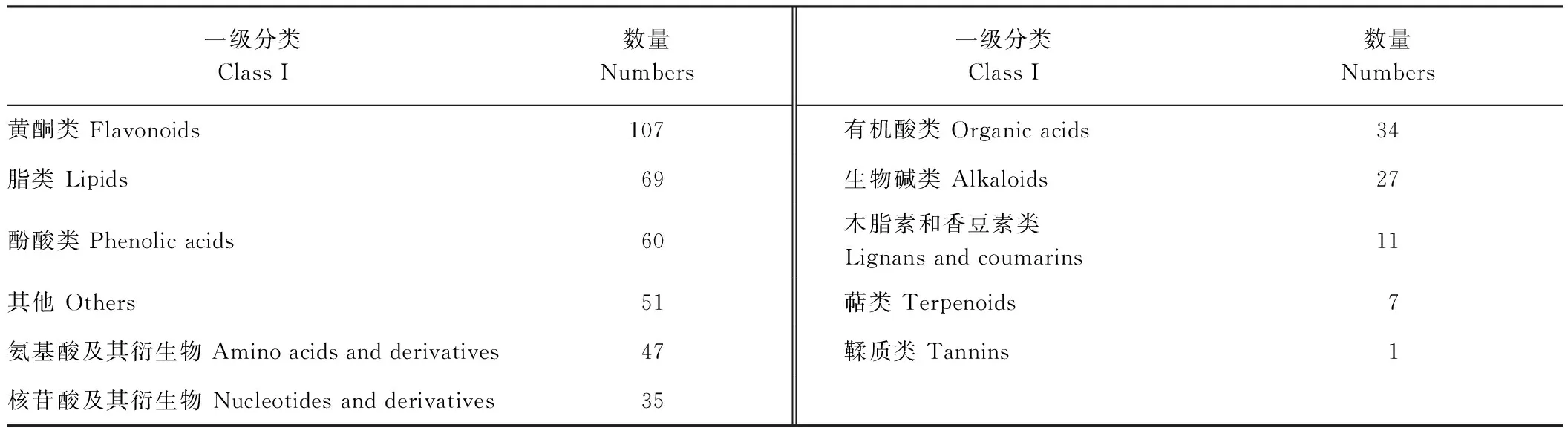
表2 蒲公英代谢物分类占比Table 2 The classified proportion of metabolites of dandelion
2.4 蒲公英不同部位差异代谢物分析
对蒲公英不同部位差异代谢物进行主成分和OPLS-DA分析,通过T检验,根相比于茎叶中筛选到显著差异代谢物266个,其中上调代谢物64个,下调代谢物202个;根相比于花中筛选到显著差异代谢物304个,其中上调代谢物66个,下调代谢物238个;茎叶相比于花中筛选到显著差异代谢物246个,其中上调代谢物84个,下调代谢物162个。差异代谢物层次聚类分析发现黄酮类在蒲公英不同部位变化最大,花中大多数上调,而根中大部分下调;相反,脂类在根中大多数上调,在花中下调(图3)。
对上调和下调差异倍数分别排在前10位的代谢物进行分析,发现蒲公英根相比于茎叶、花的差异代谢物上调幅度最大的物质为木犀草素-7-O-葡萄糖苷,下调幅度最大的物质分别为草酸和橙皮素C-丙二酰己糖苷。蒲公英根相比于花和茎叶大部分黄酮类和有机酸类均下调,大多数氨基酸及其衍生物和脂类上调(图4)。此外,在蒲公英不同部位均检测出特有代谢物,如橙皮素C-丙二酰己糖苷只存在根中;山奈酚3-O-β-(2″-O-乙酰基-β-D-葡萄糖醛酸、水杨酸苄酯、麦黄酮O-葡萄糖醛酸以及槲皮素7-O-丙二酰基己糖基-己糖苷只在茎叶中发现;熊果酸、刺甘草查尔酮、木犀草素O-己糖基-O-戊糖苷、金圣草黄素5-O-己糖苷、D-丙氨酰-D-丙氨酸、3′, 4′, 7-三羟基黄酮和杠柳苷B这7种物质只存在于花中(表4)。

表3 蒲公英根、茎叶和花代谢物中含量分别排名前20的物质Table 3 The top 20 metabolites in roots, stems, leaves, and flowers of dandelion, respectively
2.5 差异代谢物KEGG功能注释及富集分析
生物体中复杂的代谢反应一般由多个基因和蛋白质互相影响和调控,最终导致代谢组发生系统性改变。利用差异代谢物进行KEGG通路富集,其中富集因子为差异表达的代谢物中在对应通路中的个数与该通路检测注释到的代谢物总数的比值,该值越大表示富集程度越大。代谢组数据结果表明,根相比于茎叶、根相比于花以及茎叶相比于花的差异代谢物中分别有194、195和197个代谢物被注释到相应代谢通路中

注:颜色从绿到红表示代谢物的表达丰度从低到高。Note: Color from green to red indicates that the expression a bundance of metabolites is from low to high.图3 蒲公英不同部位差异代谢物热图Fig.3 Heat map of different metabolites in different parts of dandelion

表4 蒲公英根、茎叶和花中特有的代谢物Table 4 Metabolites unique to the roots, stems, leaves, and flowers of dandelion
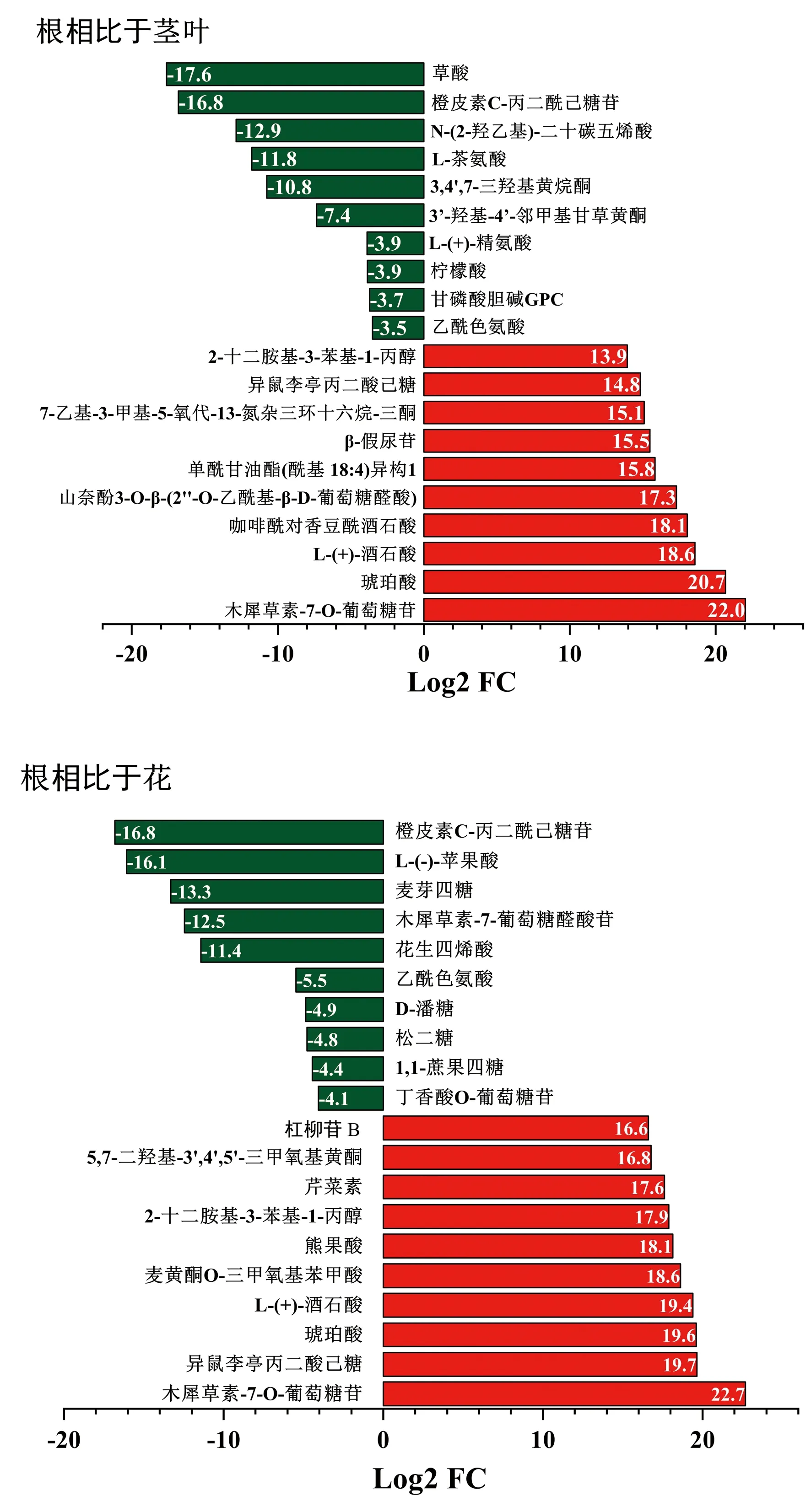
图4 蒲公英根与茎叶、花上调和下调差异倍数分别排在前10位的代谢物Fig.4 Metabolites with up-regulation and down-regulation of the top 10 differences in root vs stem and leaf and root vs flower, respectively
。筛选出的所有差异代谢物共富集在76条代谢通路上,前5条通路为代谢途径、次生代谢物的生物合成、类黄酮生物合成、黄酮与黄酮醇生物合成以及苯丙烷生物合成通路(图5)。根相比于茎叶发生极显著改变的代谢通路中排名第一和第二的分别是类黄酮生物合成以及黄酮和黄酮醇生物合成,涉及木犀草素-7-O-葡萄糖苷、绿原酸、3, 4′, 7-三羟基黄烷酮、3-O-对香豆酰奎尼酸、N6-乙酰-L-赖氨酸、柚皮素、槲皮素、柚皮素查尔酮、芹菜素、三叶豆苷、3, 7-二-O-甲基槲皮素、芹菜素7-O-葡萄糖苷、异槲皮苷和香叶木素-7-O-半乳糖苷差异代谢物;根相比于花中发生极显著改变的代谢通路中排名前三的分别是次生代谢产物生物合成、黄酮和黄酮醇生物合成以及类黄酮生物合成;茎叶相比于花中发生极显著改变的代谢通路中排名第一和第二的分别是黄酮和黄酮醇生物合成以及类黄酮生物合成(图5)。蒲公英不同部位的药效不同可能与黄酮和黄酮醇生物合成以及类黄酮生物合成密切相关,这两类物质的合成途径可为寻找和研发新的抗菌物质提供参考。
3 讨论
本研究结果表明,蒲公英50%醇提取物的抑菌活性优于水提取物(表1),与前人研究结果一致[20,23]。壳聚糖-蒲公英提取物、蒲公英多糖对大肠杆菌有一定的抑菌活性[24-25]。金三俊等[26]研究了5种中草药对大肠杆菌的抑制作用,发现黄芩和蒲公英组合对大肠杆菌有较强的抑菌效果。本研究中,蒲公英不同溶剂、不同部位提取物对大肠杆菌均未显示抑菌活性(表1),与上述文献报道结果不一致,可能与提取方法、浓度以及测定方法不同有关,具体原因还有待进一步验证。
本试验中蒲公英花醇提取物的抑菌活性最强,根水提取物最弱(图1)。前人研究表明,蒲公英根、茎、叶、花和全草的醇提取物中黄酮含量具有差异,花中含量最高,抑菌效果分析发现黄酮相较于蒲公英多糖及酚酸的抑菌效果最强[23, 27-29]。本研究代谢组分析发现,蒲公英根中相对含量最高的物质是反油酸、脂类的相对含量较高;而花中相对含量最高的物质是木犀草素(黄酮类),黄酮类的相对含量较高(表3),表明蒲公英花抑菌活性最强可能是其活性成分黄酮含量较高所致。

图5 蒲公英根与茎叶、花差异代谢物通路分析图Fig.5 Pathway analysis for differential metabolites in root vs stem and leaf and root vs flower, respectively
近年来关于蒲公英提取物抑菌作用的研究较多,但多数并没有明确鉴定蒲公英提取物中何种成分有抑菌作用。蒲公英根、茎叶和花差异代谢物分析发现,根相比于茎叶、花,差异代谢物上调幅度最大的物质为木犀草素-7-O-葡萄糖苷(图4)。此外,花中含量最高的物质是木犀草素。木犀草素是一种天然黄酮,在植物中通常以糖苷的形式存在,在不同生理系统中具有减轻氧化应激和炎症机制的作用。Son等[30]研究发现木犀草素和木犀草素7-O-葡萄糖苷通过调节高同型半胱氨酸血症ApoE基因敲除小鼠的炎症和氧化应激来改善动脉粥样硬化的形成。在角质形成细胞中已经证明,木犀草素-7-O-葡萄糖苷能够通过激活酪氨酸激酶/转录因子3(JAK/STAT3)通路,从而抑制致炎基因的转录。Stefano等[31]研究表明,木犀草素-7-O-葡萄糖苷对该通路的抑制作用是通过损伤转录因子3(STAT3)的核转位来实现的。此外,木犀草素-7-O-葡萄糖苷已经被证明在生长的细胞中有较强的抗氧化作用,并且对细胞能量的产生也有重要的影响[32]。木犀草素-7-O-葡萄糖苷通过靶向JAK/STAT3通路抑制促炎细胞因子反应,该抑制反应能减少脂质堆积和氧化,可能是心血管高危患者潜在的治疗策略[33]。由于蒲公英花中有较高含量的木犀草素和木犀草素-7-O-葡萄糖苷,因此,蒲公英花可作为提取木犀草素和木犀草素-7-O-葡萄糖苷的候选材料。
4 结论
本研究结果表明,打孔法和最小抑菌浓度测定揭示了不同提取方法和不同部位对蒲公英的抑菌活性均有影响,花提取物抑菌活性最强,根提取物最弱。基于UPLC-MS/MS的代谢组学技术研究蒲公英不同部位的代谢物差异具有可行性,结果显示蒲公英根、茎叶和花中含量最高的物质分别是反油酸(脂类)、γ-亚麻酸(脂类)及木犀草素(黄酮类),根、茎叶和花中含量排名前20的物质中黄酮类分别有0种、3种及8种。表明黄酮类物质可能是蒲公英中主要抑菌活性物质,且蒲公英花可作为提取木犀草素的原料。代谢通路分析发现,蒲公英不同部位的类黄酮生物合成以及黄酮和黄酮醇的生物合成具有差异,木犀草素、木犀草素-7-O-葡萄糖苷、芹菜素、芹菜素7-O-葡萄糖苷、3, 4′, 7-三羟基黄烷酮和绿原酸等是关键代谢物质。蒲公英不同部位可作为提取不同关键物质的候选材料,其特有的代谢物也可为新型药物研发提供新思路。
