切削液中的微生物对2219铝合金腐蚀行为影响*
2022-05-19申媛媛董耀华朱红玲董丽华
申媛媛 董耀华 杨 懿 朱红玲 董丽华
(上海海事大学海洋科学与工程学院 上海 201306)
铝合金由于具有优异的性能而广泛应用于航空航天、汽车和国防等性能要求高的领域[1]。但是铝合金作为两性金属,在酸性和碱性环境中均易发生腐蚀。而且高强度铝合金中往往含有Zn、Cu、Mg、Mn、Si等元素,这些合金元素的加入虽然提高了铝的性能,但同时也会引入异质相,增强了材料对环境中腐蚀性介质的敏感性[2-3]。2219铝合金的机械加工性能好,断裂韧度高,在高温和低温的力学性能好,抗应力腐蚀性能好,在航空航天领域应用广泛[4]。但是在现场切削加工过程中,2219铝合金零件极易出现白斑黑点等腐蚀现象,由于铝合金价格贵,铝合金零件周转周期长,精度要求高,一旦受切削乳化液影响出现腐蚀,只能报废,给企业造成巨大的经济损失。
水溶性切削液是一种半合成的微乳型切削液,具有良好的润滑、冷却、清洗、防锈等特点,广泛应用于铝合金加工领域,其中含有大量矿物油、脂肪酸以及各种表面活性添加剂,在使用过程中极易滋生微生物[5-7],导致切削液性能降低[8]。目前的研究普遍认为铝合金工件的腐蚀是由切削液的劣化造成的,而切削液中滋生的微生物对工件、刀具以及机床的腐蚀影响很容易被忽略。据统计,全世界每年由于腐蚀造成的损失高达数万亿美元,约占全球生产总值的6%[9],微生物腐蚀(MIC)是腐蚀的一个重要方面,大约占腐蚀损失的20%[10-11]。微生物在海洋、石油管道、核电等领域造成的腐蚀损失已经引起了广泛关注[12-16],而在切削加工行业,微生物对工件的腐蚀作用却很少引起重视,相关的微生物腐蚀影响及腐蚀机制研究甚少。
本文作者以航空航天领域常用的2219铝合金为研究对象,研究切削液中滋生的微生物对其腐蚀行为的影响。采用失重法研究铝合金在微生物作用下的腐蚀速率,利用扫描电子显微镜观察铝合金表面的腐蚀形貌,通过倒置荧光显微镜表征微生物在铝合金表面的附着情况,采用能谱仪分析腐蚀产物成分组成,最后采用电化学方法来进一步研究切削液中微生物对铝合金的腐蚀影响及腐蚀规律。
1 试验部分
1.1 材料与试样
试验用铝合金牌号为2219,由上海某航天材料研究所提供,成分见表1。试验前,将铝合金切割为10 mm×10 mm×2 mm的试样,用碳化硅砂纸在有水情况下逐级打磨到800#,用无水乙醇超声清洗10 min,之后用吹风机吹干,放在干燥皿中备用。一部分切割好的试样背面用焊锡与铜导线连接,然后用环氧树脂将焊接面和试样的其余面均封装起来,仅露出10 mm×10 mm的工作面。工作面用耐水砂纸逐级打磨到800#,然后用无水乙醇和去离子水清洗,干燥后作为电化学试样备用。另外一部分试样用于腐蚀质量损失分析及腐蚀形貌观测,浸泡前用电子天平(AUW220D)进行称重,精确到0.01 mg。所有试样在试验前,均置于紫外灯下处理20 min,保证不引入其他微生物。
1.2 多样性分析
切削废液样品取自上海某航天材料研究所,为使用一段时间的Castrol Alusol SL 51 XBB切削液。该切削液主要成分为矿物油,质量分数为50%是一种高性能水溶性铝合金加工液。将取回的切削废液在高速离心机(Thermo,Multifuge X1R)中进行离心分离,转速为20 000 r/min,时间为15 min。离心后倒掉上层溶液,留下离心出的微生物送至上海美吉生物医药科技有限公司进行多样性分析。
1.3 试验环境
试验介质有2种:取回的切削废液,记为S1(含有多种微生物),在高压灭菌锅中灭菌处理(时间为15 min,温度为121 ℃)的切削废液,记为S2。试验介质均盛装在250 mL的锥形瓶中,用棉塞塞住瓶口。将打磨好的试样浸泡在上述2种溶液中,然后放在37 ℃恒温摇床(KYC-1112B)上培养。每隔一段时间取出试样,并立即浸泡在2%戊二醛溶液中固化1 h,然后分别用体积分数25%、50%、75%和100%的乙醇逐级脱水,每种体积分数的乙醇中脱水处理15 min,最后取出试样干燥。试验过程均在无菌操作台上进行。
1.4 腐蚀速率
浸泡不同时间后,取出样品,用蒸馏水清洗,并根据ASTM G1-03[17]将表面的腐蚀产物及生物膜去除;然后用无水乙醇冲洗并干燥;最后再次称量试样质量,估算腐蚀速率。腐蚀速率计算公式如下:
(1)
式中:vcorr为腐蚀速率;Δm为试样质量损失;S为试样表面积;t为腐蚀时间。
为了保证数据的准确性,每个试验条件下的腐蚀试验均进行3次平行试验,取平均值。
1.5 腐蚀形貌及成分
脱水后的试样一部分用1 mg/mL的吖啶橙溶液进行染色,染色时间为10 min;然后干燥并放在倒置荧光显微镜(NIKON/Ti-E)下观察微生物在铝合金表面的附着情况。另外一部分未染色的试样用带有能谱(EDS)的场发射扫描电子显微镜(JSM-7500F)观察合金的表面形貌,并对表面成分进行元素分析。最后根据ASTM G1-03[17]去除未染色试样表面的腐蚀产物及生物膜,使用光学轮廓仪(Contour GT)观察去除膜层后铝合金表面的腐蚀轮廓。
此外,通过X射线衍射仪(X’Pert PRO MPD)对铝合金表面腐蚀产物的物相进行分析,采用的电压为40 kV,电流为10 mA,靶源为Cu-Kα,扫描范围为10°~90°。
1.6 电化学试验
电化学试验体系采用三电极,参比电极为饱和甘汞电极(SCE),对电极为铂片电极(10 mm×10 mm),工作电极为浸泡在2种介质中不同时间的铝合金试样,测试介质为灭菌的切削液,以保持腐蚀介质恒定,测量工作电极的开路电位和阻抗谱曲线。所有试样在测试之前都在开路电位下浸泡30 min,且在室温无菌环境下进行,保证测试过程稳定。电化学阻抗(EIS)的测试频率范围104~10-2Hz,幅值是±5 mV。
2 结果与讨论
2.1 铝合金的微观形貌分析
铝合金2219的微观形貌及成分分布如图1所示。从图1(a)中可以看出,铝合金表面分布着颗粒状第二相,且第二相的数量较多,但是尺寸较小。而且由2种形状的相组成,其中一种为无规则形状,边缘较为粗糙,而另外一种呈现圆形,边缘较为光滑。粗糙颗粒相主要由Fe、Cu、Si、Al 4种元素组成(见图1(b)),而圆形颗粒相以Cu、Mg、Al为主要元素,形成Al2CuMg相[18](见图1(c)、(d))。
2.2 铝合金的腐蚀速率
图2所示为铝合金2219分别浸泡在含有微生物的切削废液和灭菌的切削废液2种溶液中的腐蚀速率变化曲线。可以看出,铝合金2219在含有微生物的切削废液中的腐蚀速率先增大后减小,最后又出现增大的趋势。主要是因为在浸泡初期,铝合金直接暴露在溶液中,侵蚀性介质与铝合金直接接触,加快了铝合金的腐蚀;但是随着时间的延长,铝合金表面不仅逐渐沉积有机物,而且还有微生物附着,并逐渐形成生物膜,故对铝合金起到短暂的保护作用,腐蚀速率逐渐降低;随着浸泡时间的进一步延长,微生物新陈代谢活动旺盛,腐蚀作用大于膜层的保护作用,铝合金的腐蚀进一步加剧。而浸泡在灭菌后的切削废液中的铝合金2219腐蚀速率变化趋势完全不同,总体呈现出先增大,然后趋于稳定的趋势。同样,在浸泡初期腐蚀速率逐渐增大,随着浸泡时间的延长,铝合金表面被一层有机沉积物膜覆盖,阻碍了腐蚀介质与铝合金的直接接触,从而抑制了铝合金的进一步腐蚀。浸泡在含有微生物的切削废液中14 d,铝合金2219的腐蚀速率为78.01 mg/(dm2·d),而浸泡在不含微生物的切削废液中的腐蚀速率仅为49.13 mg/(dm2·d),微生物的存在使2219铝合金的腐蚀速率增大了59%。说明微生物的存在加速了铝合金在切削液中的腐蚀,该结论与JIRN-LAZOS等[19]的结果相一致。
2.3 铝合金2219腐蚀形貌分析
图3所示为铝合金2219在不同切削废液中浸泡前后的表面形貌。

图3 铝合金2219在不同切削液中浸泡前后的扫描电镜形貌
可以看出,浸泡在含有多种微生物的切削废液中3 d时,铝合金表面仅有零星的微生物附着(见图3(b)),浸泡15 d后,铝合金表面被多种形态的微生物附着,微生物周围有大量黏性胞外分泌物,并形成一层生物膜,划痕被完全覆盖掉(见图3(c))。但是生物膜看上去并不是很致密,出现了裂纹和孔洞。而浸泡在灭菌处理的切削废液中的铝合金表面的划痕清晰可见(见图3(d)),与浸泡前的试样相比差别不大。
采用倒置荧光显微镜进一步观察微生物在铝合金2219表面的附着情况,并与浸泡在灭菌切削液中的试样进行对比,结果如图4所示。可知,在含有多种微生物的切削废液中浸泡3 d时,铝合金表面没有发现明显的微生物附着(见图4(a));浸泡5 d后,微生物表面有零星的微生物附着(见图4(b));浸泡7 d后,铝合金表面的微生物附着量进一步增大,逐渐聚集成团簇状,并形成菌落(见图4(c));浸泡10 d后,铝合金表面的微生物菌落继续增多(见图4(d));众多的微生物菌落在铝合金表面上逐渐扩展形成生物膜(见图4(e))。而浸泡在灭菌处理的切削废液中,铝合金表面没有发现微生物附着现象(见图4(f))。
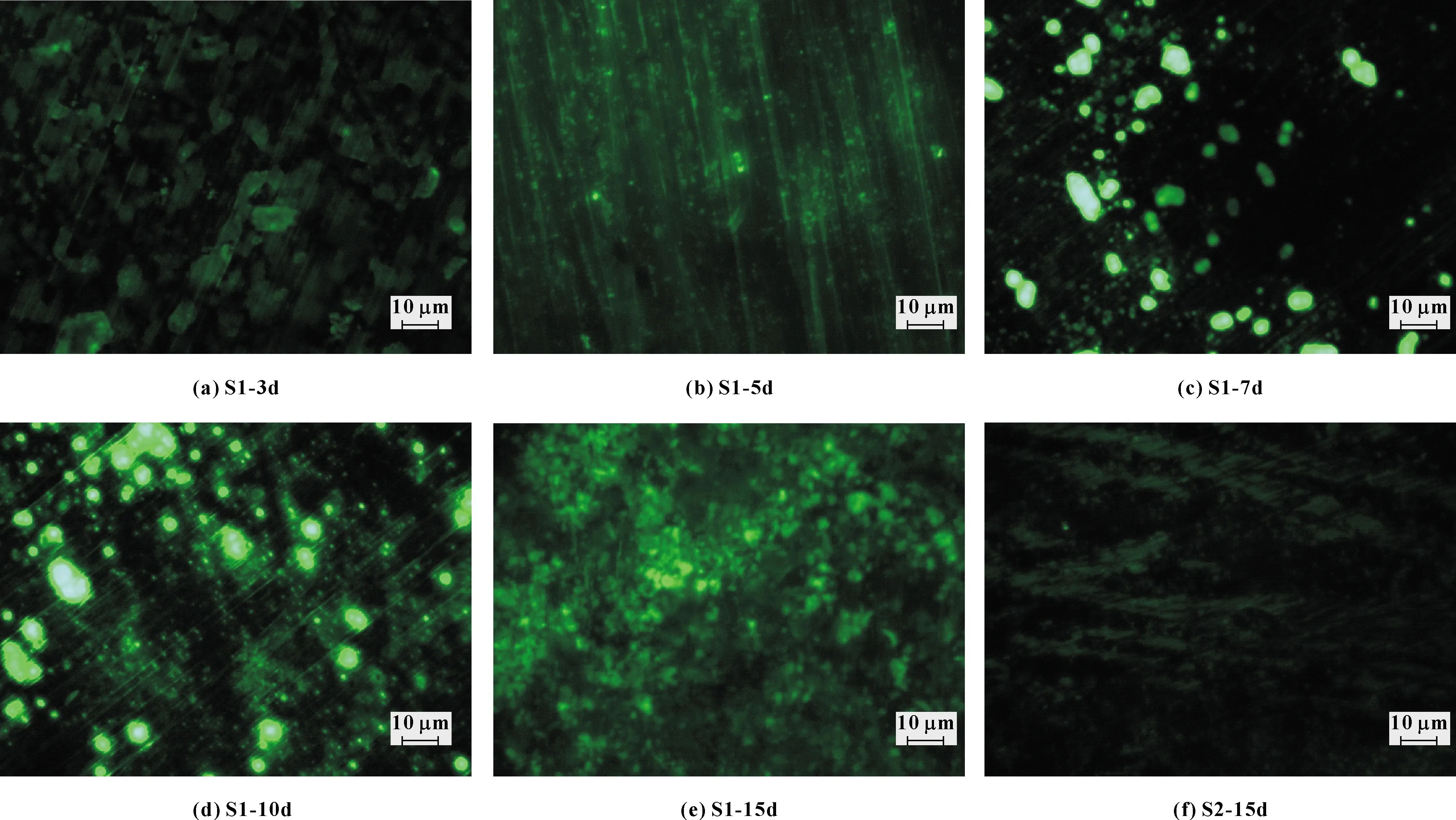
图4 铝合金2219在不同切削液中浸泡不同时间的微生物附着情况
图5所示为去除铝合金2219表面腐蚀产物后的表面轮廓图。可以看出,浸泡在含有多种微生物的切削废液中15 d后,铝合金表面点蚀最为严重,点蚀坑的宽度和深度均较大,最深处达到9.96 μm。浸泡在灭菌切削废液中的铝合金,表面较为平整,没有明显的点蚀出现。说明在多种微生物的协同作用下,铝合金2219腐蚀加剧,点蚀严重,发生点蚀的铝合金工件在后续的服役过程中极易失效,产生严重的后果。

图5 铝合金2219在含微生物切削液和灭菌切削液中浸泡15 d后去除腐蚀产物的表面光学轮廓图及点蚀坑分布统计
2.4 腐蚀产物成分分析
在不同切削液中浸泡15 d后,对铝合金2219表面的腐蚀产物进行能谱分析,结果如图6所示。可知,浸泡在含有多种微生物的切削废液中的铝合金表面含有的C和O元素很高,质量分数分别为20.80%和5.09%,金属元素Al、Mg和Cu元素的质量分数分别为64.36%、1.53%和4.09%。而浸泡在灭菌处理的切削废液中的铝合金表面C和O的含量很少,质量分数分别为4.24%和0.82%,Al元素的质量分数为82.82%,明显高于浸泡在含多种微生物的切削液中的铝合金。同样地,浸泡在含有微生物的切削液中的铝合金表面逐渐被大量微生物附着,并形成生物膜,组成生物膜的胞外分泌物主要由多糖、蛋白质等碳基化合物组成,故铝合金表面检测到较高含量的C和O元素,铝合金基体由于被生物膜覆盖,导致检测到的Al元素含量有所降低。
微生物新陈代谢产物一般由多糖、蛋白质和核酸等聚合物组成,这些聚合物的主要组成元素即为C和O,微生物的新陈代谢活动改变了铝合金表面的界面特征,为腐蚀性介质如O2提供了渗透途径[20-21]。在含有多种微生物的切削废液中,微生物新陈代谢旺盛,导致铝合金的严重腐蚀。正如从图5中观察到的,铝合金2219在劣化的切削液中浸泡15 d后,表面的点蚀最严重。
同样,为进一步确定铝合金表面腐蚀产物的成分,对浸泡15天后的铝合金2219试样进行XRD分析,结果分别如图7所示。XRD结果显示,浸泡在含有微生物的切削液中的铝合金表面Al(OH)3和CuO的峰逐渐增强,说明在微生物作用下,铝合金表面的腐蚀产物主要为Al(OH)3和CuO。

图7 铝合金2219在不同切削液中浸泡15 d后的XRD分析结果
2.5 电化学结果分析
电化学阻抗谱数据能反映电极与溶液之间的法拉第过程(如电极反应)和非法拉第过程(如双电层充放电过程)[22-23]。使用电化学工作站对铝合金电极在2种切削废液环境中浸泡不同时间的电化学阻抗谱进行测试,得到图8所示的测试结果。阻抗谱测试结果用图9中的等效电路图拟合,拟合结果如表2所示。在拟合时,通常用固定相元件(CPE)代替理想电容C来解释非平面界面和传质过程的不均匀性所造成的分散效应,CPE的阻抗用式(2)来表示:
ZCPE=1/Q(jω)n
(2)
式中:j2=-1;ω是角频率(ω=2πf);n是CPE指数(0 n代表偏离纯电容的程度,n=1时,就是纯电容。 从EIS图中确定的电荷转移电阻(Rct)的变化如图10所示。通常,O/W切削液的溶液阻抗(Rs)随着含油量的增加而增大[24-25],文中使用的切削液的电阻值约为110 Ω,与铝合金相应的电荷转移电阻(Rct)相比,可以忽略不计。 图8所示为铝合金在2种不同切削废液中浸泡3、5、10和15 d的电化学阻抗谱结果。从Nyquist图中可以看出,所有曲线都是不完整的半圆,并且在高频区还出现了扩散的现象。引入半有限的韦伯单元(W)来解释,W描述了受非平面界面和非均匀吸附层影响的电子扩散控制过程[21]。图8(a)表明,在含有多种微生物的切削废液中浸泡3 d时,铝合金2219的阻抗弧半径最小,之后出现了先增大后减小的趋势,阻抗弧的特征没有发生明显变化。在浸泡初期,微生物直接附着在合金表面,溶液中的腐蚀性介质及微生物新陈代谢活动直接加速了铝合金的腐蚀;随着浸泡时间的延长,腐蚀产物逐渐在试样表面积累,将切削液中的腐蚀性介质与合金基体隔开,在一定程度上抑制了腐蚀,但是腐蚀产物并不致密,易于脱落,腐蚀性介质通过膜层缝隙进入铝合金基体表面,局部腐蚀加重。在高频相角图中(图见8(c)),相角随时间的增加而增大。这表明电容的增加,可能是由于大分子物质(如胞外分泌物中的多糖和蛋白质)以及腐蚀产物的逐渐覆盖造成的。不均匀生物膜的表面凹坑可能加剧氧浓度电池的局部腐蚀,导致Bode图的波峰变宽变平(见图8(c))。 如图8(b)所示,浸泡在灭菌的切削液中,铝合金的阻抗弧半径随着浸泡时间的延长逐渐增大,并逐步趋于稳定。对应的Bode图中中频处的单峰相角,相对于含多种微生物的切削废液向低频区偏移(见图8(d))。在中频处出现最大相角幅值通常是由于氧化层的形成引起的[26-27]。一般情况下,无微生物的切削废液中金属的腐蚀速率由界面性能、氧转移速率和腐蚀产物膜[24]决定。因此,长期浸泡在灭菌切削废液中的铝合金腐蚀性能变化稳定,说明切削液的黏附所产生的屏蔽作用与导电氧化铝膜的形成所产生的加速作用最终达到平衡。 图8 铝合金2219在2种溶液中浸泡不同时间的阻抗谱 从图8中的Nyquist图可以看出,在低频区出现了韦伯阻抗(W),因此采用R(Q(RW))和R(Q(RW))(QR)分别进行拟合,相应的等效电路图如图9所示。对应的拟合结果示于表2。由拟合结果可以看出,含有多种微生物的切削废液的溶液电阻(Rs)值相对较低,说明铝合金在含多种微生物的切削废液中浸泡一段时间后,切削废液具有更高的电子转移率。铝合金2219在含有多种微生物的切削液中的Rct值随着浸泡时间的延长,逐渐减小,如图10所示。这意味着随着浸泡时间的延长,铝合金的电荷转移电阻逐渐降低,腐蚀速率升高,而且铝合金在含有多种微生物的切削废液中,溶解到切削废液中的金属离子较多,离子电导率就高,从而导致溶液电阻(Rs)较低[28]。而作为对比溶液的灭菌切削废液,溶液电阻最大,Rct值也整体较高,说明在不含微生物的切削液中,铝合金的腐蚀速率较低,溶解在其中的金属离子较少,故溶液的电阻也最大。 图9 铝合金2219在2种切削液中浸泡的电化学等效电路图 表2 铝合金2219在2种切削液中浸泡不同时间的电化学拟合参数 图10 铝合金2219在2种切削液中浸泡不同时间的电荷转移电阻Rct随时间的变化 在属水平上,对切削废液中微生物群落组成和丰度进行分析,结果如图11所示。主要的微生物属由假单胞菌属(Pseudomonas)、芽孢杆菌属(Lysinibacillus和Bacillus)、漫游球菌属(Vagococcus)、棒状杆菌属(Corynebacterium)和肠球菌属(Enterococcus)组成,相对丰度分别为36.64%、13.77%、8.22%、8.15%、11.38%和9.51%。假单胞菌属(Pseudomonas)的相对丰度最高,假单胞菌属细菌是专性好氧的革兰氏阴性菌,在有芽孢杆菌属(Lysinibacillus和Bacillus)氧的条件下进行大量繁殖。假单胞菌能够利用多种碳源、氮源和硫源进行新陈代谢[29-30],广泛降解有机成分[31-32],易导致切削乳化液的劣化。铜绿假单胞菌广泛存在于自然环境中[33],其在材料表面的附着是形成生物膜的前提条件[34-35],会增大低碳钢、不锈钢以及钛合金等多种合金在海洋环境中的腐蚀速率[33,36-38]。芽孢杆菌属(Bacillus)为革兰氏阳性菌,需氧或兼性厌氧。 图11 切削废液在属水平上的微生物群落结构和相对丰度 通常情况下,铝合金表面会产生一层氧化膜,随着浸泡时间的延长,在含微生物的切削液中的铝合金表面逐渐形成一层腐蚀产物膜和生物膜,改变了铝合金表面的膜状态。切削废液中微生物种类繁多,既有好氧菌又有厌氧菌。在浸泡初期,由于好氧菌的存在,溶解氧和有机物保证了好氧菌[6,39]的增殖,导致金属氧化,加速阳极溶解过程,同时获得电子,并将电子转移给溶液中的O2,金属元素的氧化过程既发生在铝合金的表面也发生在好氧菌的生物膜中。随着浸泡时间的延长,好氧菌逐渐将生物膜下的O2耗尽,降低了膜层下表面的O2浓度,从而促进了切削废液中厌氧菌的繁殖,并逐渐形成生物膜,厌氧菌的生物膜特性,使微生物代谢活动产生的有机酸(含H+)被保存在生物膜底部,加剧铝合金的局部腐蚀,导致点蚀严重[20]。 (1)铝合金2219在含有微生物的切削废液中的腐蚀速率为0.78 mg/(m2·d),而在灭菌的切削废液中,腐蚀速率仅为0.49 mg/(m2·d),微生物的存在使2219铝合金的腐蚀速率增大了59%,明显加速了铝合金的腐蚀。 (2)切削废液中的微生物会附着在2219铝合金表面,形成不均匀的腐蚀产物膜和生物膜,导致铝合金腐蚀加剧,而且腐蚀以点蚀为主。 (3)在含有多种微生物的切削液中,铝合金的电荷转移电阻逐渐减低,腐蚀速率显著提高,即切削液中微生物的存在明显加速了铝合金的腐蚀。



2.6 腐蚀机制分析

3 结论
