无明显致病因素的真菌性食管炎患者炎症及免疫学指标水平及内镜下表现
2022-05-18焦文云曹新广张婧文刘靓郭长青
焦文云,曹新广,张婧文,刘靓,郭长青
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
真菌性食管炎,是食管黏膜受真菌侵入后出现的一种炎症性疾病。其常见致病菌种类为念珠菌类,其中最常见的为白念珠菌,其次为光滑念珠菌、热带念珠菌和克鲁塞念珠菌[1],此外非念珠菌属的毛霉菌、曲霉菌、组织胞浆菌、隐球菌等也可导致真菌性食管炎的发生[2-4]。真菌无处不在,皮肤表面、消化道、尿道、外阴等部位均可分离出,但研究表明以消化道尤其以食管内带菌率最高,约占50%[5]。作为一种条件致病菌,真菌通常对健康人群不致病,但在某些条件下易诱发真菌感染[6],如滥用广谱抗生素、大量应用糖皮质激素、肿瘤患者放化疗后、长期慢性疾病、艾滋病等先天或后天免疫功能低下等。在临床工作中发现有部分真菌性食管炎患者无明显致病因素,然而在查胃镜时发现患有真菌性食管炎,针对这些患者仍考虑存在不明原因的免疫功能低下。为此,本文将对确诊的无明显致病因素的93例真菌性食管炎患者的血常规、炎症及免疫学相关指标及内镜下表现等临床资料进行分析,以期提高对其诊疗的认识。
1 资料与方法
1.1 研究对象
1.1.1 病例组 回顾性分析2019年1月至2021年1月在郑州大学第一附属医院消化内镜中心检查且满足纳入排除标准的93例无明显致病因素的真菌性食管炎患者的临床特征及消化内镜下表现。(1)纳入标准:①无明显致病因素(如糖尿病等基础疾病及免疫功能低下相关疾病);②完成胃镜、血常规、相关炎症指标、外周血T淋巴细胞细胞亚群检查检验;③符合Kodsi内镜下真菌性食管炎表现[7];④经食管灌洗液刷检发现真菌菌丝及(或)孢子。(2)排除标准:①患糖尿病、恶性肿瘤、先天性或获得性免疫功能低下相关疾病等;②存在心、肺、肝、肾等功能不全;③近1个月内感染过其他病毒、细菌或真菌等病原微生物;④近1个月内使用过质子泵抑制剂(proton-pump inhibitor,PPI)类、抗生素类、糖皮质激素类、化疗药物类或白细胞集落刺激因子类等药物;⑤病例资料不完善或丢失。
1.1.2对照组 随机选取同时期满足上述纳入标准①②③及排除标准的108例健康体检者为对照组。
1.2 观察指标对照组和病例组的血常规相关指标、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(plateletto-lymphocyte ratio,PLR)、单核细胞与淋巴细胞比值(monocyte-to-lymphocyte ratio,MLR)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、外周血淋巴细胞亚群CD3+、CD4+、CD8+T淋巴细胞计数、CD4+/CD8+等相关指标及消化内镜下表现。
1.3 诊断方法病理诊断是真菌性食管炎确诊的“金标准”。本研究中仅少部分被检者要求做普通胃镜检查,余均要求行无痛胃镜检查。术前完善心电图、传染病等相关检查并做好术前评估,同时经患者及家属同意并签署内镜相关检查知情同意书。所有被检者均由消化内镜中心经验丰富的内镜医生完成,通过白光胃镜进行观察,对于食管黏膜表面附着白色绒毛样渗出物者或可疑患者,注水冲洗留取食管灌洗液刷检或进行局部组织活检制成10 g·L-1的氢氧化钾压片光镜下直接观察,当在光镜下发现真菌样孢子或菌丝即可认为阳性[8]。依据Kodsi内镜下分级评估标准[7]将真菌性食管炎分为Ⅰ~Ⅳ级:Ⅰ级,即内镜下见直径<2 mm的散在隆起白色附着物,局部充血可见,无水肿或溃疡;Ⅱ级,即内镜下见直径>2 mm的多个隆起白斑,可有局部充血;Ⅲ级,即内镜下见融合呈片状或条状的黄白色附着物,伴黏膜充血和溃疡形成;Ⅳ级,即Ⅲ级基础上加黏膜质脆,病情严重时可出现管腔狭窄。
1.4 统计学方法所有数据均采用SPSS 21.0统计软件进行分析处理。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本的t检验,不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;计数资料以频数(n)及构成比(%)表示,组间比较采用χ2检验;通过单因素和多因素logistic回归分析筛选出差异有统计学意义的指标,绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析相关指标对无明显致病因素的真菌性食管炎的诊断预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料无明显致病因素的93例真菌性食管炎患者中男54例(58.06%),女39例(41.94%),男女比例1.44∶1,年龄19~75(52.10±14.07)岁。108例 健 康 体 检 者 中 男59 例(54.63%),女49 例(45.37%),年龄24~71(52.17±12.38)岁。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
2.2 消化内镜下表现93例无明显致病因素的真菌性食管炎患者内镜下可见食管黏膜散在或密集分布的片状、斑状、点状乳白色或灰白色豆腐渣样或颗粒状附着物,用流动水不易冲洗,较大者可融合成斑片状或结节状。受累部位黏膜可表现为不同程度的局部充血、糜烂,病情严重者伴周围黏膜水肿、糜烂或溃破,甚者可出现管腔狭窄,见图1。病例组93例病例真菌性食管炎分级,其中Ⅰ级27例(29.03%),Ⅱ级52例(55.92%),Ⅲ级14例(15.05%),Ⅳ级0例。其中病变累及范围中,食管全段39例(41.94%),食管上段30例(32.26%),食管中段5例(5.38%),食管下段10例(10.75%),食管中上段4例(4.29%),食管中下段5例(5.38%)。合并消化道病变中,慢性浅表性胃炎29例(31.18%),糜烂性胃炎39例(41.94%),萎缩性胃炎10例(10.75%),胆汁反流性胃炎5例(5.38%),胃多发息肉24例(25.81%),胃溃疡11例(11.83%),反流性食管炎6例(6.45%),十二指肠球炎3例(3.23%)。

图1 真菌性食管炎内镜下表现
2.3 炎症及免疫学相关指标两组白细胞计数(white blood count,WBC)、淋巴细胞绝对值(lymphocyte absolute,LYM)、ESR、NLR、PLR、MLR及CD3+、CD4+、CD8+T淋巴细胞计数、CD4+/CD8+比较,差异有统计学意义(P<0.05),中性粒细胞绝对值(neutrophil absolute,ANC)、单核细胞绝对值(monocyte absolute,MO)、血小板计数(platelet count,PLT)比较,差异无统计学意义(P>0.05)。见表1。

表1 两组炎症及免疫功能相关指标比较
2.4 多因素logistic回归分析单因素logistic回归分析结果显示,WBC、LYM、ESR、NLR、PLR、CD4+/CD8+是无明显致病因素真菌性食管炎的危险因素,在此基础上进行多因素logistic回归分析,结果显示,WBC、PLR、CD4+/CD8+是其独立危险因素(P<0.05)。见表2。
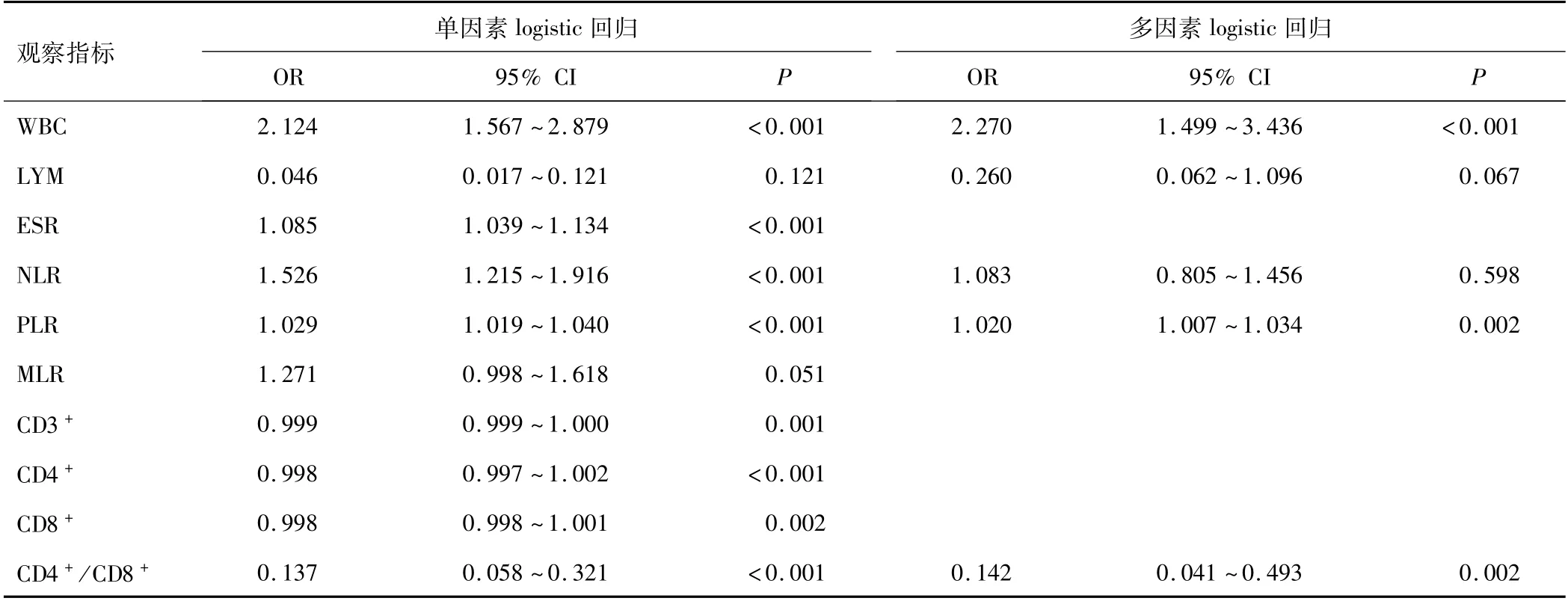
表2 组间存在差异指标的logistic回归分析
2.5 WBC、PLR、CD4+/CD8+的诊断效能分析WBC、PLR、CD4+/CD8+对无明显致病因素真菌性食管炎的诊断效能ROC曲线,发现单项指标均具有一定的诊断预测价值。将上述指标进行组合分析,结果显示3项指标联合时的诊断效能最高,对应的曲线下面积(area under curve,AUC)为0.892,灵敏度为98.1%,特异度为68.8%。见表3和图2。

表3 WBC、PLR、CD4+/CD8+对无明显致病因素真菌性食管炎的诊断效能分析

图2 联合指标预测患无明显致病因素的真菌性食管炎的ROC曲线
3 讨论
健康人群消化道内的黏膜屏障、微生物屏障及消化道分泌的酶和防御素等构成的非特异性防御系统与机体产生的细胞因子、补体、吞噬细胞、抗微生物肽等构成的特异性防御系统均可抑制真菌等病原微生物的过度生长[9-10]。当机体防御能力降低时,易引发真菌性食管炎的发生,如:糖尿病、恶性肿瘤、肝硬化、尿毒症、艾滋病等均可造成机体免疫功能下降甚至免疫缺陷;糖皮质激素、化疗药物等可通过抑制机体免疫过程的诸多环节而导致机体防御能力的降低;阿司匹林等非甾体抗炎药可通过削弱黏膜的防御和修复功能致使食管黏膜屏障受损;长期滥用广谱抗生素、PPI、H2受体阻滞剂等可破坏消化道微生物屏障致使菌群失调[2];任何导致食管黏膜屏障作用削弱及机体免疫能力下降的因素,都将增加真菌性食管炎的发病概率。
内镜下真菌性食管炎多表现为病变黏膜散在或片状的乳白色或灰白色豆腐渣样或颗粒状附着物,用流动水不易冲洗,较大者可融合成斑片状或结节状,白色附着物下方可见黏膜不同程度的充血、糜烂,病情严重者可见黏膜大片溃疡,伴周围黏膜水肿、糜烂、溃疡,甚者可见食管内充填大量豆渣样附着物而造成管腔狭窄。按Kodsi分级评定标准,本研究93例无明显致病因素的真菌性食管炎患者中,内镜下表现以KodsiⅠ、Ⅱ级多见,这与虎金朋等[5]、孔令亭等[11]研究结果一致。其中食管全段、食管上段为好发部位,而既往文献报道食管全段、食管下段是其好发部位[5],故目前关于真菌性食管炎的好发部位尚无统一结论,今后有待大样本、多中心、前瞻性研究来进一步证实。
机体感染念珠菌等真菌后,病原菌通过刺激食管黏膜引发被感染者体内炎症反应,表现为机体炎症水平的改变,同时通过释放各类炎症因子激活宿主免疫系统,从而引起免疫功能相关指标水平的改变[12-13]。近年来,有研究表明NLR、PLR、MLR可反映机体炎症水平,因检测计算方法简单、快速、经济、易于监测而被广泛研究[14-15]。本研究从真菌性食管炎的发病机制入手,分析其与炎症及免疫功能相关指标间的关系,结果显示WBC、PLR、CD4+/CD8+是真菌性食管炎的独立危险因素。分析WBC、PLR、CD4+/CD8+的诊断效能ROC曲线,发现当3项指标联合时对无明显致病因素真菌性食管炎的诊断效能最高。这一结果提示真菌性食管炎作为一种感染性疾病,炎症反应在疾病发生发展过程中发挥着重要作用;同时被感染者可能存在潜在的免疫功能低下,而淋巴细胞作为特异性免疫应答时的重要免疫细胞,其水平高低可提示患真菌性食管炎的风险,当其水平降低时易导致真菌性食管炎的发生。临床工作中,许多指标可能对真菌性食管炎的辅助诊断均有一定意义,该方向的研究目的是期望在现有临床资料的基础上,用简便、快速且低成本的指标或联合指标来早期发现真菌性食管炎患者,以便临床医生尽早给予预防或干预措施,从而使患者诊疗过程达到最大利益化。消化胃镜检查作为一项有创操作,被检者依从性较差,通过本研究了解到,临床中可首先通过检测WBC、PLR、CD4+/CD8+等相关指标来预估真菌性食管炎发生的可能性。然而,本研究为回顾性研究,样本量小,存在选择偏倚,故今后有待大样本、多中心、前瞻性的研究来加以证实。
综上所述,无明显致病因素的真菌性食管炎内镜下表现以轻症为主,其中食管全段、食管上段为其好发部位,但是,目前关于真菌性食管炎的好发部位尚无统一定论,有待进一步研究。WBC、PLR、CD4+/CD8+是无明显致病因素真菌性食管炎的独立危险因素,对其诊断具有一定的诊断预测效能,当3项指标联合应用时对无明显致病因素的真菌性食管炎有着更高的诊断效能。临床工作中加强对WBC、PLR、CD4+/CD8+等指标或联合指标的监测,对于疾病的早期诊断、及时合理干预治疗、疗效评估等有着重要意义。
