JAK2/STAT3信号通路调控细胞自噬水平对胃癌血管生成的影响机制研究①
2022-05-18管佳佳蚌埠医学院第一附属医院胃肠外科蚌埠233000
朱 冰 管佳佳 傅 军 骆 杰 (蚌埠医学院第一附属医院胃肠外科,蚌埠 233000)
胃癌是常见的消化道恶性肿瘤,其发病率和病死率位居世界第三,约为10%,严重威胁人类生命健康[1]。胃癌细胞的恶性增殖是导致患者死亡的主要原因,但胃癌早期症状不明显,诊断时已进入进展期。胃癌发病机制尚未明确,目前认为是遗传、环境及幽门螺杆菌共同作用的结果。肿瘤的发生、发展过程依赖于血管的生成,新生的血管促进肿瘤的侵袭和转移。在血管生成过程中,需要多种细胞因子共同调节,血管内皮生长因子(vascular endothelial growth factor,VEGF)可以与其受体 VEGF 受体-2 结合,促进血管新生,从而抑制VEGF 表达,可能是抗肿瘤血管生成的重要策略[2-3]。现已证实生长因子及其所携带的刺激信号通过JAK2/STAT3 信号通路传入细胞核,使血管内皮细胞发生增殖、分化和凋亡,从而调控肿瘤的发生发展[4-5]。JAK2/STAT3 信号通路作用非常广泛,在调控氧化应激、细胞自噬、炎症反应及肿瘤等方面均发挥重要作用。目前JAK2/STAT3 信号通路通过调控细胞自噬水平在心肌缺血再灌注损伤、恶性黑素瘤、肺癌以及大肠癌等方面起保护作用,但在胃癌方面的作用鲜有报道[6-9]。
本研究旨在通过JAK2/STAT3 信号通路调控细胞自噬水平,观察对胃癌血管生成的影响机制,为今后临床治疗胃癌提供理论和实验依据。
1 资料与方法
1.1 资料
1.1.1 一般资料 收集蚌埠医学院第一附属医院2019 年1 月至12 月期间80 例胃癌患者的病历资料及手术切除的胃癌组织标本(含对应癌旁组织标本,距肿瘤边缘≥5 cm)。采集的标本保存于液氮。一般临床资料包括患者年龄、性别、吸烟史、饮酒史、肿瘤直径、肿瘤位置、病理分级、淋巴结转移、浸润深度、分化程度等临床信息。纳入标准:①经胃镜和病理检查诊断为胃癌;②无重大疾病或传染病。排除标准:①癌旁组织有明显的炎症细胞浸润;②胃溃疡、胃糜烂者;③其他恶性肿瘤者;④妊娠或哺乳女性。另外选取30例胃镜及病理检查健康者为对照组。所有患者均签署知情同意书,本研究已获得蚌埠医学院第一附属医院伦理委员会批准。
1.1.2 仪器与试剂 人胃癌细胞株BGC-823(中国科学院细胞资源库);靶向JAK2 的miR-375(5'-TGAGACATTAAAGTGAACCGGA-3')、mimic NC(上海吉码制药技术有限公司);JAK2、STAT3 引物(上海生工生物工程有限公司);兔抗人p-JAK2、p-STAT3、LC3、Beclin1、VEGF 单克隆抗体(美国Cell Signal Technology 公司);Trizol RNA 提取试剂盒、LipofectamineTM3000 脂质体、反转录试剂盒(大连宝生物技术有限公司);免疫组化S-P 试剂盒(上海碧云天生物技术有限公司);BCA 蛋白测定试剂盒(南京凯基生物技术有限公司);胎牛血清、RPMI1640培养基、胰蛋白酶(美国Gibco 公司);DYCZ 425D 型双垂直电泳仪(北京六一仪器厂);二氧化碳培养箱(美国Thermo公司);IX51倒置显微镜(日本Olimpus公司)。
1.2 方法
1.2.1 细胞转染及分组 将BGC-823 细胞接种于含10%胎牛血清的RPMI1640培养基中培养,当细胞融合达到80%时胰酶消化传代。以1×105个/孔的密度将细胞接种于6 孔板,采用LipofectamineTM3000 将靶向JAK2 的miR-375 和mimic NC 转染细胞并常规培养。细胞分为3 组:空白对照组(control 组);转染mimic NC 的阴性对照组(si-mimic-NC 组)、转染miR-375的干扰组(si-JAK2组)。
1.2.2 在线生物数据库分析 使用Human Protein Atlas 数据库(https://www. proteinatlas. org/)在线分析JAK2、STAT3在人体各组织和器官中的表达情况以及在正常胃组织和胃癌组织中的表达水平,使用GEPIA 数据库(http://gepia. cancer-pku. cn/)分析JAK2、STAT3表达水平对患者预后生存期的影响。
1.2.3 免疫组化检测胃癌患者p-JAK2、p-STAT3蛋白表达水平 取患者冻存的组织,经固定、包埋等步骤制作成3 µm 石蜡切片。经60 ℃熔蜡、二甲苯脱蜡、梯度乙醇脱水、高压抗原修复后,分别滴加一抗p-JAK2(1∶200)、p-STAT3(1∶200)孵育过夜,二抗(辣根过氧化物酶标记)孵育20 min,DAB 显色液显色,苏木精复染,乙醇梯度脱水、透明、封片,镜检(×200)。染色结果判定:随机选取5个视野,根据染色面积及强度进行评分。染色面积:0 分为<5%,1分为5%~25%,2分为26%~50%,3分为51%~100%。染色强度:未染色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分。染色总分=染色面积×染色强度,总分≥3分为高表达,<3分为低表达。
1.2.4 qRT-PCR检测各组细胞JAK2、STAT3 mRNA表达水平 取冻存的胃癌组织,采用Trizol 法提取总RNA。反转录成cDNA 进行扩增,GAPDH 为内参。2-ΔΔCt计算 JAK2、STAT3的相对表达水平。JAK2正向引物:5'-TCTGTGGGAGATCTGCAGTG-3',反向引物:5'-TTTCAGAGCTGTCATCCGTG-3',STAT3 正向引物:5'-GACCCGCCAACAAATTAAG-3',反向引物:5'-TGGTGTCCAGTTTACCACGA-3'。
1.2.5 Western blot检测各组细胞p-JAK2、p-STAT3、LC3、Beclin1、VEGF 蛋白表达水平 取冻存的胃癌组织,加入RIPA裂解液,超声匀浆提取总蛋白,BCA蛋白检测试剂盒测定蛋白浓度,进行SDS-PAGE 电泳,湿转至PVDF 膜,用含5%脱脂牛奶TBST 封闭2 h,加入一抗(1∶2 000)4 ℃孵育过夜,加入二抗(1∶10 000)室温孵育2 h,用ECL 化学发光剂进行显影,以GAPDH 为内参校正,Image J 软件进行发光结果的灰度分析。
1.2.6 透射电镜观察各组细胞自噬泡的形成 细胞转染 24 h 后,胰酶消化,以 1×106个/孔接种在 6 孔板,每孔设3个复孔,培养48 h后收集细胞,用4%戊二醛于4 ℃固定,然后进行常规电镜的固定、脱水、包埋,制成超薄切片,H-7500 透射电镜下观察各组细胞的超微结构变化。
1.2.7 Matrigel体外成管实验检测细胞的血管生成能力 取50 µl/孔新鲜配制的Matrigel 基质胶加入96 孔培养板,待 Matrigel 胶凝固,以 1×104个/ml 的密度将各组BGC-823 细胞接种于96 孔板培养48 h,每孔设3 个复孔,倒置显微镜(×100)下观察细胞血管生成情况并记录。
1.3 统计学分析 数据统计采用SPSS16.0 软件,作图工具采用Graphpad 5.0,计数资料采用n(%)表示,两组间比较采用χ2检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 在线生物数据库分析结果 Human Protein Atlas 数据库(图1、图2)显示,JAK2、STAT3 广泛存在于肺、胆囊、淋巴、扁桃体、胃等组织和器官中,与正常组织相比,胃癌组织中JAK2、STAT3 表达明显升高。GEPIA 数据库显示,胃癌组织的JAK2、STAT3 表达水平也明显高于正常组织(图3A、图4A),且JAK2、STAT3 的表达量越高,患者生存期越短(图3B、图4B),差异具有统计学意义(P<0.05),说明JAK2、STAT3的表达在胃癌中具有研究意义。
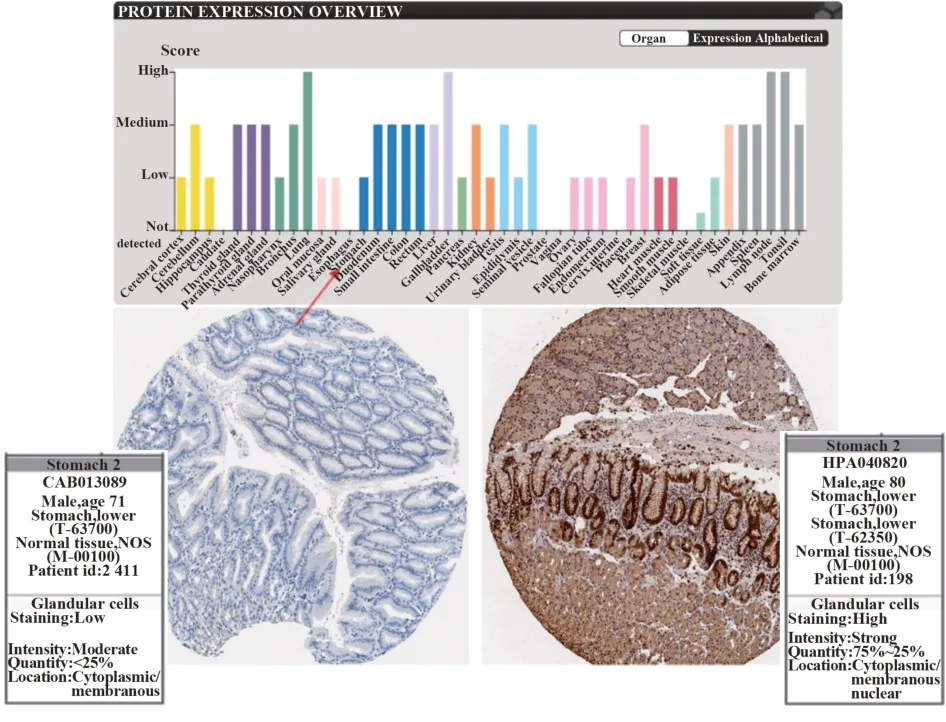
图1 人体中以及正常胃组织和胃癌组织中JAK2表达Fig.1 Expressions of JAK2 in humans,normal gastric tissues and gastric cancer tissues
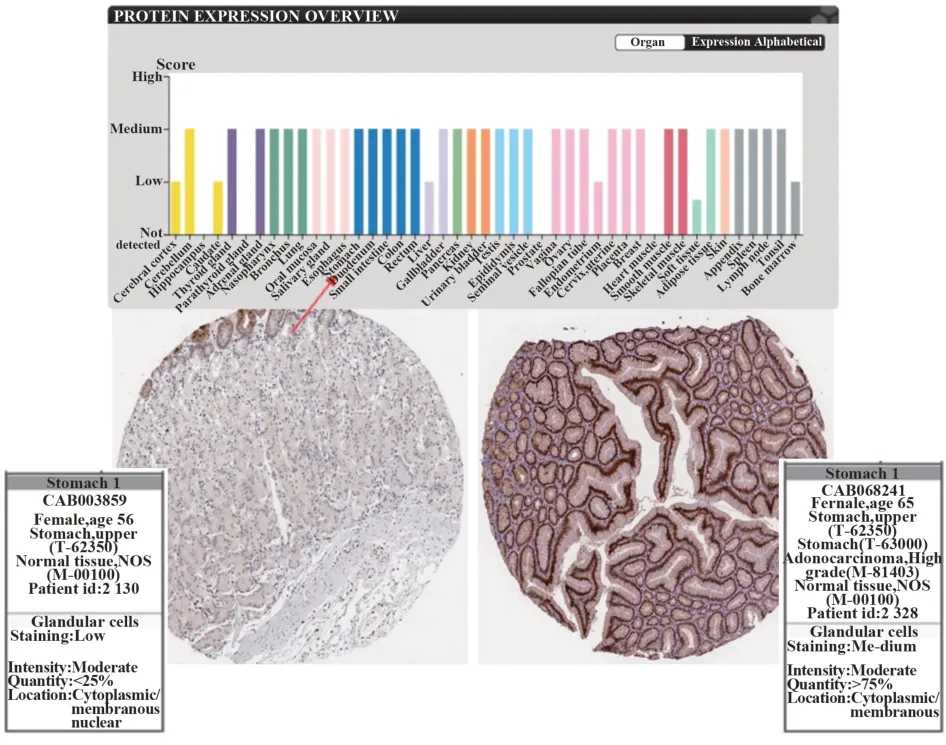
图2 人体及正常胃组织和胃癌组织中STAT3表达Fig.2 Expression of STAT3 in humans,normal gastric tissues and gastric cancer tissues
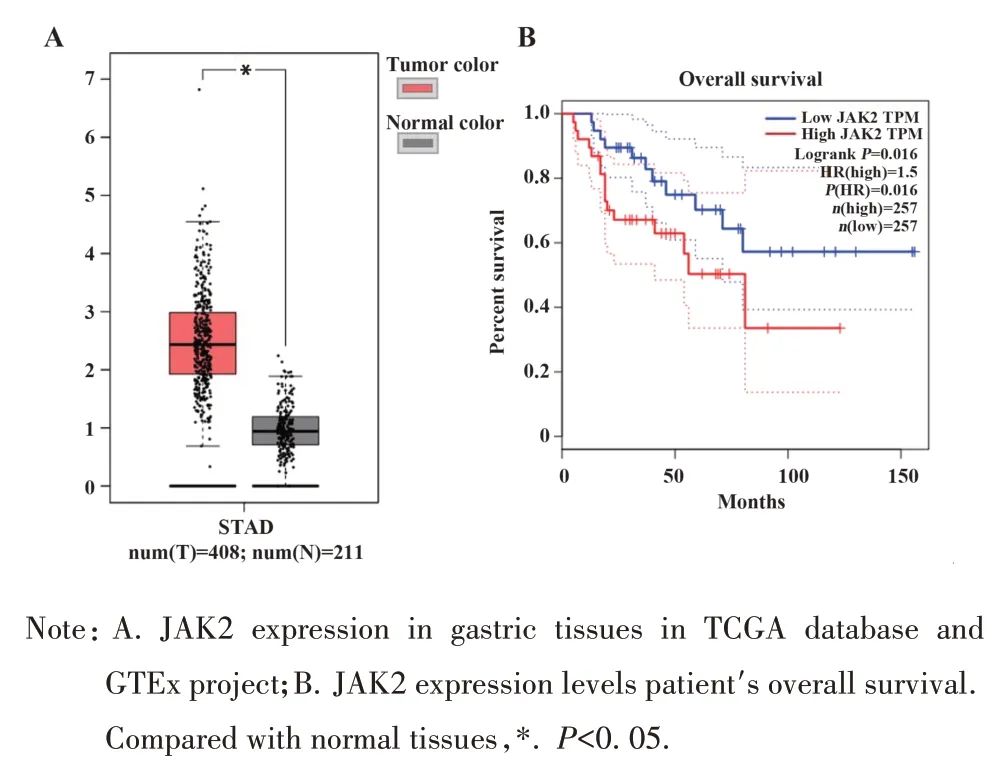
图3 胃癌组织中JAK2表达及其对预后的影响Fig.3 JAK2 expression in gastric cancer tissues and its effect on prognosis
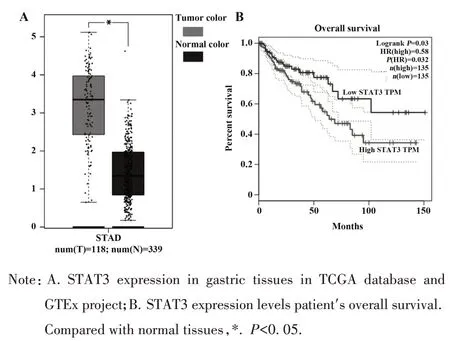
图4 胃癌组织中STAT3表达及其对预后的影响Fig.4 STAT3 expression in gastric cancer tissues and its effect on prognosis
2.2 免疫组化染色检测p-JAK2、p-STAT3的表达免疫组化染色结果显示(图5),p-JAK2、p-STAT3 在肿瘤细胞中阳性表达,呈灶状和弥漫状分布。其阳性表达率显著高于癌旁组织和正常组织。

图5 p-JAK2、p-STAT3在患者正常胃组织、胃癌组织及癌旁组织中的表达(×200)Fig.5 Expressions of p-JAK2 and p-STAT3 in normal gastric tissue,gastric cancer tissue and adjacent tissues of patients(×200)
2.3 p-JAK2、p-STAT3的表达与患者临床病理参数的关系 如表1 所示,为验证p-JAK2、p-STAT3 在胃癌发生发展过程中的作用,将80 例患者按p-JAK2、p-STAT3 相对表达量分为高表达组(p-JAK2:48 例;p-STAT3:52例)、低表达组(p-JAK2:32例;p-STAT3:28 例)。结果显示,p-JAK2、p-STAT3 的表达水平与年龄、性别、吸烟史、饮酒史、肿瘤位置等无明显相关性(P>0.05),而与肿瘤大小、病理分级、淋巴结转移、浸润深度、分化程度有明显的相关性(P<0.05)。p-JAK2、p-STAT3 表达越高,肿瘤越大,浸润深度越严重,分化程度越低,淋巴结越容易发生转移。

表1 胃癌组织中p-JAK2、p-STAT3表达水平与患者临床病理参数的关系分析[例(%)]Tab.1 Analysis of relationship between expression levels of p-JAK2 and p-STAT3 in gastric cancer tissues and clinical pathological parameters of patients[n(%)]
2.4 qRT-PCR检测细胞JAK2、STAT3 mRNA表达qRT-PCR结果显示(图6),与control组和si-mimic-NC组相比,si-JAK2 组的 JAK2、STAT3 表达水平明显降低,差异具有统计学意义(P<0.05),而control 组和si-mimic-NC组JAK2、STAT3表达水平无显著性变化(P>0.05)。

图6 JAK2、STAT3 mRNA在各组细胞中的表达Fig.6 JAK2,STAT3 mRNA expressions in each group of cells
2.5 Western blot 检测细胞 p-JAK2、p-STAT3、LC3、Beclin1、VEGF的表达 Western blot结果显示(图7),与 control 组和 si-mimic-NC 组相比,si-JAK2 组细胞中 p-JAK2、p-STAT3、VEGF 表达水平明显下降,LC3、Beclin1表达水平明显升高,差异均具有统计意义(P<0.05),而control组和si-mimic-NC组细胞各蛋白表达水平差异无统计学意义(P>0.05)。
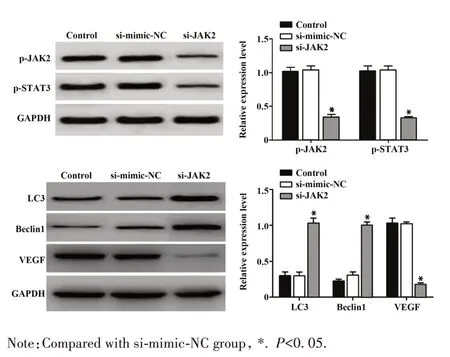
图7 Western blot 检测 p-JAK2、p-STAT3、LC3、Beclin1、VEGF蛋白表达水平Fig.7 Western blot detection of p-JAK2,p-STAT3,LC3,Beclin1 and VEGF protein expression levels
2.6 透射电镜观察各组细胞自噬泡的形成 透射电镜结果显示(图 8),control 组和 si-mimic-NC 组细胞内细胞核、线粒体等结构形态正常,细胞质内几乎未见自噬体或自噬泡形成;而si-JAK2 组出现自噬体,内含降解成分。
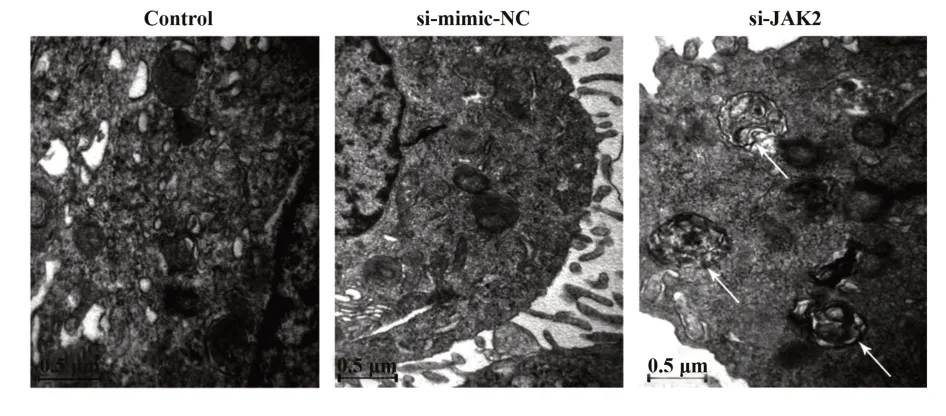
图8 透射电镜观察各组细胞自噬泡形成(×10 000)Fig.8 Transmission electron microscope observation of formation of autophagic vesicles in each group(×10 000)
2.7 Matrigel 体外成管实验检测细胞的血管生成能力 小管形成实验结果显示(图9),与control 组和si-mimic-NC 组相比,si-JAK2 组细胞小管生成数量明显下降(P<0.05),而control组和si-mimic-NC组细胞小管形成数目差异无统计学意义(P>0.05)。

图9 Matrigel体外成管实验检测细胞的血管生成能力Fig.9 Matrigel in vitro tube formation experiment to detect angiogenesis ability of cells
3 讨论
胃癌是世界上常见的恶性肿瘤,其发病率位列第四,致死率位列第二[10]。尽管外科手术、化疗、放疗等治疗手段快速发展,但由于胃癌缺乏特异性症状易错过最佳治疗时间和癌细胞的转移性等,使得胃癌患者五年生存率不到30%[11]。因此对胃癌的早期检测和治疗至关重要。肿瘤的复发和转移是胃癌细胞及其微环境相互作用的结果,而细胞自噬和血管生成是适应微环境的适应性反应[12]。在此过程中JAK2/STAT3 信号通路参与其中,JAK2/STAT3信号通路在调控氧化应激、细胞自噬、炎症反应及肿瘤等方面均发挥重要作用。岳彩飞等[13]发现褪黑素可抑制PDGF 诱导的HSC-T6 的活化与增殖,其机制可能与抑制JAK2/STAT3 信号通路有关。齐丽娜等[14]发现JAK2/STAT3 信号通路影响猪卵巢黄体的形成与退化。王丹丹[15]发现柔红霉素通过JAK2/STAT3 信号通路影响细胞自噬途径诱导心肌细胞肥大。本研究将靶向JAK2 的miR-375 转染至BGC-823细胞,通过阻断JAK2/STAT3信号通路观察对胃癌细胞自噬水平及血管生成的影响。
JAK2 是一种非受体型酪氨酸激酶,活化的JAK2能够诱导反向STAT3的磷酸化,游离的p-STAT3形成二聚体并进入细胞核,进而调控反向靶基因的表达[16]。在恶性肿瘤中,持续的生长信号导致STAT3 处于持续活化状态。本研究显示胃癌组织p-JAK2、p-STAT3 的表达水平明显高于癌旁组织和正常胃组织,p-JAK2、p-STAT3表达越高,肿瘤越大,浸润深度越严重,分化程度越低,淋巴结越容易发生转移。当转染BGC-823 细胞后,与control 组和si-mimic NC组相比,si-JAK2组细胞p-JAK2、p-STAT3表达明显降低。同时Human Protein Atlas 和GEPIA在线数据库也显示胃癌组织JAK2、STAT3的表达水平高于正常组织,且JAK2、STAT3表达越高,预后生存期越短(P<0.05)。提示JAK2/STAT3 信号通路在胃癌中发挥促癌作用。与朱秀敏[17]发现SIRT6通过抑制JAK2/STAT3 信号通路抑制胃癌生长结果一致。
细胞自噬是生物体内高度保守的代谢途径,能够吞噬细胞内受损、衰老以及失去功能的蛋白质,形成自噬泡被溶酶体水解。自噬过程需要多个自噬调节蛋白参与。Beclin-1 基因(也称BECN1 基因),与自噬相关基因ATG6/vps30同源,可以诱导其他自噬相关蛋白定位于自噬泡上,是诱导细胞发生自噬的关键基因,可抑制肿瘤的形成与生长。王颖[18]发现胃癌组织中Beclin-1 表达量明显低于癌旁组织,在淋巴结转移患者中表达量低于淋巴结未转移患者。武冰洁等[19]发现胃癌细胞中Beclin-1 阳性表达率低于非胃癌组织,Ⅲ、Ⅳ期的表达率低于Ⅰ、Ⅱ期。本研究发现与control 组和si-mimic NC 组相比,si-JAK2 组细胞Beclin-1 表达明显升高。提示Beclin-1 低表达与胃癌关系密切,且对胃癌的进展起调控作用。LC3 是自噬体膜蛋白,可作为检测自噬活动的标志物,没有自噬发生时,以LC3-Ⅰ形式存在,当发生自噬后,LC3-Ⅰ经泛素化修饰形成LC3-Ⅱ,从而启动自噬。因此常用LC3 或LC3-Ⅱ水平检测自噬情况。宋华勇等[20]和罗小月等[21]研究发现胃癌组织中LC3 阳性表达率明显低于癌旁组织,且与胃癌发展程度相关。本研究发现与control组和 si-mimic NC 组相比,si-JAK2 组细胞 LC3 表达明显升高,提示LC3 与胃癌发展程度相关。本研究透射电镜观察到control 组和si-mimic-NC 组细胞内几乎未见自噬体或自噬泡形成;而si-JAK2 组细胞出现自噬体。提示JAK2/STAT3 信号通路的阻断促进了细胞自噬水平。
肿瘤的生长和发展伴随着大量微血管的生成,新生血管不仅为肿瘤细胞输送营养、排泄代谢废物,而且还能促进其转移。VEGF 能够促进肿瘤微血管形成,是促进血管生长因子里面作用最强的,当与VEGFR1 和VEGFR2 受体结合后,能使血管迅速生长。本研究发现与control 组和si-mimic NC 组相比,si-JAK2 组细胞VEGF 表达、小管生成数量明显下降,与董峰等[22]研究结果一致。
综上所述,本研究探讨JAK2、STAT3 在胃癌中的表达及临床意义,证实了JAK2、STAT3 在胃癌中高表达且发挥促癌作用,并且与胃癌患者的不良预后紧密相关,其可能是JAK2/STAT3 信号通路抑制了细胞自噬且增加了血管形成能力,对胃癌患者的预后具有指导意义。
