二至丸对绝经后骨质疏松模型大鼠脂肪组织糖代谢影响
2022-05-18韩龙谭登万仕炜方彭华黄桂成闵文
韩龙,谭登,万仕炜,方彭华,黄桂成,闵文
(南京中医药大学第一临床医学院,江苏 南京 210023)
绝经后骨质疏松症属中医“骨痿”范畴,最新《绝经后骨质疏松症(骨痿)中医药诊疗指南》概括其有3个基本证型,分别是脾肾阳虚证、肝肾阴虚证和肾虚血瘀证,且临床以肝肾阴虚型最为多见[1]。二至丸作为平补肝肾之阴的经典方剂,应用范围较广,临床疗效好[2]。近年来大量研究显示,二至丸能通过降低绝经后骨质疏松症骨组织中RANKL/OPG比率,抑制骨质流失,增强骨强度,促进骨重建,改善骨质疏松[3-6]。
骨组织代谢与脂肪组织代谢水平关系密切,脂肪组织分泌脂肪因子如瘦素、脂联素、趋化素等,调节骨稳态[7-8]。另外,体脂含量与骨量成负相关,脂肪组织代谢紊乱能通过激活NF-κB/RANKL炎症信号通路增强破骨细胞活性,加快骨吸收过程,从而引起机体骨量减少[9-10]。
前期研究表明,二至丸能够改善绝经后骨质疏松骨重建过程,而其对骨重建影响是否与脂肪组织糖代谢有关尚不清楚。因此,本研究探讨二至丸对绝经后骨质疏松大鼠脂肪组织糖代谢影响及机制。
1 材料与方法
1.1 动物
SPF级雌性SD大鼠56只,6~8月龄,体质量300~360 g,购自南京市江宁区青龙山动物繁殖场,动物许可证号:SCXK(苏)2017-0001。动物饲养于南京中医药大学动物实验中心,饲养温度20~22 ℃,自由进食、饮水。实验经南京中医药大学伦理委员会批准,批准号:201910A024。
1.2 药物与制备
取500 g女贞子(四川绵阳市,批号:18121111),将其粉碎成粗粉状,采用10倍量70%乙醇回流提取2次,每次1 h,合并2次提取液,减压浓缩回收乙醇,浓缩至500 mL(即生药1 g·mL-1),-20 ℃储藏备用。取500 g墨旱莲(安徽亳州,批号:190301),采用10倍量水回流提取2次,每次1 h,合并2次提取液,减压浓缩回收水,浓缩至500 mL(即生药1 g·mL-1),-20 ℃储藏备用。临用前取同体积女贞子、墨旱莲粗提液混合均匀,得二至丸粗提液。阿仑膦酸钠片(广东彼迪药业,批号:20180901),规格:每片10 mg,溶解浓度:0.2 g·L-1;氟化钠(罗恩试剂,批号:R015014),规格:25 g,溶解浓度:1 g·L-1。
1.3 仪器与试剂
小动物双能X线仪(MEDIX 90,Medlnk),实时定量PCR分析仪(Applied Biosystems 7500,ABI),凝胶成像系统(ImageQuant LAS 4000mini,Cytiva),电子天平(ATY124,岛津),Western blot电泳槽(VE-180,天能),多功能酶标仪(Enspire,PerkinElmer),高速冷冻离心机(Centrifuge 5430R,Eppendorf)。
大鼠胰岛素ELISA试剂盒(上海酶联,批号:12/2019),RIPA裂解液(北京康为世纪,批号:CW2333S),BCA蛋白浓度测定试剂盒(碧云天,批号:P0010),RNA逆转录试剂盒(南京诺唯赞,批号:R223-01),PCR扩增试剂盒(上海翊圣,批号:11202ES08),SDS-PAGE凝胶配制试剂盒(碧云天,批号:P0012A),PVDF膜(Immobilon-PSQ,批号:R9DA19786),Glut4一抗(Proteintech,批号:66846-1-Ig),PGC-1α一抗(Proteintech,批号:66369-1-Ig),Sirt1一抗(Proteintech,批号:13161-1-AP),α-Tublin一抗(Proteintech,批号:11224-1-AP)。引物由上海捷瑞生物工程有限公司合成,序列见表1。

表1 引物序列Table 1 Primer sequences
1.4 模型制备及干预方法
56只大鼠适应性饲养1周后,按随机数字表法将其分为假手术组(n=16)和手术组(n=40)。采用20%乌拉坦按照5 mL·kg-1腹腔注射麻醉大鼠,麻醉完全后,用碘伏擦拭皮肤消毒。于肋弓下2横指,脊柱旁开1 cm处备毛,之后用手术剪在备毛处切开皮肤,切口长约1.5 cm。切开肌层,用镊子夹起白色脂肪团,观察到菜花样即为卵巢组织。轻轻将卵巢捏起,用眼科镊分离出卵巢,用细线结扎输卵管和血管,切除卵巢,对侧处理相同,然后小心逐层缝合。将假手术组大鼠切除与卵巢大小相仿的一块脂肪,其余处理同手术组。造模结束后,各组大鼠均腹腔注射青霉素钠,每日5万U,注射3 d。造模8周后,随机抽取手术组与假手术组各8只大鼠,采用双能X线检测其股骨下端及椎体骨密度,以验证造模是否成功。造模成功后,剩余假手术组8只和手术组32只,将手术组剩余大鼠随机分为模型组、阿仑膦酸钠组、氟化钠组、二至丸组,各组均8只。按5 mL·kg-1生理盐水予假手术及模型组灌胃,依据成人与大鼠体表面积比等效剂量折算,二至丸组给予1.6 g·kg-1药物水提液,阿仑膦酸钠组1 mg·kg-1,氟化钠组5 mg·kg-1。灌胃8周,每日1次。
1.5 检测指标和方法
测量各组大鼠体质量,观察其毛发、摄食、活动及精神状态等。给药8周后,各组大鼠禁食12 h,采用20%乌拉坦(5 mL·kg-1)腹腔注射,麻醉所有大鼠。麻醉后,暴露大鼠腹主动脉,使用10 mL负压采血管采血,标记及记录,室温静置1~2 h后,3 500 r·min-1离心15 min,将血清转移至新离心管中,-80 ℃贮存备用。取出大鼠内脏脂肪,称质量后转入离心管中;后剥离出大鼠腰椎,剔除周围肌肉、韧带等,各组织标记后转入-80 ℃冰箱冻存。
1.5.1 骨密度检测 采用双能X线检测假手术组与手术组大鼠骨密度(BMD)。
1.5.2 各组大鼠血糖比较 给药末周,对各组大鼠进行糖耐量试验(GTT)。GTT:禁食12 h后,用三诺血糖仪量取大鼠空腹血糖(FBG)并记录;接着腹腔注射50%葡萄糖溶液(2.5 g·kg-1)并记录时间,随后分别测得15、30、60、120 min时间点血糖值并记录。计算糖耐量曲线面积(AUC):AUC=[(FBG+BG30 min)×15/60+(BG30 min+BG60 min)×15/60+(BG60 min+BG120 min)×30/60]。
1.5.3 ELISA法检测血清胰岛素含量 根据ELISA试剂盒说明书进行检测。
1.5.4 qPCR法检测脂肪Glut4、PGC-1α和Sirt1 mRNA表达 精确称取约0.1 g脂肪组织,加入1 mL Trizol裂解液,按照说明书逐步提取RNA。用酶标板检测所提RNA样品浓度。RNA纯度在1.8~2.1视为所提RNA纯度良好,符合实验要求。取1 μg总RNA,采用两步法逆转录为cDNA,体系为20 μL。实时定量PCR扩增条件:95 ℃ 15 min,95 ℃ 30 s,60 ℃ 35 s,40个循环,以β-actin为内参。扩增结束后,数据以2-ΔΔCt来分析。
1.5.5 Western blot法检测脂肪Glut4、PGC-1α和Sirt1蛋白表达 用分析天平精确称取0.1 g脂肪组织,用眼科剪将组织剪碎后,放入预冷的匀浆器中,按0.1 g·mL-1加入蛋白裂解液,后匀浆30次左右,直至大块组织不见或形成一层薄膜。将所得液体倒入预冷1.5 mL离心管中,剧烈震荡,冰上静置5 min。之后按照12 000 r·min-1离心5 min,吸上清即为脂肪蛋白。采用BCA法测定蛋白浓度。依据蛋白浓度计算煮样浓度,之后在10%分离胶中加入40 μg蛋白样品。待电泳结束,将对应分子量的蛋白条带转移(300 mA,100 min)到PVDF膜上;用脱脂奶粉室温封闭1 h;之后一抗4 ℃过夜,次日孵育二抗1.5 h。待洗涤干净后,通过ECL超敏发光液曝光并且使用Image J软件定量分析。
2 结果
2.1 大鼠一般状态比较
给药前,与假手术组相比,模型组大鼠毛发、饮食饮水、活动及精神状态均无明显差异。给药8周后,与模型组比较,各给药组大鼠毛发、饮食饮水、活动及精神状态均无明显异常。
2.2 给药前后各组大鼠体质量及内脏脂肪质量比较
与假手术组相比,给药前后模型组大鼠体质量均明显增加(P<0.05);与模型组相比,各给药组大鼠体质量均无明显变化(P>0.05)。与给药前相比,给药后各组大鼠体质量均无明显改变(P>0.05)。给药结束后,与假手术组相比,模型组大鼠内脏脂肪质量显著增加(P<0.01);与模型组相比,各给药组大鼠内脏脂肪质量无明显变化(P>0.05)。见图1。
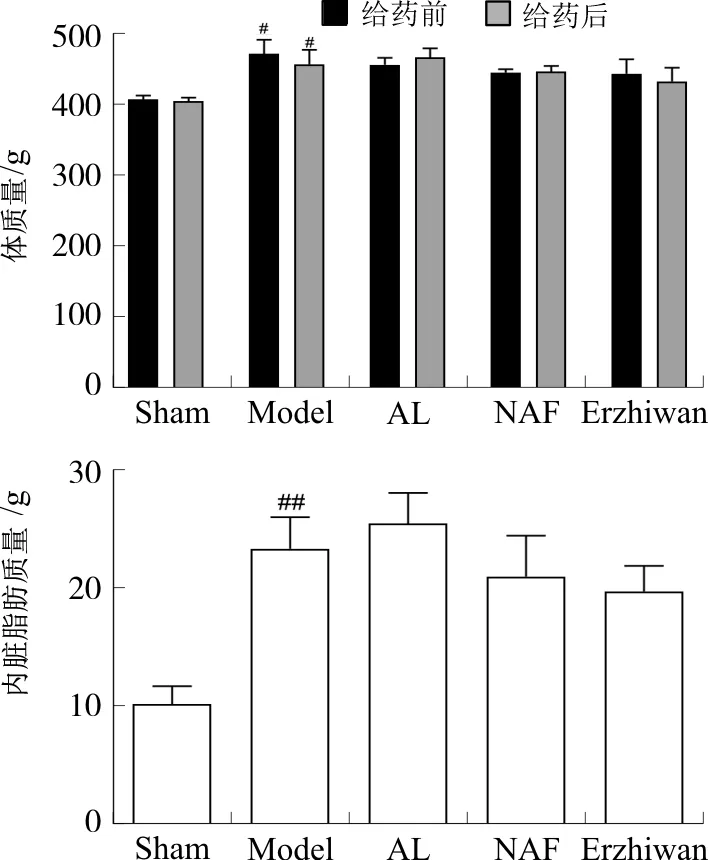
注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,#P<0.05,##P<0.01。
2.3 二至丸对大鼠骨密度的影响
与假手术组相比,模型组大鼠骨密度显著低于假手术组(P<0.01)。与模型组相比,阿仑膦酸钠组、氟化钠组与二至丸组骨密度均显著增加(P<0.01)。见图2。
2.4 二至丸对大鼠FBG、GTT和AUC指数的影响
与假手术组相比,模型组大鼠FBG、AUC指数显著增加(P<0.01)。与模型组相比,各给药组大鼠FBG无明显变化(P>0.05),而阿仑膦酸钠组AUC指数明显减少(P<0.05),氟化钠组和二至丸组AUC指数显著减少(P<0.01)。见图3。
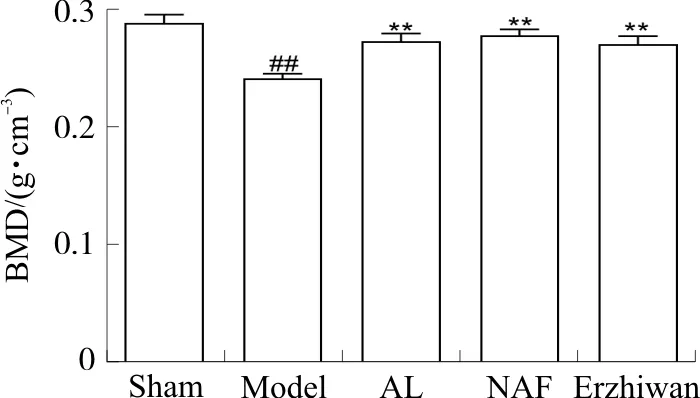
注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,##P<0.01;与模型组相比,**P<0.01。图2 二至丸对大鼠骨密度的影响Fig. 2 Effect of Erzhiwan on bone density in rats

注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。图3 二至丸对大鼠FBG、GTT和AUC指数的影响Fig. 3 Effects of Erzhiwan on FBG, GTT and AUC in rats
2.5 二至丸对大鼠血清胰岛素水平的影响
与假手术组比较,模型组大鼠血清胰岛素水平明显升高(P<0.05)。与模型组比较,氟化钠组血清胰岛素水平显著降低(P<0.01),二至丸组血清胰岛素水平明显降低(P<0.05)。见图4。
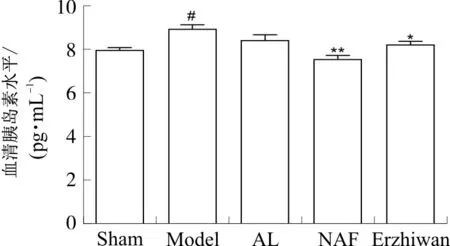
注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,#P<0.05;与模型组相比,*P<0.05,**P<0.01。图4 二至丸对大鼠血清胰岛素水平的影响Fig. 4 Effect of Erzhiwan on serum insulin in rats
2.6 二至丸对大鼠脂肪组织Glut4、PGC-1α、Sirt1 mRNA表达的影响
与假手术组相比,模型组大鼠Glut4、PGC-1α mRNA表达显著减少(P<0.01),Sirt1 mRNA表达明显减少(P<0.05);与模型组相比,二至丸组Glut4、PGC-1α、Sirt1 mRNA表达均显著增加(P<0.01)。见图5。
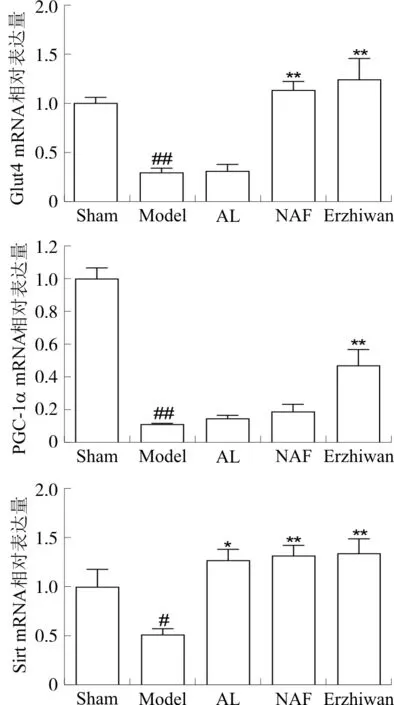
注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。图5 二至丸对大鼠脂肪Glut4、PGC-1α、Sirt1 mRNA表达的影响Fig. 5 Effects of Erzhiwan on mRNA expression of Glut4, PGC-1α and Sirt1 in rat adipose tissue
2.7 二至丸对大鼠脂肪组织Glut4、PGC-1α、Sirt1蛋白表达的影响
与假手术组相比,模型组大鼠脂肪组织Glut4、Sirt1蛋白水平明显减少(P<0.05),PGC-1α蛋白水平显著减少(P<0.01);与模型组相比,二至丸组Glut4、PGC-1α、Sirt1蛋白水平均明显增加(P<0.05)。见图6。
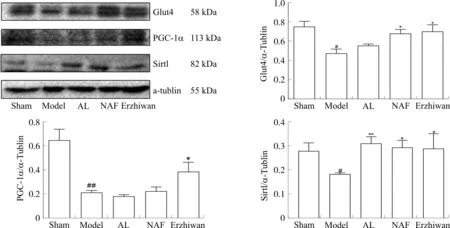
注:Sham.假手术组;Model.模型组;AL.阿仑膦酸钠组;NAF.氟化钠组;Erzhiwan.二至丸组。与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。图6 二至丸对大鼠脂肪组织Glut4、PGC-1α、Sirt1蛋白表达的影响Fig. 6 Effects of Erzhiwan on proteins expression of Glut4, PGC-1α and Sirt1 in rat adipose tissue
3 讨论
脂肪组织代谢紊乱与骨质疏松之间的关系紧密。女性在绝经前后体脂率与骨密度呈正相关,腹部脂肪过多,易引起骨量下降[11]。绝经后妇女常出现骨质疏松同时伴有肥胖发生[12]。二至丸作为平补肝肾的经典方剂,临床常应用于肝肾不足等证。研究发现,二至丸对绝经后骨质疏松骨重建过程有明显改善作用,而其对绝经后骨质疏松干预作用是否与改善机体脂肪糖代谢有关到目前为止尚不清楚。
雌激素能够抑制脂肪合成代谢过程。相反,雌激素缺乏能导致脂肪的过度积累[13]。另外,雌激素缺乏会导致对破骨细胞的抑制减弱,增加破骨细胞的活性及数目,进而加快骨吸收过程[14]。本研究结果与前期研究一致,切除卵巢后的大鼠体质量明显增加,骨密度显著下降[15]。另外,模型大鼠内脏脂肪、血清胰岛素、FBG含量均明显增加,糖耐量水平显著下降,提示模型大鼠体内存在明显的胰岛素抵抗。本研究表明,二至丸能够降低绝经后骨质疏松模型大鼠的高血糖、高胰岛素,增加糖耐量,提示二至丸具有胰岛素增敏效应,降低胰岛素抵抗。
Sirt1、PGC-1α和Glut4是反映脂肪组织葡萄糖摄取和能量代谢的主要指标,其中Sirt1能够激活PGC-1α,促进Glut4表达,导致脂肪细胞葡萄糖摄入增加和线粒体氧化磷酸化水平显著升高,提高机体能量代谢水平。本研究结果显示,绝经后骨质疏松模型大鼠脂肪组织的Glut4、PGC-1α以及Sirt1蛋白及基因表达均显著减少,提示该模型脂肪组织糖代谢显著下降,引起脂肪组织代谢紊乱,可能影响骨代谢过程。通过二至丸干预后,脂肪组织中Sirt1、PGC-1α、Glut4基因和蛋白水平均显著增加,骨密度显著增加,表明二至丸能够通过上调Sirt1、PGC-1α、Glut4水平,提高大鼠脂肪组织糖代谢水平和骨密度。因此,二至丸改善绝经后骨质疏松骨重建过程可能与激活Sirt1/PGC-1α/Glut4、改善绝经后骨质疏松症状态下脂肪组织糖代谢紊乱有关,进一步详细机制仍有待探究。
