构巢曲霉几丁质酶ChiB 的结构分析与重组表达
2022-05-18郭小利金盛宇刘中华
赵 静,郭小利,金盛宇,王 宇,刘中华
(南京师范大学,生命科学学院,江苏省微生物与功能基因组学重点实验室,南京 210000)
0 引言
真菌细胞壁是真菌特有的细胞器,主要由几丁质、葡聚糖和蛋白质等组分组成[1-2]。近年来,侵袭性真菌感染已经严重威胁人类的生命健康,通过抑制或干扰真菌细胞壁的合成过程能够有效地抑制真菌的感染,因此以真菌细胞壁组分或以细胞壁合成相关酶为靶点的抗真菌药物也逐渐成为研究热点[3]。在真菌细胞壁合成的过程中,刚性的细胞壁在细胞壁重构酶的作用下获得可塑性,并在细胞膨压的作用下扩张[4]。本课题组围绕真菌细胞壁的扩张机制开展研究。本课题组在研究中发现,在模式担子菌灰盖鬼伞中,几丁质酶和葡聚糖酶参与细胞壁的重构[5-6]。其中,几丁质酶CcChiE1 通过水解细胞壁中的几丁质参与灰盖鬼伞子实体菌柄伸长生长过程中的细胞壁扩张,在子实体发育过程中起重要作用[5]。
构巢曲霉(Aspergillus nidulans)是丝状模式真菌,也是一种重要的人类条件致病真菌[7-8]。在构巢曲霉的生长发育过程中,几丁质酶是否参与细胞壁重构尚不清楚。本研究分析构巢曲霉中与细胞壁扩张蛋白CcChiE1 同源的几丁质酶,利用生物信息工具分析其结构信息,检测其在构巢曲霉生长过程中的表达量变化规律,利用大肠杆菌(Escherichia coli)重组表达系统并纯化该蛋白,初步分析其酶学性质,以探究其是否有可能通过水解几丁质参与构巢曲霉生长过程中的细胞壁重构,希望能以曲霉细胞壁重构酶为靶点,为抗真菌药物的研发提供新的思路。
1 材料与方法
1.1 质粒及菌株的构建
A.nidulans FGSC A4 菌株用YMM 培养基(酵母提取物5 g,葡萄糖20 g,尿苷1.2 g,尿嘧啶1.1 g,Ribo 1 mL,Trace element 1 mL,固体培养基中加入琼脂20 g,115 ℃灭菌20 min)培养。E.coli DH5α 或Rosetta 菌株使用LB 培养基(酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,固体培养基中加入琼脂15 g,115 ℃灭菌20 min,待其冷却至50 ℃左右时视需要加入Kanamycin 50 mg/L 或Chloromycetin 34 mg/L)。质粒pET28a(+)购自Novagen。
1.2 系统发育进化树构建
在Aspergillus Genome Database 中查找到A.nidulans 中几丁质酶的蛋白序列,从National Center for Biotechnology Information 查找得到灰盖鬼伞几丁质酶ChiE1、ChiIII 的蛋白质序列,利用MEGA5 软件通过邻位相接法构建系统进化树。构巢曲霉几丁质酶的蛋白序列编号分别为:AN11059、AN11063、AN5454、AN0299、AN0509、AnChiB(AN4871)、An-ChiC(AN9390)、AN0221[9-13],灰盖鬼伞几丁质酶蛋白序列登录号分别为:CcChiE1(XP_001841026.2)、CcChiIII(XP_001828436.2)。
1.3 结构鉴定
使用NCBI Conserved domain search (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对A.nidulans 几丁质酶ChiB 的蛋白质结构域分析[14],SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP-4.1/)对AnChiB 的信号肽序列进行预测[15],蛋白的二级结构通过PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测,三维模型结构通过I-TASSER 分析预测,选取得分较高的预测结构并进一步通过TM-alia 进行准确地分析和鉴定。
1.4 实时荧光定量PCR 检测
将A.nidulans 的孢子接种于YMM 液体培养基中培养一定时间,收取培养的菌丝使用液氮进行快速冷冻,用柱式真菌总RNA 快速抽提纯化试剂盒(上海,生工)提取总RNA,用HiScript®II Q RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒(南京,诺唯赞)去除总RNA 的DNA 并进行逆转录,用ChamQTMSYBR®qPCR Master Mix(High ROX Premixed)定量试剂盒(南京,诺唯赞)对cDNA 进行定量扩增。以 A.nidulans 的 actin(AN6542)作为内参基因,利用2-ΔΔCT法获得An-ChiB 在曲霉不同时间点的表达量。
定量PCR 引物为:Q-actin-F:GTATGTGCAAGGCCGGTTTC;Q-actin-R:TCATCACCGACGTAGGAG TCC。Q-ChiB-F:CAGGCCAGAGACTGGCGAAG;QChiB-R:CAAGCCCAGCTGCTTGACG。
1.5 基因的克隆与重组表达
以A.nidulans FGSC A4 的几丁质酶ChiB(Gen-Bank 编号AN4871)的cDNA 序列为模板,委托南京思普金生物公司参照E.coli 的密码子偏好性进行密码子优化和全基因合成。将该序列连接到pET28a(+)的NdeI 和HindIII 酶切位点之间,得到重组表达质粒pET28a(+)-AnChiB。将该质粒转染至E.coli DH5α 感受态细胞中,利用引物AnChiBF/R(AnChiB-F:GCGCGGCAGCCATATGATGAGTGGTTATAAGACCGTTGGTT;AnChiB-R:AGTGCGGCCGCAAGCTT TTAGCTGCTCGGAAAGCCG)对转化子进行验证。挑选阳性克隆培养,并用SanPrep 柱式质粒小量抽提试剂盒(上海,生工)抽提质粒送往南京生工生物公司对质粒进行测序,测序结果与AnChiB 的cDNA 序列进行比对。将测序正确的质粒pET28a(+)-AnChiB 导入原核表达系统的宿主菌E.coli Rosetta(DE3)感受态细胞中,获得重组菌株pET28a(+)-AnChiB/E.coli Rosetta。
重组菌的诱导表达采用乳糖操纵子诱导表达模型,将重组菌株pET28a(+)-AnChiB/E.coli Rosetta 接种至5 mL LB (Kana/Chl)液体培养基中,37 ℃,200 rpm 摇床中培养12 h 后,取1 mL 菌液接种至100 mL LB (Kana/Chl)液体培养基中扩大培养,待菌液的OD600培养至0.8~1.2 时,向菌液中加入终浓度为0.1 mM 的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),37 ℃继续培养48 h 以完成诱导。
离心收集诱导后的菌体用50 mM pH 6.0 的Bis-Tris 缓冲液重悬至20 mL,参照ProteinIsoTM Ni-NTA Resin(北京,TransGen Biotech 公司)的说明书破碎菌体,并利用镍离子亲和层析柱对重组的AnChiB 蛋白进行分离纯化。收集纯化后的酶液,与蛋白上样缓冲液混合后于100 ℃下加热10~15 min,待冷却后进行充分混匀并上样至12%的聚丙烯酰胺凝胶进行电泳[16]。
1.6 水解酶活性测定
以几丁质粉末(chitin powder),胶态几丁质(colloidal chitin),85% 壳聚糖(85% deacetylated chitosan),75%壳聚糖(75% deacetylated chitosan)以及乙二醇几丁质(glycol chitin)、乙二醇壳聚糖(glycol chitosan)、羧甲基纤维素钠(CMC-Na)为底物,检测重组表达酶AnChiB 对不同底物的水解酶活性。200 μL 反应体系中含有0.5%的底物、50 mM pH 5.0 的醋酸钠缓冲液和适量的酶液。反应体系充分混合后37 ℃反应4 h。反应结束后用DNS 法检酶活性[17]。1 个酶活单位(U)定义为:在一定反应条件下,每分钟释放1.0 μmol N-乙酰氨基葡萄糖所需要的酶量。
测定不同pH 对AnChiB 酶活性影响时,反应体系中加入不同pH 的缓冲液进行测定,将酶活最大时的pH 条件下的酶活记为100%,计算不同pH条件下的相对酶活并以百分数表示。
2 结果
2.1 AnChiB 的同源性与蛋白结构分析
本课题组前期的研究成果显示,灰盖鬼伞的几丁质酶ChiE1 和ChiIII 诱导真菌细胞壁扩张,ChiE1 在子实体发育过程中起关键作用[5]。利用MEGA 软件,用邻位相接法构建系统发育进化树,分析构巢曲霉中的8 个几丁质酶与灰盖鬼伞几丁质酶ChiE1、ChiIII 的蛋白质序列的同源关系。An-ChiB 的结构分析结果见图1。结果显示,AnChiB、AN5454 与灰盖鬼伞ChiE1 处于同一分枝,An-ChiB、AN5454 与CcChiE1 亲缘关系较近,见图1(a)。蛋白序列比对分析显示,AnChiB 与CcChiE1的同源性为43.37%(Max Score=400),AN5454与CcChiE1 的同源性为38.22% (Max Score=363)。选择 AnChiB 做进一步分析和研究,AN5454 的研究将另外开展。
AnChiB(AN4871)的蛋白质序列由446 个氨基酸残基组成。使用NCBI Conserved domain search 分析显示,AnChiB 含有一个糖基水解酶家族18 几丁质酶结构域(氨基酸残基55—395,GH18_chitinase domain,cd06548),表明其属于GH18_chitinase 二型(type II)几丁质水解酶[18]。使用SignalP 4.1 Server 分析显示,AnChiB 的N 端第1—18 氨基酸残基为信号肽。由PSIPRED 预测该蛋白的二级结构后显示,AnChiB 的信号肽由α螺旋和少部分的无规则卷曲组成,在整个蛋白结构中,α 螺旋占31.83%(粉色),β 折叠占15.02%(黄色),无规则卷曲占53.14%,见图1(b)。利用I-TASSER 预测AnChiB 的三维结构,结果表明An-ChiB 的蛋白质三维结构为由8 个α-螺旋(α-helice)(蓝色)和8 个β-折叠(β-strand)(红色)组成的(β/α)8TIM 桶状结构,催化位点D164、D166和E168 位于第4 个β-折叠上;在第7 个α-螺旋和β-折叠间存在一个插入序列(黄色),与桶状结构形成一条狭长的底物结合沟,底物结合位点(W43,W83,W95,W128,W238,W372,F260)延底物结合沟分布(C-score=0.23),见图1(c)和图1(d)。
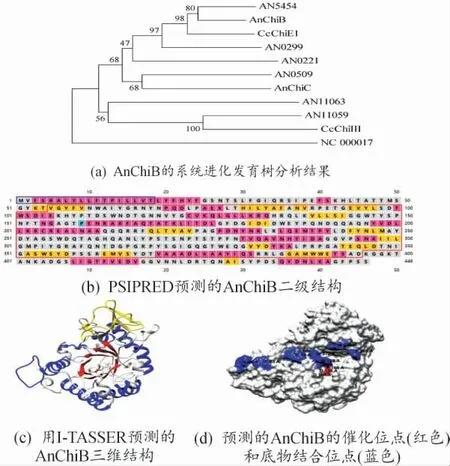
图1 AnChiB 的结构分析结果
2.2 AnChiB 的SDS-PAGE 鉴定及酶活测定
按照前述方法构建得到重组表达菌株pET28a(+)-AnChiB/E.coli Rosetta,经测序验证克隆重组的AnChiB 基因与NCBI 中报道的该基因的cDNA序列完全一致。SDS-PAGE 分析显示,与空载对照菌株相比,诱导表达后重组表达菌株的上清中增加了一条大小约为45 kDa 的蛋白条带。利用镍离子亲和层析柱对粗酶液进行分离纯化后,得到一条大小约为45 kDa 的蛋白条带。纯化后的蛋白浓度为0.88 mg/mL,见图2(a)。图2(a)中:M 表示蛋白Marker;1 代表空载对照上清;2 代表AnChiB重组表达上清;3 代表纯化的酶。
分析AnChiB 对不同底物的水解酶活性,其结果显示,AnChiB 可以水解晶体几丁质、胶态几丁质、乙二醇几丁质和85%脱乙酰化壳聚糖,不能水解75%脱乙酰化壳聚糖、乙二醇壳聚糖和羧甲基纤维素,同时AnChiB 的最适底物是胶态几丁质(表1)。分析AnChiB 的最适pH 值,结果显示在pH 值为5.0 时,AnChiB 的水解酶活性达到最高,偏酸或偏碱都会导致酶活下降,在pH 值为8.0~9.0 的条件下,水解酶活性将会降低至最大酶活的40%以下,见图2(b)。
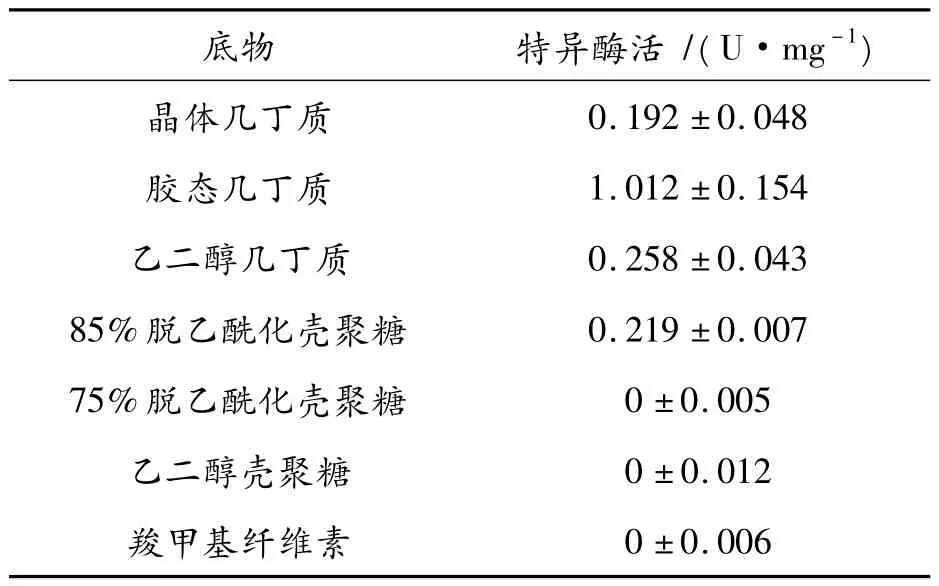
表1 几丁质酶AnChiB 的底物特异性情况
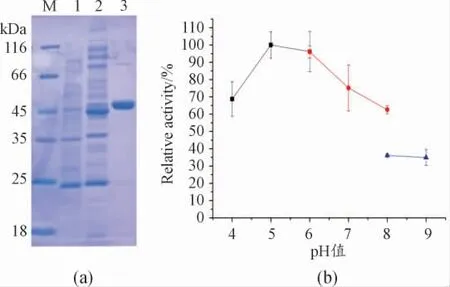
图2 AnChiB 的重组表达纯化及最适pH 分析结果
2.3 AnChiB 在构巢曲霉生长不同阶段的表达量水平
为了分析AnChiB 在构巢曲霉生长不同阶段的表达量情况,分别收集了培养0、6、12、24、48、72和96 h 的菌体,提取RNA,逆转录获得cDNA,利用实时荧光定量PCR 检测AnChiB 在不同样本中的表达量。实验结果显示,在培养6 h 后,AnChiB的表达量明显上升,是0 h 时表达量的4.20 倍,见图3。在第12、24 h,AnChiB 的表达量分别为0 h的2.44 倍和5.56 倍,与6 h 相比无显著差异(图3)。在第48 h,AnChiB 的表达量显著增加,与0 h相比上升34.91 倍,与6 h 相比上升7.54 倍,并达到最高值(图3)。AnChiB 的表达量在72 h和96 h下降,降低到0 h 的3.58 和2.90 倍(图3)。图3中,***表示差异极显著(p<0.001)。
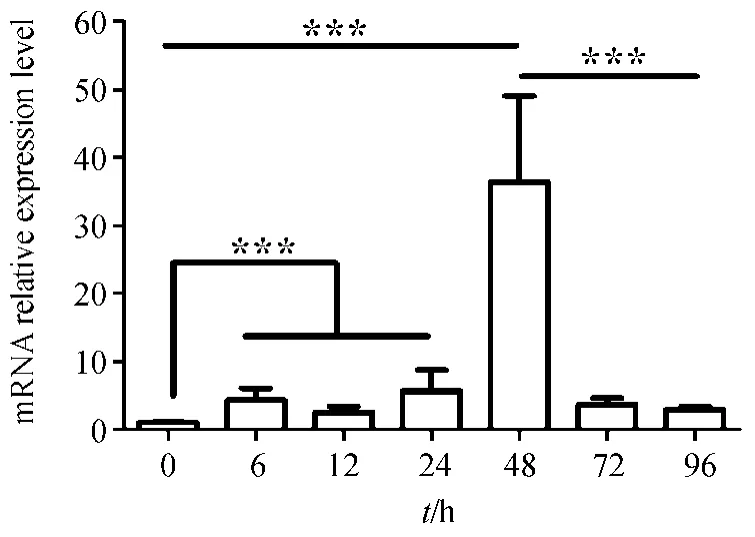
图3 AnChiB 在构巢曲霉生长不同阶段的相对表达量水平
3 讨论
本课题组在前期研究中以担子菌模式生物灰盖鬼伞为研究对象,揭示了几丁质酶在真菌细胞壁扩张过程中起重要作用[5-6]。但在子囊菌中哪个几丁质酶参与细胞壁扩张尚不清楚。故而,本研究以丝状真菌模式生物构巢曲霉为研究对象,通过序列同源性分析和比对,确定在构巢曲霉中几丁质酶ChiB 与灰盖鬼伞细胞壁扩张蛋白几丁质酶ChiE1 的同源度最高。进一步结构分析显示,AnChiB 与CcChiE1 的蛋白质结构具有较高的相似性:首先,2 个几丁质酶都具有N 端信号肽,定位在胞外空间;第二,2 个几丁质酶的三维结构高度相似,都具有一个狭长的底物结合沟。由于具有相似的结构,AnChiB 与灰盖鬼伞细胞壁扩张蛋白几丁质酶ChiE1 也具有相似的酶学性质:①2个几丁质酶都具有水解晶体几丁质的活性,前期研究表明,具有水解晶体几丁质活性的几丁质酶往往具有诱导细胞壁扩张的能力;②2 个几丁质酶的最适pH 值均为5.0,这与真菌生长发育的最适pH 值一致[19]。有文献报道,AnChiB 在构巢曲霉的衰亡期高表达并参与菌丝的自溶[12]。本研究的结果表明:AnChiB 在构巢曲霉的衰亡期(48 h)达到最高;但在构巢曲霉菌丝生长初期(6 h),AnChiB 的表达量即明显上升。AnChiB 可能参与构巢曲霉的菌丝生长,并参与细胞壁的扩张。但由于构巢曲霉的菌丝生长为顶端生长,其生长区域非常微小,需要的细胞壁扩张蛋白较微量,所以,AnChiB 在菌丝生长初期的表达量虽然显著上升,但上升幅度不大[20-21]。
4 结论
构巢曲霉AnChiB 具有真菌细胞壁扩张蛋白的特征:①定位在胞外空间;②具有典型的底物结合沟;③具有水解晶体几丁质的活性等。本研究提示:AnChiB 不仅参与构巢曲霉菌丝的自溶,还可能参与菌丝生长过程中的细胞壁扩张。为进一步研究AnChiB 的生理功能,以及丝状真菌的细胞壁扩张机制提供了数据支持,希望能为以曲霉细胞壁重构酶为靶点的抗真菌药物的研发提供新的思路。
