二乙基亚硝胺诱导斑马鱼肝癌模型的探索与优化
2022-05-18张云罗肖袁媛杨世洲
胡 光,李 丹,陈 阳,张云罗,肖袁媛,杨世洲,周 倩
(重庆理工大学 药物化学与分子药理学重庆市重点实验室,重庆 400054)
0 引言
肝细胞癌(hepatocellular carcinoma,HCC)简称肝癌,为临床常见恶性肿瘤。肝癌是全球癌症相关死亡的首要原因,在我国的肿瘤死亡原因中仅次于肺癌。根据国际癌症研究机构(IARC)发布的全球癌症发病率和死亡率2018 年评估报告显示,2018 年肝癌成为全球第六大最常见的癌症以及第四大癌症死亡的原因,2018 年新增肝癌病例大约为84.1 万例,新增肝癌死亡患者数量高达约78.2 万;同时,在全球大多数地区,男性的肝癌患病率与死亡率相对更高,因此,肝癌在全球癌症病例中排名第五,更在男性死亡数中排名并列第二[1]。根据国家癌症中心肿瘤登记办公室统计的2015 年中国癌症数据,2015 年新发肝癌患者37.0万,肝癌患者死亡数32.6 万,在我国主要恶性肿瘤发病数目和死亡原因中,肝癌分别排在第4 位和第2 位[2]。因此,对肝癌进行更深入的机理研究,以对疾病进行治疗已刻不容缓。
斑马鱼作为继大鼠、小鼠后的世界第三大模式动物,其基因测序已基本完成,正被广泛地应用于各种体内实验的研究。斑马鱼的基因与人类同源性为87%,在遗传水平上与人类有高度相似性;此外,斑马鱼作为一种有脊椎骨的动物,在其消化系统(肝肠组织)和心血管系统等部分的生长发育的机制和人体非常相似[3],因此以斑马鱼为基础建立的疾病模型也能在一定程度上反应人类疾病的相应情况[4]。斑马鱼作为新型的整体实验动物模型,具有体外受精、发育迅速、繁殖能力强,以及适合于实验室饲养等特点;与传统的细胞、大鼠、小鼠模型相比,斑马鱼还兼有体内、体外2 种模型的优点:胚胎及幼鱼期体积很小、鱼体透明,可以在光学显微镜下进行实时检测观察内部器官、组织的变化;成年以后繁殖速度快,短期内能为实验提供大量的样本;给药方式简单、周期短、成本低,适于大规模药物的高通量筛选等。
二乙基亚硝胺(diethylnitrosamine,DEN)是一种常见的癌症诱导剂,其经过DNA 上的微端粒体在体内转化后,可导致诸如核酸、蛋白质等类型的大分子物质被甲基化修饰,从而引起肝细胞损伤甚至坏死;还可以通过刺激肝脏细胞的细胞外基质的合成和分泌的方式,促进肝纤维化的发生与发展,进而促进肝脏肿瘤的形成[5]。除此之外,DEN 水溶性较好且物理化学性质较稳定,适合使用直接浸泡的方式对斑马鱼进行暴露处理[6],这些因素都使得在斑马鱼身上建立肝癌模型的实验目的变得更加的简单、可行。
近年来,斑马鱼在肝脏疾病研究中的应用日益增多:2006 年,Mizgireuv 等[7-8]第一次使用DEN成功诱导了斑马鱼形成肝脏肿瘤;随后,Fujisawa等[9]也选用DEN 诱导并成功构建斑马鱼肝脏肿瘤模型。2008 年,Rekha[10]首次在HCV 转基因斑马鱼体内采用硫代乙酰胺诱导出了肝硬化和肝癌。2011 年,Nguyen 等[11]首次利用米非司酮诱导krasV12 转基因斑马鱼使其发生肝脏肿瘤。到了2012 年,可以在肝脏内特异表达HBX 和HCV 核心蛋白的转基因斑马鱼被Liu 等成功构建,在该模型上可以明显地观察到肝纤维化与胆管细胞癌[12]。
综上所述,采用DEN 诱导斑马鱼肝癌的实验模型建立是可行的,本课题组将通过缩短肝癌发生模型的试验周期、增加肝癌发生的评价方法、完善该模型的评价指标等方式,优化、完善DEN 诱导斑马鱼肝癌的实验方法,建立更加符合高通量筛选的肝癌评价平台,为简单、快速的药物筛选提供研究基础和支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
8 月龄AB 品系野生型斑马鱼(上海费曦生物科技有限公司)。
1.1.2 实验室主要试剂及仪器
斑马鱼养殖系统(南京一树梨花生物科技有限公司),二甲苯(川东化工),DEN(阿达玛斯),中性树胶试剂(麦克林),98%3-乙氧酰基苯胺甲磺酸(阿拉丁),4%多聚甲醛(白鲨生物),光学显微镜(奥林巴斯)。
1.2 实验方法
1.2.1 斑马鱼的饲养条件
斑马鱼在25~28 ℃环境中饲养,采用时间自动控制装置保证每日14 h 光照和10 h 黑暗的循环。
1.2.2 斑马鱼成鱼DEN 处理浓度筛选
初筛采用的诱导剂DEN 的浓度为0、100、150、200 μg/mL,将8 月龄斑马鱼随机分组,以20条/组分别在不同的鱼缸中喂养。实验组暴露于相应梯度浓度的DEN 溶液中,对照组暴露于等量的RO 水中,置于同一环境下饲养,持续观察斑马鱼的生存情况。
1.2.3 肝肠指数检测
肝肠指数的定义为:斑马鱼肝肠湿重量与斑马鱼整体湿重量的比值。将斑马鱼浸入98%的3-乙氧酰基苯胺甲磺酸中麻醉,随即用天平称取斑马鱼的整体湿重量,而后在显微镜下将斑马鱼的肝肠组织分离开,再用天平称量肝肠组织的湿重量,同时进行数据记录,以评价DEN 处理组和对照组斑马鱼在造模期间肝肠脏形态学改变情况。
1.2.4 肝脏石蜡切片的制作
将斑马鱼肝脏用4%的多聚甲醛固定24 h,用PBS 冲洗2~3 次,每次2~3 min。而后,依次采用梯度酒精、二甲苯、65 ℃石蜡2 次浸泡肝脏组织,制备的石蜡标本用石蜡切片机切取5 μm/片的石蜡切片。
1.2.5 HE 染色
石蜡切片以后,将切片用新鲜二甲苯2 次侵泡5 min 脱蜡处理;再用100%乙醇5 min、95%乙醇2 min、80%乙醇2 min、70%乙醇2 min、蒸馏水2 min 进行水化处理;用苏木素浸染35 s,分化液30 s,自来水浸泡15 min,伊红浸染3 min,自来水浸泡2 min;95%乙醇分别2 次冲洗4 s,100%乙醇冲洗4 s,100%乙醇浸泡1 min,新鲜二甲苯2 次浸泡1 min;最后用中性树脂进行封片,显微镜下观察并拍照。
1.2.6 血管新生评价
对各个浓度的斑马鱼进行解剖,而后对其肝脏组织进行外观观察,根据肝脏血管的增生数量以及血管密集程度按照正常、轻度、中度、重度、特重5 个等级评价,并计算各程度的发生率。
2 结果
2.1 诱导剂DEN 浓度的筛选
在浓度筛选过程中,采用50、150、250 μg/mL的DEN 对斑马鱼进行给药处理。实验结果显示,相较于对照组,DEN 浓度为250 μg/mL 时,斑马鱼生存率最低且具有显著性。在DEN 给药处理到第4 周时,250 μg/mL DEN 处理组的斑马鱼已全部死亡。在DEN 诱导9 周后,150 μg/mL 实验组斑马鱼生存率为10%,50 μg/mL 实验组斑马鱼生存率为70%,因此,筛选出DEN 合适浓度范围在0~150 μg/mL,选择150 μg/mL 作为高浓度组、100 μg/mL 作为中浓度组、50 μg/mL 作为低浓度组建模给药浓度。
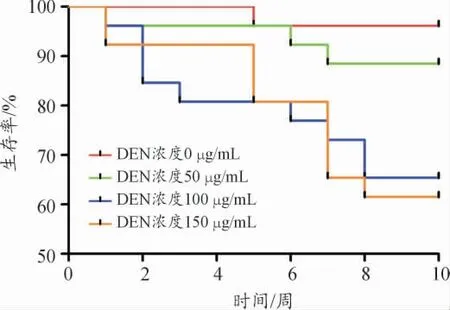
图1 DEN 给药处理10 周期间斑马鱼生存率变化情况
2.2 DEN 诱导肝癌发生的形态学结果
在造模给药9 周后对斑马鱼进行观察记录。整个实验过程,对照组斑马鱼存活正常,DEN 处理的各组斑马鱼部分皆出现脊柱弯曲,腹腔膨大现象(图2);对照组斑马鱼体表干净,边缘清晰;DEN处理的各组实验组斑马鱼体表均出现一定程度的腐烂、黏腻。各组肝脏的形态观察结果显示:解剖后,相较于对照组斑马鱼,DEN 处理组斑马鱼腹腔出现腹水,且肝脏明显膨大,肝脏上有明显点状、球状肿瘤组织出现,胆囊变小且本色绿色变浅;对照组斑马鱼肝脏表面光滑,无结节形成,质地柔软且呈深红色,但经DEN 处理后,肝脏结节数量变多且形态大小不一,能够观察到较为明显的肿瘤生长,肝脏出现高度纤维化趋势,颜色为淡红色或淡黄色(图3)。图3 中,红圈标注区域为斑马鱼的肝肠组织中有代表性变化的部分。与对照组相比,DEN 处理组肝脏血管密集,表面凹凸不平,进一步证实肝脏肿瘤的形成(图4)。

图2 斑马鱼体表观察实物图

图3 斑马鱼肝脏组织表面图

图4 斑马鱼肝肠组织血管生成实物图
2.3 HE 染色结果
从HE 染色的结果(图5)中可以看出,对照组斑马鱼的肝脏组织结构一切正常,肝细胞排列整齐有序且细胞大小均一(图5(a));DEN 处理组斑马鱼肝脏组织结构在不同诱导剂浓度下出现不同程度的破坏,细胞排列紊乱且大小不一,出现中性粒细胞浸润,肝细胞异常分裂,细胞增多,胆管增生,纤维化等现象(图5(b)-5(d))。

图5 对照组斑马鱼肝组织HE 染色观察图
2.4 肝肠指数检测结果
由肝肠指数可知,DEN 试剂会引起斑马鱼肝肠大小的变化。由于斑马鱼本身个体小的因素以及斑马鱼的肝脏包裹肠的特点,因此在实验过程中,将斑马鱼的肝肠同时称重并记录。实验发现,随着DEN 浓度的增加,肝肠指数有逐步增大的趋势。经过统计数据进行显著性差异计算,50 μg/mL 的DEN给药组与对照组相比无显著性差异;100 μg/mL和150 μg/mL 的DEN 都能显著增大斑马鱼的肝肠指数,其中浓度为100 μg/mL 时,P<0.05,浓度为150 μg/mL 时,P<0.01。由此说明,DEN 在0~150 μg/mL 的浓度范围内,能够呈浓度依赖性地诱导斑马鱼肝肠指数升高。建模后各实验组斑马鱼肝肠指数直方图见图6。与对照组(0 μg/mL)相比,100 μg/mL 和150 μg/mL 的DEN 都能显著增大斑马鱼的肝肠指数,其中150 μg/mL 时效果更好。图6中,* 代表P<0.05,**代表P<0.01。

图6 建模后各实验组斑马鱼肝肠指数直方图
2.5 肝脏血管新生检测结果
第10 周后,根据解剖后观察斑马鱼肝脏的血管新生情况并记录实验数据后发现(表1),对照组斑马鱼肝脏的血管未有增多现象,实验组斑马鱼肝脏的血管产生了不同程度的血管增生,且血管新生的严重程度随着诱导剂DEN 的浓度增大而加剧。

表1 斑马鱼肝脏血管新生程度 %
3 讨论
DEN 作为经典的肝癌造模诱导剂,将斑马鱼长期饲养于含DEN 试剂的溶液中会导致斑马鱼产生肝纤维化,从而发生癌变[13]。Mizgireuv 采用DEN 诱导8 周并清水喂养9 个月(共11 个月)产生肿瘤[7];Fujisawa 等采用同种药物诱导2 个月并清水喂养4 个月(共6 个月)成功构建斑马鱼肝脏肿瘤模型[9]。经过查阅大量文献,发现其他同类斑马鱼肝癌模型的建立时间均较长,本研究将斑马鱼直接浸泡于含DEN 药物的溶液中,DEN 诱导9 周并清水喂养1~2 周,即可观察到较为明显的肝脏肿瘤,并能够进行相关指标检测。与现有的研究相比,诱导周期短且效果明显,极大地缩短了实验时间,提高了实验效率,为肝癌药物的快速筛选提供理论参考。
肝癌的高死亡率迫使人类对其研究不断深入,以便得到最佳的治疗方法,但目前尚无临床疗效肯定的直接抗肝癌的药物。此外,小鼠类实验动物的药物筛选相对繁琐且费时费力。因此,建立稳定、可靠、经济的肝癌动物模型具有重要意义。斑马鱼作为模式动物具有高通量的特点,对用药量需求少,给药方式简单且价格便宜。更重要的是,相较于采用肝脏转基因斑马鱼等模型[14],实验使用野生型AB 系斑马鱼,成本降低至转基因斑马鱼的几十分之一,经济性更明显。此外,斑马鱼本身个体小,全身血量少,不容易采用常规方法检测。本项目优化出斑马鱼肝癌的检测手段,与之前多数研究的评价方式相比,采用斑马鱼体表和肝脏外观肉眼观察、肝肠指数检测、石蜡切片HE 染色、肝脏血管新生率等方法,多维度评价斑马鱼肝癌的发生,可使评价方法更加完善和客观。
由实验数据可知,在DEN 暴露处理第3~4 周开始,实验组斑马鱼体重变轻,游动减缓,但在大体外观上与对照组斑马鱼无显著差异,通过石蜡切片并进行HE 染色发现,实验组斑马鱼肝脏细胞数量有增多现象;DEN 处理5~8 周时,观察到实验组部分斑马鱼出现脊柱弯曲现象,解剖时发现实验组斑马鱼腹部出现油状腹水且腹水情况随着浓度的增大而加重,此外,肝脏颜色变浅,出现炎性细胞浸润现象;DEN 处理9 周开始,实验组斑马鱼鱼鳍附近以及腹部存在腐烂情况,体表黏腻,鱼鳞易脱落,部分个体有体表出血等现象,解剖时发现实验组斑马鱼肝脏组织有明显的变大变重,肝脏表面出现明显的血管新生的现象,并且肝脏颜色变为淡黄色,与对照组斑马鱼肝脏的暗红色相比有显著差异。由于DEN 的强致癌性,毒性较大,实验过程中会不断有斑马鱼无法耐受而死亡。在斑马鱼肝脏模型的检测中,受限于个体特征,斑马鱼本身的血流量较少,无法利用常规的肝癌检测方法准确检测,只能通过组织形态学与病理切片观察。肝癌模型对肝组织进行组织形态学观察可以明显看到组织产生肿瘤,颗粒状囊肿,整个肝脏边缘模糊化,伴有一定的油状腹水;HE 染色检测结果显示,对照组斑马鱼肝脏组织结构和细胞形态正常,细胞大小均一,肝细胞分布均匀,细胞核形态正常,未见明显空泡。而DEN 给药组肝细胞出现严重的破裂空洞的现象,肝细胞排列松散凌乱,大小不一。
此外,实验中把肝脏血管新生的程度作为评价肝癌模型构建的指标之一,主要是考虑到肿瘤的产生过程中,需要大量的营养物质、生长因子和氧气等支持细胞不断增殖,而血管是运输这些物质的主要载体。为获取这些必需物质,肿瘤细胞诱导内皮细胞发生增殖、迁移、侵入、管形成等过程,因此,从血管新生的数量及程度可以间接评估出肿瘤的发生与进展[15]。
4 结论
采用DEN 作为肝癌诱导剂,在9 周内成功建立了斑马鱼肝脏癌症模型,并在诱导过程中优化了诱导时间与给药浓度,证明了DEN 在0~150 μg/mL 浓度范围内能够呈浓度依赖性地诱导斑马鱼肝肠指数的增加,促进肝脏的血管新生以及诱导斑马鱼肝脏的癌变过程。与传统的动物模型相比,优化后的实验模型具有经济、高效、评价手段完善的特点,为进一步研究肝癌的发病机制及治疗药物的筛选提供了评价手段。
