一株满江红内生真菌的分离鉴定及分生孢子发育研究
2022-05-17黄敏敏陈美珍郑伟文
黄敏敏,陈美珍,陈 坚,郑伟文*
(1. 福建省农业科学院农业质量标准与检测技术研究所 / 福建省农产品质量安全重点实验室,福建 福州 350003; 2. 福建省农业科学院生物技术研究所, 福建 福州 350003)
水生植物满江红(Azolla,俗称红萍)是蕨类和固氮蓝藻(Nostoc azollae)的共生体,广泛分布于热带和亚热带的淡水生态系统[1—2]。二十世纪七十年代能源危机期间,为减少对化石能源的依赖,我国和东南亚曾一度掀起利用满江红作为稻田绿肥和畜禽饲料的热潮。随着研究的深入,人们发现满江红体内除共生蓝藻外,还有多种细菌[3—5]。进入21世纪后,随着分子生物学技术的飞速发展,满江红作为共生固氮的模式植物也日益受到关注,固氮蓝藻及其宿主满江红的基因组全序列测定也先后完成[6—7]。2019年,陈坚等[8]通过高通量测序,发现小叶满江红(Azolla microphylla)体内含有多种可产生抗菌、抗肿瘤、富集重金属等活性物质的真菌。这意味着,挖掘繁殖快速且取材容易的满江红体内的真菌资源有可能开发出有经济价值的产品。通过体外培养,进一步鉴定满江红体内真菌的遗传背景及其潜在功能,成为开发满江红体内独具特色的真菌资源的重要前提。真菌活性物质一般通过发酵过程取得,作为发酵悬浮液重要组分的分生孢子其发育状态直接关系到代谢产物的品质与得率。本研究通过实验室培养取得一种真菌的纯培养物,对其进行分子鉴定,并用电子显微镜揭示其分生孢子发育和衰亡进程的结构特征,为进一步验证满江红内生真菌的遗传背景及其开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 真菌材料
材料为小叶满江红(Azolla microphylla),1982年从国际水稻研究所(International Rice Research Institute)引进,编号为IRRI 4018。为了排除外源真菌等微生物的干扰,参照白克智等[9—10]的茎尖培养法,取得表面无菌的满江红纯培养物,在IRRI培育基正常繁殖多代。
1.1.2 培养基
真菌培养基为沙氏(Sabouraud’s)培养基:蛋白胨10 g,麦芽糖 40 g,琼脂20 g,水1000 mL,pH 7.0。
1.2 内生真菌分离培养
取健康的萍体20 g研磨成匀浆,用接种环挑取匀浆在沙氏培养基平板上划线,以上操作均在苏净SW-CJ-2F型洁净工作台无菌条件下完成。25 ℃恒温箱内培养。待菌落长出后,挑取单菌落进一步纯化培养,直至长成致密的绒毛状暗蓝绿色菌落。
1.3 内生真菌培养物分子鉴定
用Ezup柱式真菌基因组DNA抽提试剂盒(上海生工)提取两株培养物总 DNA,序列扩增用通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) 、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR 反应体系:ITS1 (10 μmol·L–1)、ITS4 (10 μmol·L–1)及 DNA模板各 1 µL,Taq Plus DNA Polymerase(5 U·μL–1),dNTP (each 10 m mol·L–1)和 10 X PCR Buffer 共12.5 µL,加无菌双蒸水 9.5 µL,整个反应体系共25 µL。PCR 反应条件:95 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,共 30 个循环;72 ℃ 10 min。PCR产物使用 1%琼脂糖凝胶电泳检测后,扩增产物送上海生工用 3730XL测序仪进行一代双末端测序,获得 abi测序峰图文件,通过软件组装后,与NT库进行比对,获得近源物种信息。
1.4 扫描电镜样品制备与观察
切取上述真菌培养物用 2.5%戊二醛溶液(0.1 mol·L–1磷酸缓冲液,pH 7.2)在室温下固定 4 h,用相同磷酸缓冲液洗涤3次后,用2%锇酸在4 ℃下固定2 h,又经磷酸缓冲液充分洗涤后,用乙醇逐级脱水,并经环氧丙烷替换两次。试样用Hitachi HCP-2型临界点干燥器干燥,经干燥的样品粘附于铜台上,在高倍解剖镜下用细针将菌落中部分菌丝体剥离,减少菌丝遮盖,使孢子梗得以充分暴露,再用EIKO IB-5型离子溅射仪喷镀金钯。用JEOL JSM-6380lV型扫描电子显微镜观察并拍片。加速电压15 kV。
1.5 透射电镜样品制备与观察
将上述经环氧丙烷置换的部分样品包埋于Epon-812环氧树脂,后用Leica EM UC7型切片机切成0.05 µm薄片,醋酸铀和柠檬酸铅双重染色;用Hitachi HT7700型透射电镜观察并拍片。加速电压80 kV。
2 结果与分析
2.1 内生真菌体外培养与鉴定
经培养纯化,共取得2株纯培养的真菌,7 d直径约20 mm,12 d直径约35 mm,质地为绒毛状至致密;颜色呈灰蓝色至暗蓝色,初期稍淡,老后渐深,近于暗蓝灰绿色(图 1A)。2株内生真菌的体外培养物ITS-PCR产物分子量约600 bp (图1B)。
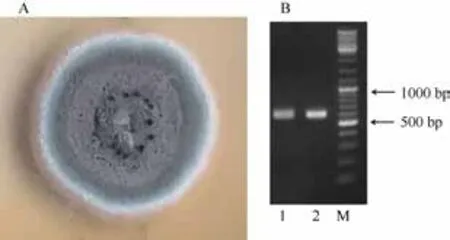
图1 内生真菌分离物的菌落形态及其培养物ITS-PCR产物电泳图谱Fig. 1 Colony morphology and Profile of ITS-PCR products of the endo-fungal isolates
用 3730XL测序仪进行一代双末端测序,通过软件组装后,获得如下545 bp的ITS序列:
CCTGCGGAAGGATCATTACTGAGTGCGGG CTGCCTCCGGGCGCCCAACCTCCCACCCGTGA ATACCTAACACTGTTGCTTCGGCGGGGAGCTCC CTCGGGGGCGAGCCGCCGGGGACTACTGAACT TCATGCCTGAGAGTGATGCAGTCTGAGTCTGAA TATAAAATCAGTCAAAACTTTCAACAATGGATC TCTTGGTTCCGGCATCGATGAAGAACGCAGCG AACTGCGATAAGTAATGTGAATTGCAGAATTCA GTGAATCATCGAGTCTTTGAACGCACATTGCGC CCCCTGGCATTCCGGGGGGCATGCCTGTCCGA GCGTCATTGCTGCCCATCAAGCCCGGCTTGTGT GTTGGGTCGTCGTCCCCCCCGGGGGACGGGCC CGAAAGGCAGCGGCGGCACCGTGTCCGGTCCT CGAGCGTATGGGGCTTTATCACCCGCTCGACTA GGGCCGGCCGGGCGCCAGCCGACGTCTCCAAC CATTTTTCTTCAGGTTGACCTCGGATCAGGTAG GGATACCCGCTGAACTTAAGCATATCAA
经NT库比对,两株真菌分离物与100株曲霉属(Aspergillus)真菌的相似度达99.45%以上,其中58株为聚多曲霉(Aspergillus sydowii)。相似度达100%的聚多曲霉有30株,为此推测两株分离物均为子囊菌门(Ascomycota)聚多曲霉(Aspergillus sydowii)(表1)。将测得的ITS与多株具有抗菌、抗病毒、抗肿瘤活性的聚多曲霉菌株的 ITS序列在GenBank进行比对(Blastn),相似度均在98%以上(表 1)[11—15]。
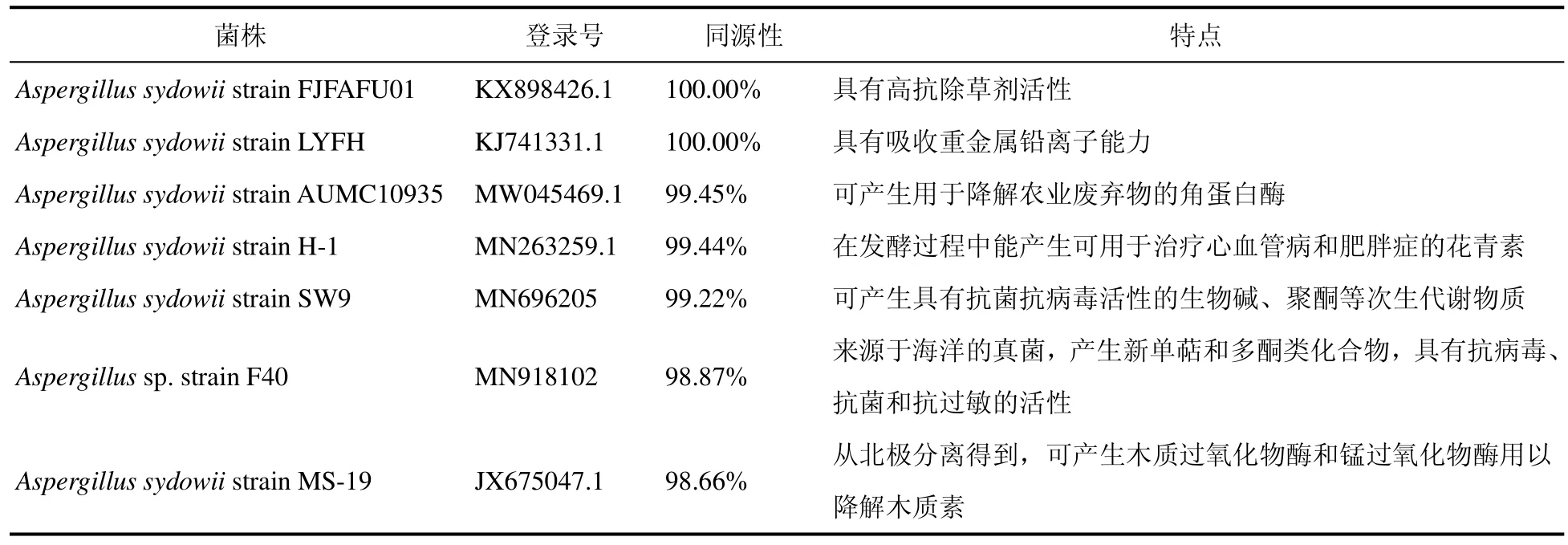
表1 满江红内生真菌分离物ITS序列比对结果Table 1 Comparison of ITS sequence of the endofungal isolates from Azolla
2.2 内生真菌分离物分生孢子形态发生
该内生真菌分离物分生孢子的发育模式为双层方式:从菌丝顶端膨大,形成喇叭形顶囊(高3.4 μm × 直径 5.7 μm)(图 2A),由此长出分生孢子梗,包括梗基(4.2~5.6 μm × 2.2~3.3 μm)和瓶梗(3.8~5.2 μm × 2.4~3.6 μm) (图 2B);随后从辐射状的分生孢子梗顶端长出成串圆球形(或椭球形)的分生孢子链,数量可达数十至数千之多,分生孢子直径2~3.5 µm,表面粗糙,多有细小的突起(图 2C)。

图2 内生真菌分离物分生孢子形态发生Fig. 2 Conidial morphgenesis of the endo-fungal isolates
2.3 内生真菌分离物分生孢子发育和衰亡进程的超微结构
目前对于分生孢子的发育阶段(即未成熟或成熟)及至衰老死亡在细胞结构水平上尚无明确的定义。以下所称的成熟、健康的分生孢子是指:(1)细胞膜系(细胞壁和质膜)完整或无明显内陷、断裂;(2)细胞器如线粒体、高尔基体和溶酶体等完整、内膜无缺损;(3)细胞电子密度较高,有丰富的核糖体,以及微丝、微管或小泡囊等。不健康的分生孢子指细胞电子密度低、细胞器或细胞膜系统残缺或扭曲变形。未成熟的分生孢子指细胞电子密度较高,细胞结构尚未分化或尚在分化。后成熟期的分生孢子指虽有细胞结构但电子密度很低。
图3A为一正脱离其母体(瓶梗)的分生孢子斜切面观,该瓶梗的顶部膨大,预示另一个分生孢子也将被释放出。图3B是图3A右上角方框的放大图,这一发育初期的分生孢子其组成物质来自母体,电子密度高说明代谢旺盛,但尚无细胞器和膜系统等结构分化。图3C为发育中期的分生孢子,胞内已有线粒体和高尔基体的分化(图3D),并有多个具双层单位膜的囊泡(直径40~550 nm)和多条微管,尚未形成完整的细胞膜和细胞壁。图3E是两个正在成熟的分生孢子,它们具有真核生物典型的细胞结构,即细胞壁、质膜、细胞核、线粒体、高尔基体、溶酶体和液泡以及核糖体等细胞器。
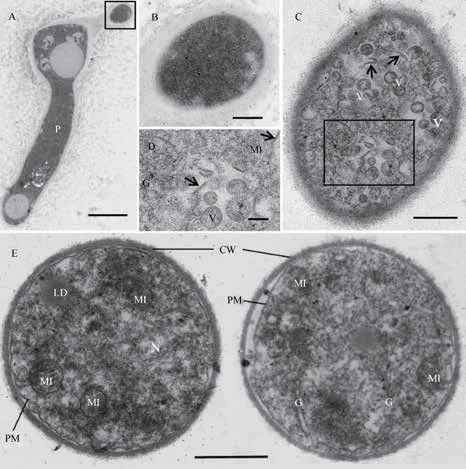
图3 内生真菌分离物不同发育期分生孢子的超微结构Fig. 3 Ultrastructure of the conidia of the endofungal isolate at different developmental stages
图 4A为一后成熟期的分生孢子,其细胞壁、质膜、细胞器基本完整,但电子密度低,并有局部缺损,属于不健康的细胞。图4B的分生孢子细胞壁基本完整但明显变形,质膜和细胞器也严重缺损,趋向液泡化。图4C则是一分生孢子残体,细胞壁、质膜消失,除脂滴外,细胞器多已裂解。这些属于不健康的分生孢子。

图4 不健康的分生孢子结构Fig. 4 Structure of unhealthy conidia
从培养6 d的培养物中随机抽取200个分生孢子,处于分化早、中期的未成熟分生孢子占28.5%,处于成熟期的分生孢子为63%,不健康的占5%,出现类似自噬特征的占3.5%。检查6 d培养物中100个成熟、健康的分生孢子,细胞器出现频率最高的是线粒体(54%)、脂滴(38%)和被两层单位膜包被的泡囊(大小为20~100 nm)。统计12 d的培养物中200个分生孢子,3%为早中期分生孢子,55%为成熟分生孢子,不健康的占 11.5%,显现自噬性死亡特征的占 30.5%。说明约三分之一的分生孢子以自噬的形式死亡。
呈现自噬性死亡特征的分生孢子显然是不健康的。由于其占比高,为此作为重点,从超微结构水平进行较详细观察,并将衰亡进程分成如下几个阶段:(1)自噬启动,由单位膜包裹的圆形液泡/溶酶体内有一被吞噬并裂解的线粒体结构和多个细小的囊泡(图 5a),这种自噬性液泡又称自噬泡或自噬体(autophagosome);(2)质膜内陷,分生孢子质膜明显内陷,细胞壁和质膜之间的距离达其半径的二分之一,两者间的电子透明区域几乎占据一半以上的空间,并充满形状多样的泡囊或碎片,自噬泡内可见部分质膜和胞质被包裹并降解(图5b);(3)胞质裂解,此时分生孢子质膜内陷超过半径的三分之二,尽管质膜基本完整,但线粒体、脂滴等细胞器多被裂解,原来浓密的细胞质和核糖体、微丝等内含物消失,电子密度显著下降,细胞器多被自噬泡或小囊泡所取代(图 5c);(4)质膜断裂,且大部分被降解,胞质中线粒体、脂滴、高尔基体以及核糖体等细胞器、内含物已基本消失,多个自噬泡中多为囊泡或细胞内含物的残体,表明该分生孢子已濒临死亡(图5d);(5)整体解构,细胞高度液泡化,所有细胞结构组分已崩溃,大部分内含物已消失,仅有少量未被消化的囊泡和膜状断片,整个细胞的电子密度几近透明,仅细胞壁保留原来的形态(图5e)。

图5 分生孢子自噬性死亡的结构特征Fig. 5 Structural characteristics of the autophagic death of the conidia
3 讨论与结论
长期以来,水生植物满江红被认定为蕨类与固氮蓝藻的共生体,而今随着越来越多的内生细菌被分离培养,人们将满江红与微生物的共生关系上升为蕨-藻-细菌的三联共生[16]。陈坚等[8]通过高通量测序,发现满江红体内还有真菌存在,将满江红与微生物共生关系的研究又推进一步。本研究不仅证实满江红体内存在内生真菌,还首次实现满江红体内真菌的体外培养,用转录间隔区1 (ITS1)和间隔区4 (ITS4)引物通过PCR扩增、测序和软件组装,取得545 bp序列,经Blastn比对,与聚多曲霉的相似度到99.45%的菌株在100株以上,从分子水平上明确了该内生真菌分离物的分类位置。
分生孢子是有隔菌丝霉菌中最常见的一类无性孢子,是大多数子囊菌门真菌的无性繁殖方式。分生孢子的形态、构造、大小和排列等特征因种而异,是菌种鉴定的重要依据[16—17]。为此本研究用扫描电镜对满江红内生真菌分生孢子的发生和发育模式进行观察。子囊菌门的曲霉属(Aspergillus)和青霉属(Penicillium)是两个进化关系相当接近、均具有分化明显并产生一定形状的分生孢子梗的属,但曲霉的分生孢子梗顶端膨大成顶囊,顶囊上半部着生呈辐射状排列的小梗,小梗末端形成分生孢子链;而青霉的分生孢子梗顶端多次分枝成扫帚状,分枝顶端着生小梗,小梗上串生分生孢子[18—19]。本研究观察到喇叭状的顶囊,上面着生辐射状的分生孢子链,因而可排除属于青霉的可能性。对真菌分离物分生孢子形态结构和发育模式的观察表明,其分生孢子发生模式为芽殖型(blastic)[16—17],其分生孢子的形状、大小等具有曲霉属真菌的典型特征[18]。这与分子鉴定结果一致,因而可以进一步认定该分离物为聚多曲霉,属子囊菌门(Ascomycota)散囊菌目(Eurotium)发菌科(Trichocomaceae)。
更有意义的是,将该分离物的ITS序列与能产生多种活性物质的多种聚多曲霉菌株比对,相似度均大于98%,表明本研究获得的满江红内生真菌聚多曲霉具有上述潜能,值得进一步研究,以确定其应用价值。
本研究还对不同发育期的分生孢子结构特征进行定义和比较分析。结果表明,分离的聚多曲霉在沙氏平板培养6 d与12 d,其分生孢子发生与老化程度有如下区别:6 d培养物处于发育早中期的分生孢子比12 d培养物高约25%,成熟的分生孢子也比后者高8%。而12 d培养物不健康或呈现自噬特征的分生孢子比6 d培养物高约35%。出现不健康的分生孢子可能是 DNA复制出错或翻译时蛋白质折叠异常所致,在发育早期或后期均可能发生;也可能是菌体之间营养竞争导致的死亡。12 d培养物中不健康或衰亡的分生孢子比例偏高可能与自制的平板培养基厚度较薄,营养在短期内耗尽有关,营养元素缺乏作为一种化学信号可能诱发细胞程序性死亡;也可能是取样误差所致。固体培养基上的真菌菌苔随着培养时间的推进由中心向外周呈辐射状生长(图1A)。在菌龄12 d的菌苔中心处取样,其分生孢子老化的比例可能大于在菌苔外缘处取样的分生孢子。后续将在研究中对不同取样区域的观察结果进行比较,制定更科学的取样标准,以避免因取样造成误差。悬浮液是真菌发酵的主要产物。分生孢子的生育状况直接关系到其代谢产物的质量与数量。上述结果启示在后续的开发研究中应通过发酵条件的优化以调控其生育状况从而取得最佳的产品得率。
细胞程序性死亡是真核生物死亡的重要形式,可分为凋亡、自溶和自噬等类型[20]。满江红内生真菌培养物中不健康分生孢子除了电子密度低、细胞内含物裂解外,其外膜系统尤其细胞壁有明显的程序性死亡特征。如图4B近似于凋亡(apoptosis-like),细胞壁呈不规则的内陷变形;而图4C更接近于自溶(autolysis-like),即细胞壁自我溶解;图5e分生孢子几乎中空,残存但形态完整的细胞壁则是自噬性死亡区别于凋亡和自溶的重要标志[20]。
自噬是单细胞或多细胞真核生物将其细胞质内含物移入自噬泡(液泡、溶酶体或两者融合)进而自我消化的动态过程。它也是各种生物为实现体内平衡,达到新的适应水平的自我保护和调节过程[21—22]。自噬性死亡(Autophagic cell death)是细胞通过自噬而实现自我“牺牲”的消亡过程,是细胞程序性死亡的一种重要方式。本研究分生孢子自噬性死亡的几个阶段与真核生物自噬性死亡的超微结构变化基本吻合[22—23]。图5a中自噬泡的出现,是典型的自噬,可视为自噬性死亡的早期信号。但因其胞质电子密度较高,也可能是一种自我调节的可逆行为。图5d中溶酶体与液泡的融合是自噬泡形成和扩展,最终导致死亡的主要途径。
本研究首次分离培养,并通过测序比对和形态结构观察,鉴定了水生植物满江红的内生真菌聚多曲霉的存在,较为系统地揭示了其分生孢子发育模式以及发生与衰亡进程的结构特征,为聚多曲霉活性物质的开发和利用及其基础生物学研究提供了细胞学依据,并启示对水生植物满江红内生真菌资源的开发是有意义的课题。
