瑞芬太尼抑制人肝癌细胞Notch信号通路及细胞生长的研究
2022-05-17夏德国颜克实陆大浩
夏德国, 颜克实, 陆大浩, 张 弛, 高 巨
(扬州大学附属苏北人民医院, 1. 麻醉科, 2. 肝胆外科, 江苏 扬州, 225000)
统计数据[1-2]显示,目前中国新确诊的肝癌患者约占全球新确诊肝癌患者的50%, 且肝癌具有高病死率、高复发率及恶性程度高等特点,是肿瘤外科常见的恶性肿瘤。多数肝癌患者的早期临床症状表现不明显,确诊时已属中晚期,治疗效果不理想,并易发生并发症[3]。瑞芬太尼是临床上用于全身麻醉诱导或全身麻醉维持阵痛的麻醉药,在胰腺癌、骨肉瘤等多种肿瘤治疗中均有应用[4-5]。刘震等[6]研究结果显示,舒芬太尼和瑞芬太尼均可以抑制肝癌细胞的增殖和迁移能力,阻滞细胞周期,并诱导细胞凋亡。Notch信号通路主要包括Notch受体、Notch配体及下游基因Hes1, 在调节癌症细胞分化、增殖和凋亡等方面发挥重要的作用[7]。研究[8]显示,姜黄素通过抑制、下调Notch1、NF-κB信号通路而抑制肝癌细胞的增殖。本研究通过体外培养肝癌细胞HepG2, 探讨瑞芬太尼通过Notch信号通路调控肝癌细胞增殖、周期和凋亡的可能性以及相关的机制,现报告如下。
1 材料与方法
1.1 细胞和主要试剂
肝癌细胞HepG2购自中国科学院上海生物研究所; 胎牛血清、DMEM培养基购自美国Gbico公司; 链霉素、青霉素购自美国Hyclone公司; 注射用盐酸瑞芬太尼购自江苏恩华药业公司(国药准字H20143314, 批号201802073); Notch通路抑制剂DAPT购自美国Sigma公司; CCK8试剂盒、BCA试剂盒、ECL试剂盒购自上海碧云天公司; 细胞周期试剂盒、凋亡试剂盒购自江苏凯基生物公司; p27抗体、Cyclin D1抗体、Bax抗体、cleaved cas-3抗体、Notch1抗体、Hes1抗体和GAPDH抗体购自美国Abcam公司。
1.2 细胞培养和分组
将复苏后的肝癌细胞HepG2转至含有10%胎牛血清、双抗(100 mg/L链霉素和100 kU/L青霉素)的DMEM培养基内,于37 ℃、5% CO2条件下培养。取对数生长期的肝癌细胞HepG2, 消化后转移至6孔细胞板内,接种密度为1×106个/孔。采用0、5、50、500 ng/mL的瑞芬太尼处理细胞,并设为瑞芬太尼的各剂量组; 选取500 ng/mL的瑞芬太尼和20 μmol/L的Notch通路抑制剂DAPT处理细胞,分别设为瑞芬太尼组、瑞芬太尼+DAPT组。
1.3 CCK8检测细胞增殖
取对数生长期的各组肝癌细胞HepG2, 制成细胞悬液后接种至96孔细胞板内,每孔内加入100 μL的细胞悬液,在培养箱内固定培养48、72 h, 每孔添加10 μL CCK8溶液,继续培养1 h, 取出后在酶标仪450 nm处检测细胞的光密度值(OD450 nm值)。
1.4 流式细胞术检测细胞周期和凋亡
1.4.1 细胞周期实验: 取对数生长期的各组肝癌细胞HepG2, 在培养箱内培养48 h, 经过离心后加入75%预冷的乙醇溶液,使其混匀后固定24 h, 加入1 mL PI和RNA酶,室温培养30 min, 在流式细胞仪上检测细胞周期分布情况。
1.4.2 细胞凋亡实验: 取对数生长期的各组肝癌细胞HepG2, 制成单细胞悬液后接种在6孔细胞板内,在培养箱内培养48 h, 离心后收集细胞,加入1 mL的1×Binding Buffer重悬细胞,按照凋亡试剂盒的说明步骤加入Annexin V-FITC/PI各5 μL, 混匀避光反应15 min, 在流式细胞仪上检测细胞凋亡情况。
1.5 Western blot检测p27、Cyclin D1、Bax、cleavedcas-3和Notch通路相关蛋白的表达
取对数生长期的各组肝癌细胞HepG2用于提取细胞的总蛋白,参照BCA试剂盒说明书定量蛋白浓度,上样至SDS-PAGE凝胶电泳处理,转膜,采用脱脂奶粉封闭培养2 h。洗膜后加入p27、Cyclin D1、Bax、cleaved cas-3、Notch1、Hes1和GAPDH抗体, 4 ℃孵育过夜,洗膜3次,加入二抗,室温下孵育2 h,洗膜3次,最后滴加ECL化学液曝光处理,经过Image J软件分析蛋白条带灰度值,以GAPDH作为内参,计算目的蛋白的表达。
1.6 统计学分析

2 结 果
2.1 不同浓度的瑞芬太尼对肝癌细胞HepG2增殖的影响
采用0、5、50、500 ng/mL的瑞芬太尼处理肝癌细胞HepG2后,结果显示,细胞的OD450 nm值逐渐降低, p27蛋白表达逐渐增加,差异均有统计学意义(P<0.05)。见图1、表1。
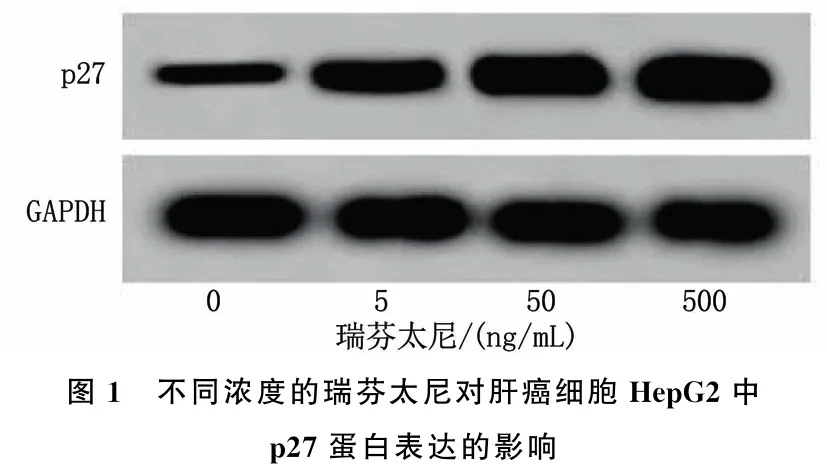
图1 不同浓度的瑞芬太尼对肝癌细胞HepG2中p27蛋白表达的影响

表1 不同浓度的瑞芬太尼对肝癌细胞HepG2增殖的影响
2.2 不同浓度的瑞芬太尼对肝癌细胞HepG2周期的影响
采用0、5、50、500 ng/mL的瑞芬太尼处理肝癌细胞HepG2后,结果显示, G0/G1期细胞比率逐渐增加, S期细胞比率、Cyclin D1蛋白表达逐渐降低,差异均有统计学意义(P<0.05)。见图2、表2。
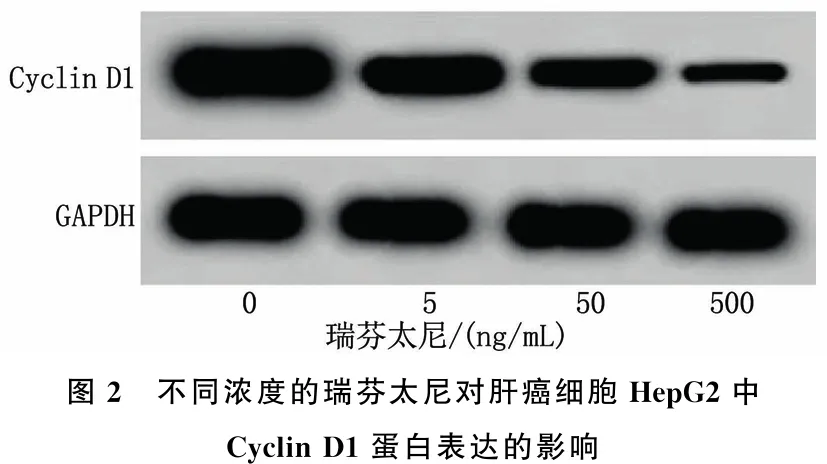
图2 不同浓度的瑞芬太尼对肝癌细胞HepG2中Cyclin D1蛋白表达的影响

表2 不同浓度的瑞芬太尼对肝癌细胞HepG2周期的影响
2.3 不同浓度的瑞芬太尼对肝癌细胞HepG2凋亡的影响
采用0、5、50、500 ng/mL的瑞芬太尼处理肝癌细胞HepG2后,结果显示,细胞凋亡率、Bax、cleaved cas-3蛋白表达逐渐增加,差异均有统计学意义(P<0.05)。见图3、表3。

A: 细胞凋亡率; B: 凋亡相关蛋白。图3 不同浓度的瑞芬太尼对肝癌细胞HepG2凋亡的影响

表3 不同浓度的瑞芬太尼对肝癌细胞HepG2凋亡的影响
2.4 不同浓度的瑞芬太尼对肝癌细胞HepG2中Notch通路的影响
采用0、5、50、500 ng/mL的瑞芬太尼处理肝癌细胞HepG2后,结果显示,细胞的Notch1、Hes1蛋白表达逐渐降低,差异有统计学意义(P<0.05)。见图4、表4。
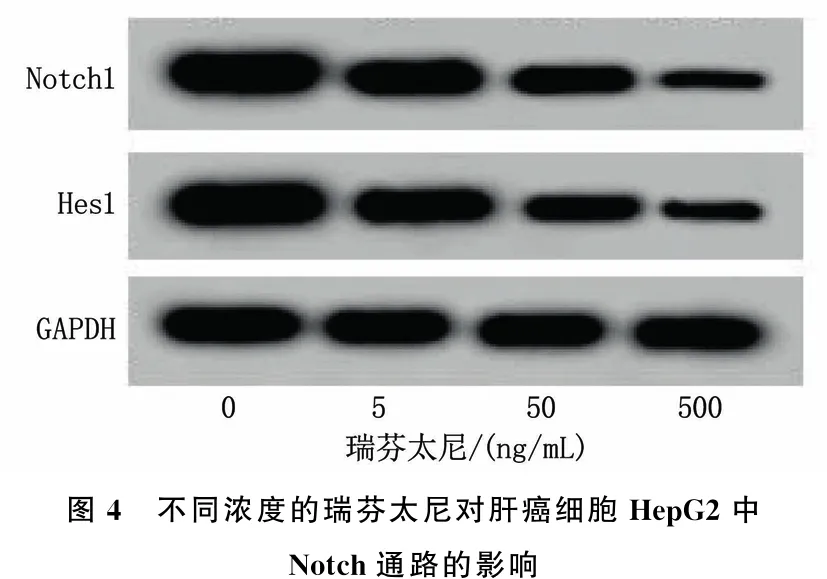
图4 不同浓度的瑞芬太尼对肝癌细胞HepG2中Notch通路的影响

表4 不同浓度的瑞芬太尼对肝癌细胞HepG2中Notch通路的影响
2.5 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2增殖和周期的影响
与瑞芬太尼组相比,瑞芬太尼+DAPT组的OD450 nm值、S期细胞比率、Cyclin D1蛋白表达降低,G0/G1期细胞比率、p27蛋白表达增加,差异均有统计学意义(P<0.05)。见图5、表5。
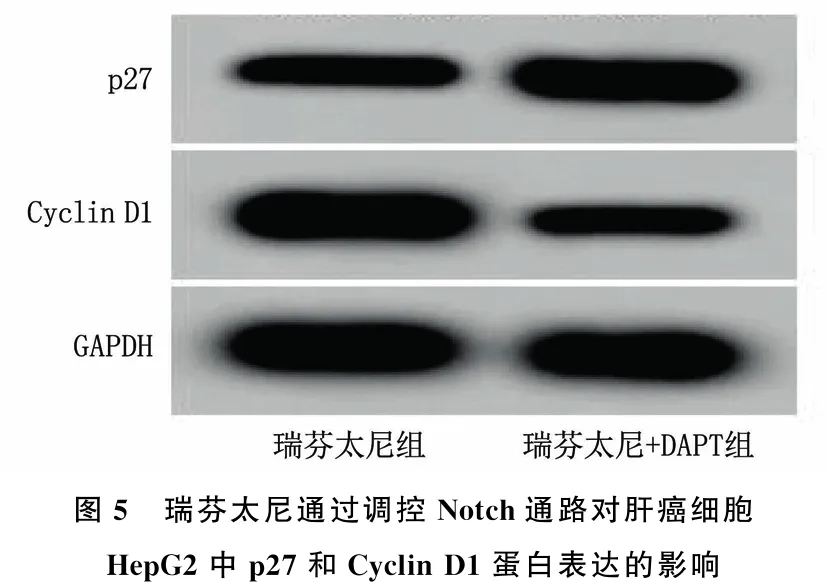
图5 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2中p27和Cyclin D1蛋白表达的影响

表5 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2增殖和周期的影响
2.6 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2凋亡的影响
与瑞芬太尼组相比,瑞芬太尼+DAPT组的细胞凋亡率、Bax、cleaved cas-3蛋白表达增加,差异均有统计学意义(P<0.05)。见图6、表6。
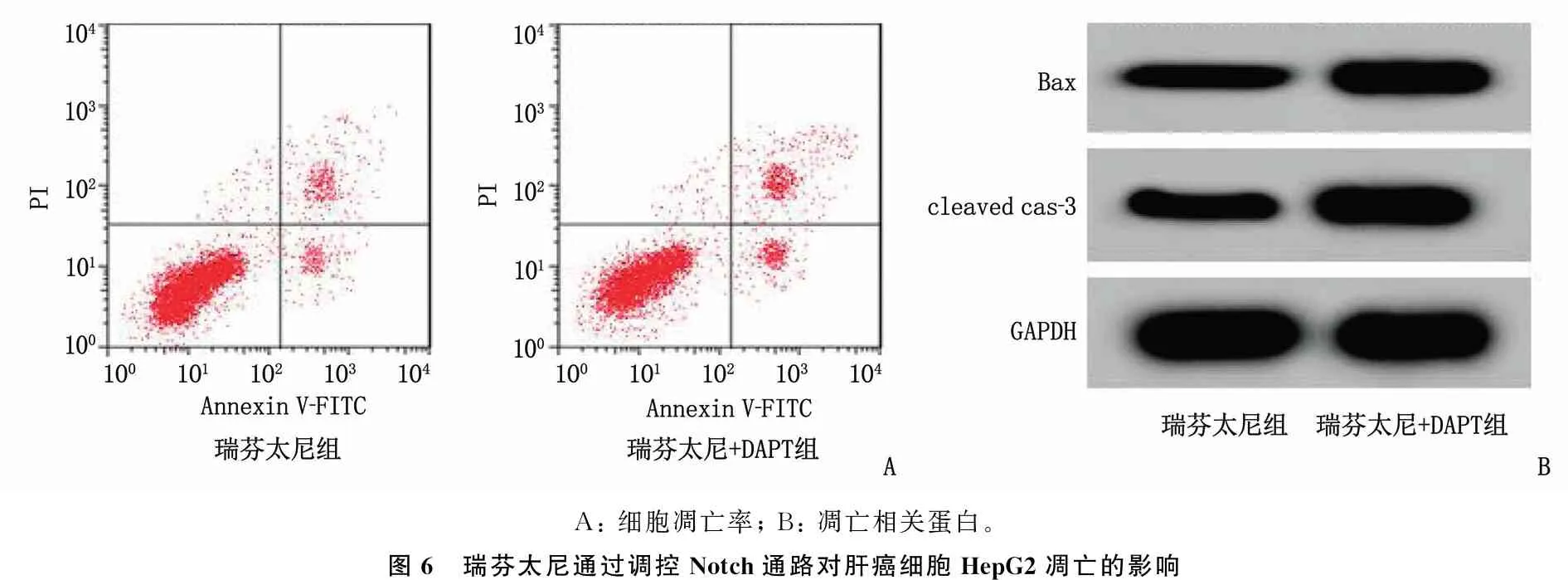
A: 细胞凋亡率; B: 凋亡相关蛋白。图6 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2凋亡的影响

表6 瑞芬太尼通过调控Notch通路对肝癌细胞HepG2凋亡的影响
3 讨 论
肝癌受多种因素的影响,其中病毒感染、环境污染、遗传等是导致肝癌的主要原因[9]。临床上治疗肝癌的方法包括外科手术切除、化疗、放疗和免疫治疗等,但是基于肝癌高侵袭率、高复发率和高病死率等特点,导致患者5年预后较差[10-11]。瑞芬太尼是一种有选择性的μ阿片受体激动剂,在组织和细胞内能够快速水解,起效过程很快[12]。瑞芬太尼具有抗肿瘤的作用,孟杨等[13]研究结果显示,瑞芬太尼通过上调miR-148a抑制骨肉瘤细胞增殖,并诱导其细胞凋亡。孙成成等[14]研究结果显示,瑞芬太尼通过调控miR-519d-3p/STAT3的表达抑制胃癌细胞的增殖,促进细胞的凋亡。唐优仕等[15]研究结果显示,瑞芬太尼通过抑制AKT信号通路而抑制胰腺癌细胞的增殖,并促进细胞的凋亡,减弱端粒酶活性。孙辉平等[16]研究结果显示,瑞芬太尼能够抑制肝癌细胞的增殖和促进细胞凋亡,阻滞细胞周期。本研究采用不同浓度的瑞芬太尼处理肝癌细胞HepG2后,结果显示,瑞芬太尼各剂量组可以抑制肝癌细胞的OD450 nm值,促进细胞的凋亡,增加G0/G1期细胞比率,降低S期细胞比率,上调p27、Bax、cleaved cas-3蛋白表达,下调Cyclin D1蛋白表达,说明瑞芬太尼可以明显抑制肝癌细胞的增殖,阻滞细胞周期,促进细胞的凋亡。
Notch信号通路是一个在进化上高度保守的信号转导途径,最初发现于果蝇体内,在脊椎动物和无脊椎动物中广泛存在,可以参与肿瘤细胞的增殖、周期和凋亡等[17-18]。Notch家族主要有Notch1、Notch2、Notch3、Notch4受体,可以与Notch受体DLL1、DLL3、DLL4、Jagged1、Jagged2特异性结合使信号通路激活,进而激活Hes家族的转录因子[19-20]。Notch1蛋白表达在肝癌细胞中上调, miR-124通过抑制Notch1信号通路抑制肝癌细胞增殖和迁移[21]。岳犇等[22]研究结果显示,激活Notch1/Jagged1信号通路可以抑制肝癌细胞的增殖和侵袭能力。孙传喜等[23]研究结果显示, ADAM17通过Notch1/Hes1信号通路调控肝癌细胞的增殖。本研究采用不同浓度的瑞芬太尼处理肝癌细胞HepG2, 结果显示各浓度的瑞芬太尼处理后的Notch1、Hes1蛋白表达下调。在加入Notch信号通路抑制剂DAPT处理细胞后, OD450 nm值、S期细胞比率降低, G0/G1期细胞比率、细胞凋亡率增加, p27、Bax、cleaved cas-3蛋白表达上调, Cyclin D1蛋白表达下调,说明瑞芬太尼可以抑制Notch信号通路。
综上所述,瑞芬太尼可以抑制肝癌细胞的增殖和细胞周期,促进细胞的凋亡,其作用可能通过抑制Notch信号通路实现。
