网络药理学分析三氯生对非酒精性脂肪性肝病的治疗作用
2022-05-16孙东雷赵田禾王静静张遵真
左 超,孙东雷,赵田禾,王静静,张遵真
四川大学华西公共卫生学院/四川大学华西第四医院劳动卫生与环境卫生学系,成都 610041
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种波及全人群的慢性肝脏疾病,而全世界尚无药物获批用于NAFLD临床治疗[1],寻求NAFLD发病机制中的关键靶点和有效干预药物已成为当下研究的热点与难点。肝脏脂肪酸合成增加与脂肪酸分解减少被认为是NAFLD发生发展的罪魁祸首[2],其中脂肪酸合成酶(fatty acid synthase,FASN)是肝脏从头合成脂肪酸的关键限速酶,FASN表达增加会引起肝细胞内脂肪沉积导致肝脏脂肪变性[2],因此,将FASN抑制剂用于改善NAFLD是药物研发的新方向。三氯生(C4H7Cl3O2)是一种常见的广谱抗菌剂,最初被发现可以通过抑制细菌FASN发挥抗菌作用[3],近年研究显示三氯生还可以抑制多种人源性细胞的FASN[4- 5],不难推测三氯生可能通过抑制FASN减少肝细胞脂合成,可能具有治疗NAFLD的潜力。但迄今为止并无将三氯生用于改善NAFLD的研究,三氯生是否能够治疗NAFLD的效果尚不清楚。此外,单一靶点药物不足以改善NAFLD[1],三氯生是否能够作用于多靶点改善NAFLD同样存疑。若能寻找到除FASN外三氯生改善NAFLD的其他靶点,可以为三氯生改善NALFD的研究提供更加全面的理论依据。网络药理学是近年发展的、基于计算机的预测技术,可快速、高效预测化合物作用于疾病的多个靶点,可为探究化合物的成药潜力与分子机制提供线索。本研究采用网络药理学技术预测三氯生对NAFLD的作用靶点,分析靶点富集的信号通路,并进行初步的药理学实验,为未来深入研究三氯生治疗NAFLD的作用与机制提供思路与依据。
材料和方法
数据库三氯生的化学结构资料和结构信息SMILES式来自小分子化学物数据库Pubchem(https://pubchem.ncbi.nlm.nih.gov/)。化合物作用靶点的预测与疾病靶点的获取通常利用多个数据库进行交集分析,避免单一数据库预测结果的不准确性。因此,本研究使用PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)、HTDocking(https://www.cbligand.org/AD/)、HitPick(http://mips.helmholtz-muenchen.de/hitpick/cgi-bin/index.cgi?content=help.html)、SuperTarget(https://bioinformatics.charite.de/supertarget/index.php?site=targets) 4个化合物作用靶点预测网站预测三氯生的作用靶点,利用TTD(http://db.idrblab.net/ttd/)、OMIM(https://omim.org/)和Genecards(https://www. genecards.org/) 3个经典的疾病数据库获取NAFLD疾病靶点,通过蛋白质数据库Uniprot(https://www. uniprot.org/)对靶点名称进行标准化处理,从蛋白质结构数据库PDB(http://www1.rcsb.org/)中获取蛋白三维结构编码(即PDB ID)。
药品与试剂三氯生(纯度≥97%)和羧甲基纤维素钠购于大连美仑生物有限公司,三氯生混悬液每日现配现用。60%高脂饲料购于南通特洛菲饲料科技有限公司。10%中性甲醛组织固定液购于武汉赛维尔生物科技有限公司。蛋白质裂解液购于索莱宝生物科技有限公司。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)α抗体购于艾博抗生物有限公司。β-actin抗体购于博士德生物有限公司。
动物与饲养8周龄雄性C57BL/6J小鼠购于四川大学动物实验中心,实验动物生产许可证:SCXK(川)2018- 026。C57BL/6J雄鼠喂养于四川大学华西公共卫生学院实验动物中心,许可证:SYXK(川)2018- 011,昼夜交替时间10/14 h,温度26 ℃,相对湿度60%。动物实验方案已通过四川大学华西医学中心伦理审查(编号:K2021027)。
三氯生作用靶点预测在Pubchem数据库获取三氯生三维结构与SMILES式,导入PharmMapper、HTDocking、HitPick和SuperTarget,预测三氯生的作用靶点。
非酒精性脂肪性肝病靶点的获取以NAFLD的ICD- 10代码 “K76.001”、“Non-alcoholic fatty liver diseases”作为关键词,限定种属“Homo sapiens(人类)”,在TTD、OMIM、Genecards数据库进行疾病靶点的检索,筛选NAFLD疾病靶点。
三氯生与NAFLD共同靶点的蛋白质网络构建使用Uniprot数据库将三氯生作用蛋白与NAFLD疾病靶点通过蛋白-基因名称转换后进行交集分析获取共同靶点,使用R Project作韦恩图。使用String平台对共同靶点进行“蛋白-蛋白”相互作用分析,利用Cytoscape 3.7.1软件进行可视化,构建共同靶点的蛋白相互作用网络图,筛选出三氯生治疗NAFLD潜在靶点进行分子对接验证。
三氯生治疗NAFLD潜在靶点的分子对接验证使用UCSF Chimera与Auto Dock Tool两种分子对接软件进行分子对接验证。将三氯生治疗NAFLD潜在靶点的PDB ID输入UCSF Chimera与Auto Dock Tool软件,计算三氯生与各蛋白的结合能,筛选能与三氯生稳定结合的靶点。
三氯生与NAFLD共同靶点的生物过程与通路分析对筛选出的三氯生与NAFLD共同靶点进行基因本体(gene ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,使用R Project进行可视化,探究靶点富集的生物过程和信号通路,结合分子对接结果筛选关键靶点。
动物实验方案适应性喂养1周后,将小鼠随机分为空白对照组(n=10)、模型组(n=10)和三氯生组(n=10),小鼠自由摄食和饮水。空白对照组使用普通饲料,模型组与三氯生组使用高脂饲料,饲养12周。建立NAFLD模型后三氯生组每日灌胃400 mg/(kg·d)剂量的三氯生混悬液;模型组灌胃0.5%羧甲基纤维素钠溶液,按0.01 ml/g的灌胃体积连续灌胃8周;空白对照组继续饲喂普通饲料。给药结束,禁食不禁水12 h,处死小鼠,收集小鼠肝脏。每只小鼠剪取肝脏相同部位,10%中性甲醛组织固定液中固定24 h后由武汉赛维尔生物科技有限公司进行HE染色与油红O染色。称取133 mg肝脏组织,加入1000 μl蛋白裂解液提取蛋白,并采用蛋白质免疫印迹法检测小鼠肝组织中PPARα蛋白水平。
结 果
三氯生治疗NAFLD潜在靶点的网络构建与分析本文探究三氯生治疗NAFLD靶点的网络药理学研究流程见图1。通过网络药理学共获得319个三氯生作用靶点和351个NAFLD疾病靶点,取交集后获得34个共同靶点(表1)。将34个靶点导入String并使用Cytoscape3.7.1计算每个靶点的Degree值并进行可视化。Degree值表示靶点在整个网络中与其他靶点的关联强度,数值越大表明靶点在整个网络具有更核心的地位,更具研究价值。结果显示34个靶点的平均Degree值为10.38,其中ALB、AKT1、PPARG、IGF1、F2、MAPK8、FABP4、HMOX1、MPO、CASP3、ACE、APP、PPARA、STAT1、FASN、EGFR、SOD2、TTR、MMP2这19个基因的Degree值大于均值,节点更大、颜色更红(图2),表明它们可能是三氯生治疗NAFLD的潜在靶点,需要通过分子对接进一步验证。

1个圆形代表1个节点,在蛋白-蛋白相互作用网络图中,Degree值越大,节点越大、越红
三氯生与潜在靶点的分子对接结果潜在靶点与三氯生结合越稳定,成药潜力越大,因此,本文采用分子对接技术分析三氯生与上述19个潜在靶点蛋白的结合能。结合能<0 kcal/mol表明三氯生可与受体蛋白自发结合,能量越低结合构象越稳定。三氯生与19个潜在靶点蛋白均能自发稳定结合,其中UCSF Chimera对接得分显示,PPARA、ALB对应蛋白质与三氯生的结合能最低,Auto Dock Tool结果显示MAPK8对应蛋白质的结合能最低(表2),表明PPARA、ALB、MAPK8对应的靶点蛋白与三氯生结合构象最稳定。
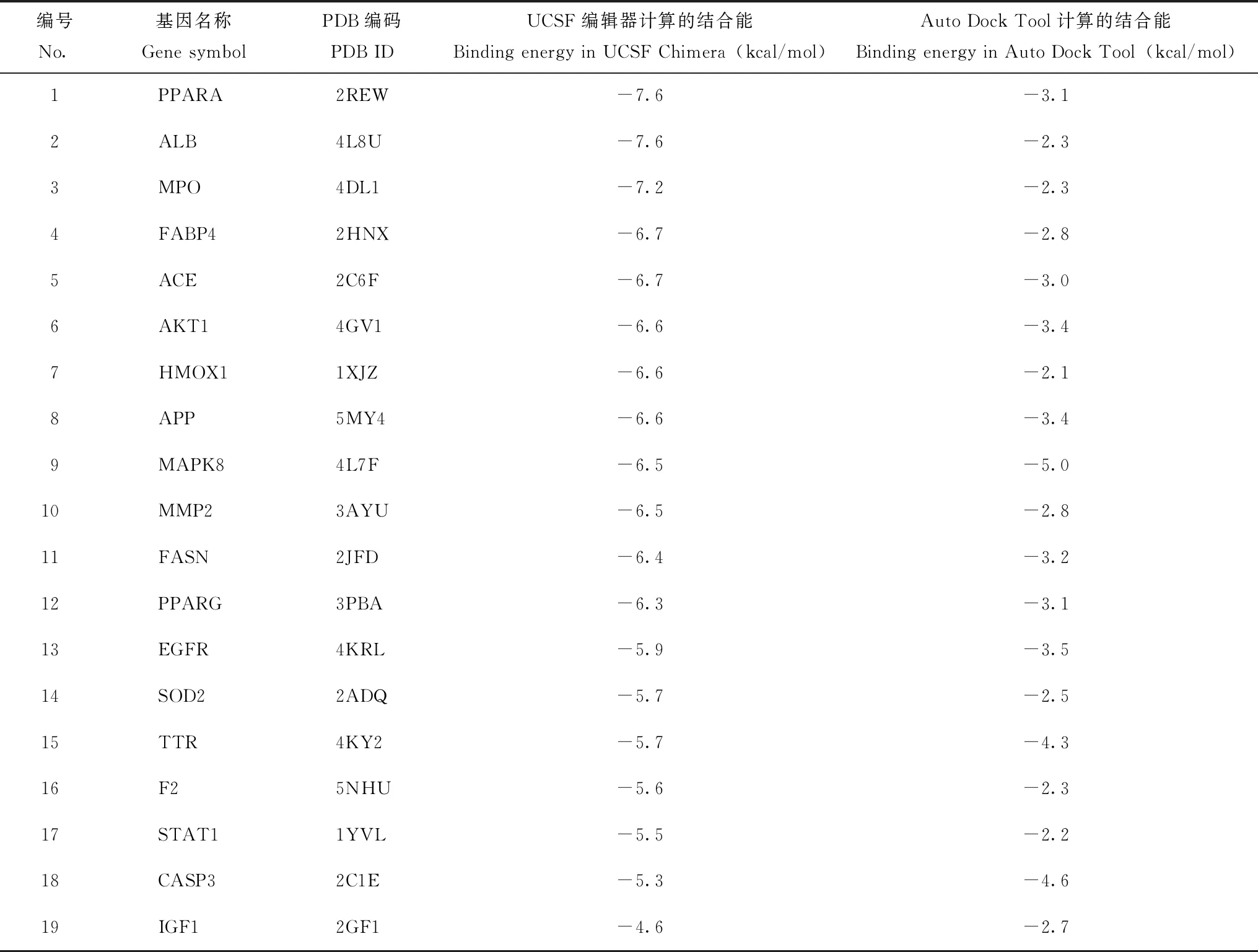
表2 三氯生与潜在靶点蛋白的分子对接得分
三氯生与NAFLD共同靶点的GO分析与KEGG通路分析为确定三氯生发挥作用的关键通路,对筛选出的34个三氯生和NAFLD的共同靶点分别进行KEGG通路和GO分析。KEGG通路分析显示,34个共同靶点富集在PPAR信号通路、癌症通路和丙型肝炎相关通路等10条信号通路(图3)。其中,PPAR信号通路主要参与脂肪酸氧化分解代谢,是共同靶点高度富集的通路。GO分析表明,34个靶点的生物过程包含机体对营养素的敏感度、羧酸代谢、脂质转运和细胞脂质分解等(图4);此外,这些靶点还与细胞和脂质及激素的结合、核受体的活性、抗氧化能力等生物功能相关。
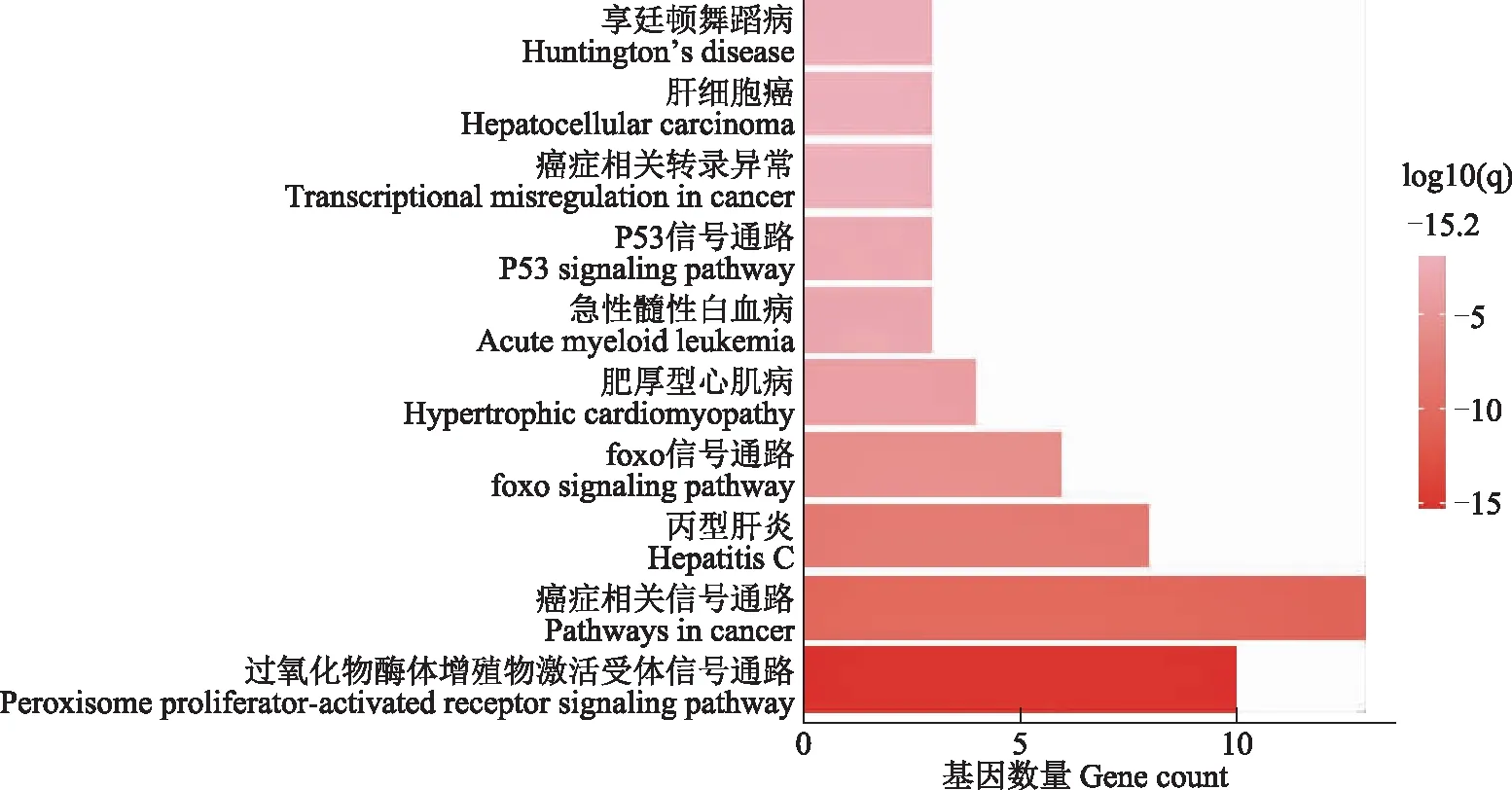
图3 三氯生与NAFLD共同靶点的KEGG分析
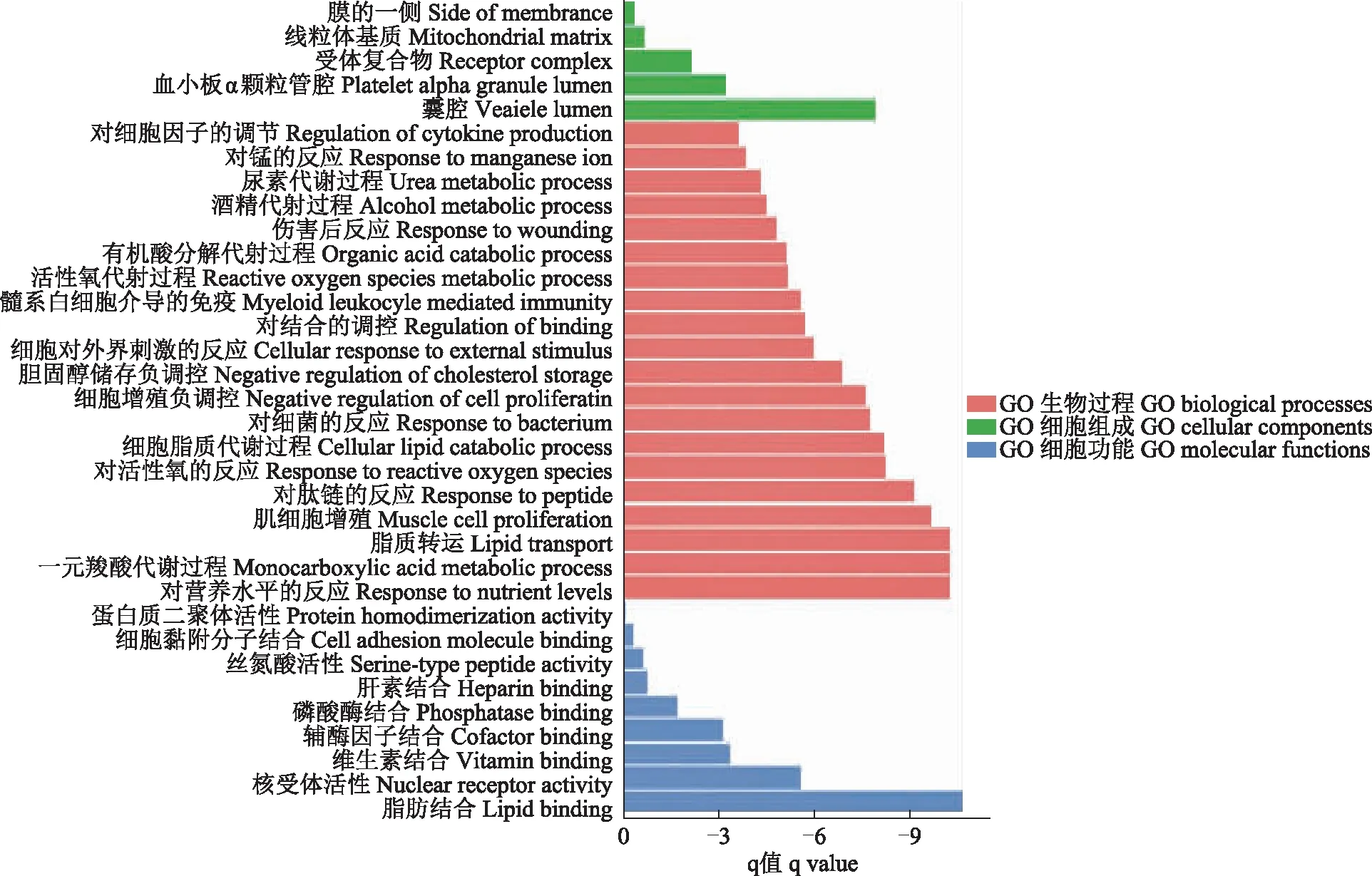
图4 三氯生与NAFLD共同靶点的GO分析
三氯生对NAFLD小鼠肝脏组织学形态与脂肪沉积的影响HE染色结果显示,空白对照组小鼠肝脏细胞正常,肝索清晰;模型组可见肝脏细胞出现大量气球样变,细胞边界模糊,肝索消失,可见大量脂肪空泡;三氯生给药8周后,三氯生组小鼠肝脏细胞气球样变与脂滴空泡逐渐减少(图5)。油红O染色结果可见,空白对照组小鼠肝细胞质与细胞核蓝染;模型组小鼠肝细胞核蓝染,胞质内聚集大量红染的脂滴,三氯生给药后小鼠肝脏中红色脂滴颗粒显著变小、变少(图5)。使用Image Pro Plus 6.0软件计算油红O染色脂滴面积与总面积的比值(即脂滴面积比),结果显示空白对照组小鼠肝脏脂滴面积比为0.01%,模型组小鼠肝脏脂滴面积比为59.99%,三氯生组小鼠肝脏的脂滴面积比为10.26%。与模型组相比,三氯生干预后小鼠肝脏的脂滴面积比下降了82.90%(F=96.952,P<0.001)。

图5 小鼠肝脏HE染色与油红O染色结果(×200)
三氯生对NAFLD小鼠肝脏组织中PPARα蛋白水平的影响与空白对照组相比,模型组小鼠PPARα蛋白水平增加了62.66%(F=44.233,P<0.001);与模型组相比,三氯生给药后小鼠肝脏PPARα蛋白水平增加了133.90%(F=26.460,P<0.001)(图6)。
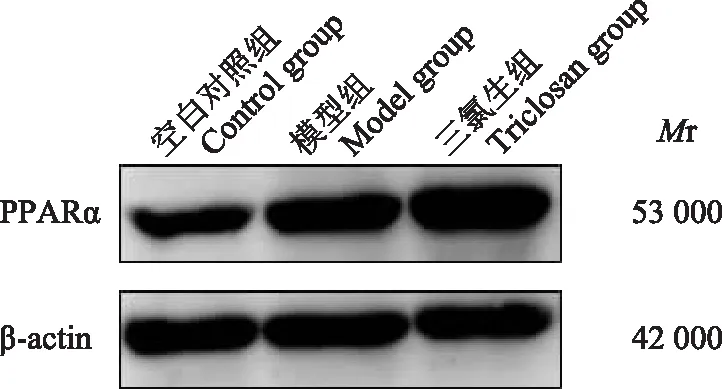
PPARα:过氧化物酶体增殖物激活受体α;Mr:相对分子质量
讨 论
本研究初步预测到34个三氯生与NAFLD的共同靶点,通过蛋白质相互作用分析筛选出19个潜在靶点,并通过分子对接与KEGG分析的进一步筛选,发现PPARα是三氯生治疗NAFLD的关键靶点。蛋白质相互作用筛选出的19个潜在靶点中,SOD2与MPO参与细胞氧化应激,MMP2、EGFR参与NAFLD进展形成肝纤维化[6],PPARG、PPARA、AKT1、MAPK8、ACE、ALB等基因与糖脂代谢紊乱有关[5,7- 9],FASN促进肝脏脂肪酸合成[2],表明三氯生可能是一个多靶点药物。分子对接可根据三氯生与各靶点蛋白结合的稳定程度判断更易结合并发挥作用的靶点,结果提示PPARA、ALB以及MAPK8相应靶蛋白与三氯生结合稳定。PPARA翻译出PPARα,参与调控肝脏脂肪酸氧化分解[10],是肝脏脂肪含量减少的重要途径。白蛋白(albumin,ALB)可作为NAFLD肝纤维化早期预测的血清标志物,用于评估肝脏功能受损情况[11],由于ALB变化不具有特异性[12],难以作为NAFLD的治疗靶点。MAPK8参与高脂饮食诱导的小鼠糖脂代谢紊乱,是治疗肥胖的潜在靶点[13],但MAPK8可否改善NAFLD仍待确证。KEGG通路分析结果高度集中于PPAR信号通路,提示三氯生最可能通过PPAR信号通路发挥治疗NAFLD作用,ALB与MAPK8未参与该通路,表明PPARα可能是所有潜在靶点中最具希望的靶点。PPAR信号通路包含3种不同的类型,其中PPARα主要在肝脏组织表达,是肝脏脂肪酸氧化分解的关键调控分子[2]。有研究显示PPARα可以激活下游酶体如肉毒碱棕榈酰转移酶- 1使脂肪酸进入线粒体氧化分解,减少肝脏脂肪酸含量[2]。高脂饲料饲喂C57BL/6雌鼠8周,子代雄鼠肝脏PPARα蛋白表达均降低,肝脏出现脂肪变性[5];使用添加PPARα激活剂的高脂饲料饲养子代雄鼠,肝脏脂肪变性明显改善[5]。这些结果充分表明激活PPARα可以增强脂肪酸氧化分解、降低肝脏脂肪含量,达到治疗NAFLD的作用。研究显示三氯生可以激活小鼠肝癌细胞Hepa1c1c7中的PPARα[4];动物实验显示三氯生能够激活小鼠肝脏中的PPARα,增加细胞色素P4504A等参与脂肪酸代谢的酶的表达[14],表明三氯生可能通过激活PPARα改善NAFLD。
肝脏脂肪酸合成是肝脏脂肪的主要来源,FASN直接调控肝脏脂肪酸合成,因此,抑制FASN可以减少肝脏脂肪含量。重组腺病毒介导miRNA- 27a的过表达可以抑制肝脏中FASN mRNA的表达,从而抑制油酸钠诱导的小鼠原代肝细胞三酰甘油的积累,降低雄性C57BL/6J小鼠肝脏中三酰甘油的含量[15];此外,生物信息学分析提示FASN可能是NAFLD的治疗靶点[16],提示抑制FASN可以降低肝脏脂肪含量。笔者前期的体外实验显示三氯生可以抑制肝细胞FASN mRNA和蛋白水平,减少细胞内脂肪含量[17],表明三氯生可以通过抑制FASN改善NAFLD肝脏脂肪变性。但KEGG分析并未富集到FASN等与脂肪酸合成途径相关的通路,但分子对接结果显示三氯生可以与FASN稳定结合,因此不能简单否定三氯生对FASN的抑制作用。肝脏脂肪酸代谢主要包含脂肪酸的来源与排出两个重要环节,其中FASN介导肝脏脂肪酸从头合成,是肝脏脂肪重要来源;PPARα调控脂肪酸氧化,是肝脏脂肪减少的关键途径;脂肪酸合成与氧化的紊乱则被认为是NAFLD的关键发病机制[2]。若能抑制脂肪酸摄取与合成、增强脂肪酸氧化代谢,理论上可以达到治疗NAFLD的效果。然而,单独激活PPARα增强脂肪酸氧化会导致脂肪酸过氧化物酶体β氧化和内质网ω氧化代偿性增加,产生活性氧加速疾病进展[2];而肝脏从头合成的脂肪酸是激活PPARα的重要配体,完全敲除肝脏FASN会导致小鼠肝内脂肪酸生成障碍,使PPARα因缺乏配体无法被激活,脂肪酸因此无法被正常氧化分解,引起肝脏脂肪变性[18],因此,同时抑制FASN和激活PPARα,可避免上述单靶点治疗NAFLD的不足,是极具希望的联合靶点治疗方向。
肝细胞气球样变、肝脏脂肪变性是NAFLD基本病理改变[19],本研究模型组小鼠肝脏HE染色显示肝脏出现大量脂滴空泡伴气球样变,三氯生组小鼠肝脏脂滴空泡几乎消失。油红O可将肝脏脂滴染为橘色,以此可直接观察肝脏脂肪沉积,本研究模型组可见大面积的大颗粒橘红色脂滴,三氯生干预后脂滴面积减少、颗粒显著减小,表明三氯生可以有效降低肝脏脂肪含量。这些结果提示三氯生可以有效改善NAFLD小鼠肝脏病变。进一步对PPARα的表达水平进行检测,结果显示高脂饮食增加NAFLD小鼠肝脏PPARα蛋白水平的表达,表明NAFLD小鼠肝脏脂肪酸分解加强,这是由脂肪过度沉积引起的代偿反应[2];在三氯生处理后,小鼠肝脏的PPARα蛋白水平与模型组相比增加,表明三氯生可以促进PPARα水平增加,可能通过激活PPARα改善NAFLD。
借助网络药理学,本研究预测到三氯生可能激活脂肪酸氧化的新的关键调控蛋白PPARα,并在动物实验中首次揭示三氯生治疗NAFLD的作用,验证三氯生可以提高PPARα蛋白表达水平。这些结果提示三氯生可能具有“双管齐下”减少肝脏脂肪含量的潜力,是既可减少脂肪酸合成还可能增加脂肪酸氧化分解的双靶点药物候选。事实上,双靶点药物是更具价值和希望的NAFLD治疗药物的开发方向,本研究为将三氯生开发成为NAFLD双靶点药物提供了重要依据。网络药理学挖掘的靶点仅为理论的作用靶点,必须进行严格的动物实验与临床检验[20],因此,在临床中阐明三氯生的治疗效果是未来的必经之路。
