洋葱总皂苷含量测定条件优化及其体外抗肿瘤活性研究*
2022-05-16樊孔明蔡仁明杨璐菡姚秋艳张世鹏杨春艳
樊孔明,蔡仁明,杨璐菡,姚秋艳,张世鹏,林 勇,杨春艳△
(1. 川北医学院药学院·川北医学院药物研究所,四川 南充 637100; 2. 川北医学院基础医学创新研究平台,四川 南充 637100; 3. 川北医学院形态研究所,四川 南充 637000; 4. 川北医学院临床医学系,四川 南充637000; 5. 川北医学院公共卫生学院,四川 南充 637100)
洋葱Allium cepaL. 为药食两用植物,含有皂苷、多酚、有机硫化合物等化学成分,具有抗菌、抗氧化、抗炎、抗糖尿病、调血脂、抗高血压、免疫保护等作用[1-10],还具有促进人成纤维细胞增殖、诱导组织再生和促进伤口愈合的潜在药理学活性[11]。皂苷的含量测定方法包括高效液相色谱法、比色法、薄层扫描法、原子吸收法等,其中比色法使用历史悠久、应用较普遍[12-13],其显色体系主要包括香草醛-浓硫酸或高氯酸、盐酸二甲氨基苯甲醛试剂、茴香醛试剂、对二甲氨基苯甲醛- 磷酸等[14]。目前,尚未见关于优化洋葱总皂苷含量测定显色条件的报道,洋葱抗肿瘤活性的研究也鲜有报道。本研究中采用香草醛- 浓硫酸比色法,利用硫酸氧化皂苷与香草醛进行反应,通过单因素试验确定了最佳显色条件,并评价了该提取物对A549 细胞、HeLa 细胞、HepG2 细胞体外生长的抑制作用。现报道如下。
1 仪器、试药与细胞
1.1 仪器
FA2004 型电子分析天平(上海良平仪器仪表有限公司,精度为0.0001 g);HH-2k4型恒温水浴锅(巩义市予华仪器有限责任公司);KQAQ 型中国超声波专业清洗仪器(东莞市科桥超声波设备有限公司,功率为500 W,频率为40 kHz);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);SHB-Ⅲ型循环水真空泵(河南金傅仪器制造有限公司);AG - 9620A 型精密鼓风干燥箱(上海柏欣仪器设备厂);N4型紫外分光光度计(上海仪电分析仪器有限公司);QE - 500 型粉碎机(武义县屹立有限公司);UPH - Ⅱ- 10T 型优普超纯水制造系统(四川优普超纯科技有限公司);Multiskan Go 型全波长酶标仪(赛默飞世尔科技有限公司);3111型CO2细胞培养箱(美国Thermo Forma 公司);CDKX4 型荧光倒置显微镜(日本奥林巴斯公司)。
1.2 试药
紫皮洋葱(市售);薯蓣皂苷元对照品(批号为20210305,纯度不低于98%),紫杉醇对照品(批号为20210316,纯度不低于99%),香草醛对照品(批号为20210325,纯度不低于98%),均购自北京索莱宝科技有限公司;Dulbecco's Modified Eagle's Medium(DMEM,批号为20210311),热灭活胎牛血清(FBS,批号为20210316),0.25%胰酶- 乙二胺四乙酸消化液(批号为20210210),二甲基亚砜(DMSO,批号为20210115),均购自武汉博士德生物工程有限公司;CCK-8 试剂盒(上海碧云天生物技术有限公司,批号为20210402);浓硫酸、冰醋酸均为分析纯,购自成都市科隆化学品有限公司;95%乙醇(成都蜀都实业有限责任公司);其他试剂均为分析纯,水为自制超纯水。
1.3 细胞
A549细胞(批号为20200108),HepG2细胞(批号为20200213),HeLa 细胞(批号为20200115),均由川北医学院医学影像研究所提供。
2 方法与结果
2.1 样品及溶液制备
洋葱粉末:取新鲜紫皮洋葱,切片,置65 ℃烘箱中干燥至恒重,粉碎,于干燥器内保存,备用。
供试品溶液:取干燥后的洋葱粉末800.0 g,加入64.5%乙醇[料液比为1∶10(m/V)],54 ℃超声提取3次,每次30 min,抽滤提取液,合并滤液,减压浓缩,蒸干得提取物466.64 g(提取率为58.33%)。取上述醇提物0.5 g,精密称定,加甲醇适量,超声使溶解,转移至100 mL 容量瓶中,加甲醇定容,即得质量浓度为5 mg/mL 的供试品溶液,用0.45 μm 微孔滤膜滤过,分装于15 mL 离心管,保存于4 ℃冰箱,备用。
对照品溶液:取薯蓣皂苷元对照品5 mg,精密称定,加甲醇适量,超声使溶解,转移至5 mL容量瓶中,加甲醇定容,即得质量浓度为1 mg/mL 的对照品溶液,保存于4 ℃冰箱,备用。
5%香草醛- 冰醋酸溶液:取香草醛对照品2.5 g,精密称定,加冰醋酸适量,超声使溶解,转移至50 mL容量瓶中,加冰醋酸定容,保存于4 ℃冰箱,备用。
2.2 数据处理及分析
采用Excel 2013软件统计并分析数据,采用GraphPad Prism 8.3.0 软件和Adobe Photoshop CS4 软件绘图。所有试验均平行测定3次,且至少重复2次。
2.3 最大吸收波长确定
分别精密量取2.1 项下洋葱醇提物供试品溶液、薯蓣皂苷元对照品溶液和甲醇(空白对照)各0.1 mL,分别置试管中,80 ℃水浴挥干溶剂,冰浴条件下加入5%香草醛- 冰醋酸溶液0.2 mL 和80%硫酸0.8 mL,70 ℃水浴加热15 min,冰浴10 min,转移至5 mL容量瓶中,加冰醋酸定容,室温静置15 min[15],于370 ~700 nm波长范围内扫描。结果薯蓣皂苷元对照品溶液和洋葱醇提物供试品溶液分别于455 nm 和470 nm 波长处有稳定的最大吸收峰,故最终确定检测波长为455 nm。紫外吸收光谱图见图1。
2.4 单因素试验优化显色条件
精密吸取2.1项下供试品溶液0.1 mL,参考文献[15]进行显色反应。采用单因素试验分别考察不同反应时间(5,10,15,20,25 min),不同反应温度(60,65,70,75,80 ℃),不同5%香草醛- 冰醋酸用量(0.1,0.2,0.3,0.4,0.5 mL),不同80%硫酸用量(0.6,0.7,0.8,0.9,1.0 mL),不同冰浴时间(5,10,15,20,25 min)对洋葱醇提物中总皂苷含量测定的影响。单因素试验的固定值为反应时间15 min,反应温度70 ℃,5%香草醛-冰醋酸用量0.2 mL,80%浓硫酸用量0.8 mL 和冰浴时间10 min。若有2个或以上因素对含量测定影响大,则采用响应面试验进一步优化该显色条件。结果见图2。
由图2 A 可知,供试品溶液的吸光度在反应时间不超过15 min 时明显增大,反应时间超过15 min 时吸光度开始缓慢上升,故确定最佳反应时间为15 min。由图2 B可知,供试品溶液的吸光度在反应温度不超过75 ℃时明显增大,反应温度超过75 ℃时吸光度缓慢上升,故确定最佳反应温度为75 ℃。由图2 C 可知,供试品溶液的吸光度在5%香草醛-冰醋酸用量少于0.4 mL 时明显增大,多于0.4 mL 时吸光度开始降低,故确定最佳5%香草醛-冰醋酸用量为0.4 mL。由图2 D可知,供试品溶液的吸光度在80%硫酸用量为0.6 ~1.0 mL时明显下降,故确定最佳80%硫酸用量为0.6 mL。由图2 E可知,供试品溶液的吸光度在冰浴时间不超过20 min时明显增大,超过20 min 时吸光度开始降低,故确定最佳冰浴时间为20 min。可见,对供试品溶液总皂苷含量测定影响大的因素只有5%香草醛-冰醋酸用量,故无需进一步利用响应面试验优化显色条件。因此,最终确定洋葱醇提物中总皂苷含量测定的最佳显色条件为使用5%香草醛- 冰醋酸0.4 mL 和80%硫酸0.6 mL,于75 ℃下反应15 min,冰浴20 min。
2.5 方法学考察[16-17]
线性关系考察:分别吸取2.1项下薯蓣皂苷元对照品溶液(质量浓度为1 mg/mL)30,40,50,60,70 μL,置试管中,按2.4 项下优选的显色条件进行显色反应,于455 nm 波长处测定吸光度,重复3 次,以对照品溶液质量浓度(C,mg/mL)为横坐标、吸光度(A)为纵坐标进行线性回归,得回归方程A =61.317C -0.0287(R2=0.9957,n=5)。结果表明,薯蓣皂苷元对照品溶液质量浓度在0.006 ~0.014 mg/mL 范围内与吸光度线性关系良好。
精密度试验:精密吸取2.1 项下供试品溶液适量,共6 份,于455 nm 波长处测定吸光度。结果的RSD为1.73%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取2.1 项下供试品溶液适量,在室温下分别于显色15,30,45,60,90,120 min 时,于455 nm波长处测定吸光度。结果的RSD为0.66%(n=6),表明供试品溶液在室温下放置120 min内稳定性良好。
重复性试验:取2.1项下洋葱粉末适量,精密称定,共6 份,按2.1 项下方法制备供试品溶液,于455 nm 波长处测定吸光度,并计算含量。结果洋葱总皂苷的平均含量为73.44 mg/g,吸光度的RSD为3.53%(n=6),表明方法重复性良好。
加样回收试验:取2.1 项下洋葱粉末1 g,精密称定,共6 份,分别加入10 mg 薯蓣皂苷元对照品,按2.1项下方法制备供试品溶液,分别吸取供试品溶液和甲醇(空白对照)各50 μL,置试管中,按2.4项下优选的显色条件进行显色反应,于455 nm 波长处测定吸光度,并计算回收率。结果见表1。
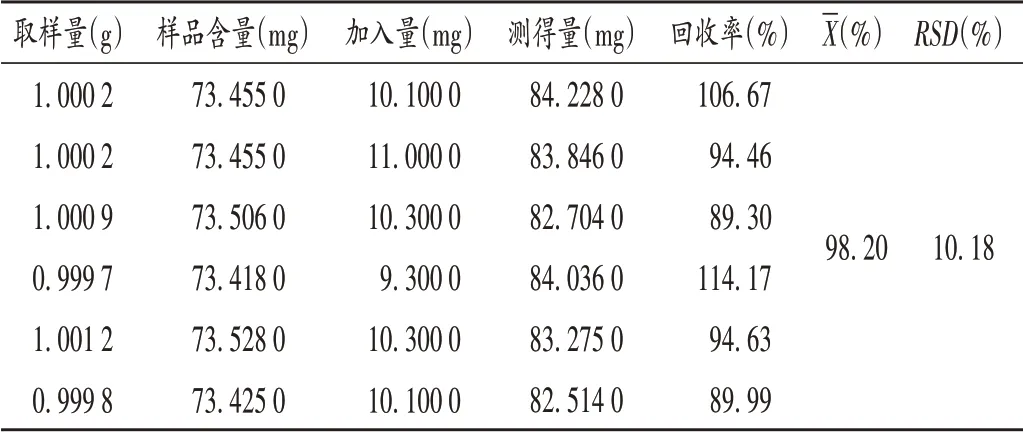
表1 加样回收试验结果(n=6)Tab.1 Results of the recovery test(n=6)
2.6 抗肿瘤活性测定
样品溶液制备:取洋葱醇提物0.4062 g,精密称定,置超净台内紫外照射消毒过夜,加DMEM 配制成质量浓度为32 mg/mL 的母液Ⅰ,4 ℃冰箱保存,备用;取紫杉醇对照品0.0020 g,精密称定,加DMSO 配制成质量浓度为10 mg/mL的母液Ⅱ,4 ℃冰箱保存,备用。
细胞培养:HepG2细胞、A549细胞、HeLa细胞均使用完全培养基[DMEM-FBS-双抗(89∶10∶1,V/V/V)],于恒定37°C、5%CO2的细胞培养箱中培养。
细胞混悬液制备:取HepG2细胞、A549细胞、HeLa细胞,处于指数生长期时消化贴壁细胞,使用完全培养液将其制备为细胞混悬液。
分组与给药:取指数生长期的HepG2细胞、A549细胞、HeLa 细胞,分别以3000 ~4000 个/孔的初始接种量接种于96孔板,每孔加入细胞混悬液100 μL,24 h后弃去培养液,药物组分别加入质量浓度为9.6,8.0,6.4,4.8,3.2,1.6 mg/ mL 的洋葱醇提物溶液(完全培养基稀释2.6项下样品溶液制备中母液Ⅰ配制而成)各100 μL,阳性对照组分别加入质量浓度为2.0000,1.0000,0.5000,0.2500,0.1250,0.0625 μg/mL 的紫杉醇溶液(完全培养基稀释2.6项下样品溶液制备中母液Ⅱ配制而成)100 μL,阴性对照加入完全培养基100 μL,每个浓度做3个复孔。
细胞活性测定:将96孔板置5%CO2、37 ℃培养箱中培养,分别于培养24 h和48 h时取出,弃去培养液,用磷酸盐缓冲液清洗1 次,每孔加入CCK-8 溶液[DMEMCCK-8(10∶1,V/V)]110 μL,37 ℃培养1.5 h,使用酶标仪于450 nm 波长处测定吸光度(OD)[18-20],按公式[抑制率(%)=(1-OD药物组或阳性对照组/OD阴性对照组)×100%]计算抑制率。结果见图3。由图3 A和图3 B可知,质量浓度为1.6 ~9.6 mg/mL 的洋葱醇提物对HepG2 细胞、HeLa 细胞、A549 细胞的活性均有一定抑制作用,作用24 h 后对上述3 种细胞的半数抑制浓度(IC50)分别为4.463,7.126,3.964 mg/mL,作用48 h 后对上述3 种细胞的IC50分别为3.371,5.551,8.988 mg/ mL;由图3 C和图3 D 可知,质量浓度为0.0625 ~2.0000 μg/mL紫杉醇作用24 h 后对HeLa 细胞的生长抑制作用最强,作用48 h后对HepG2细胞的生长抑制率接近100%。
3 讨论
3.1 洋葱醇提物总皂苷含量测定方法选择
甾体皂苷作为葱属植物中重要的活性成分,具有抗肿瘤、抗炎等作用[21-23],其含量测定具有重要意义。但甾体皂苷只有较弱的末端吸收,目前主要采用比色法测定葱属植物的总皂苷含量[24]。如陈浩等[12]以硫酸-甲醇为显色剂,采用比色法测定了大蒜提取物中总皂苷的含量。赵江琼等[13]以薯蓣皂苷元为对照品,采用香草醛比色法测定了葱白中总皂苷。LE 等[25]发现若反应溶液中存在丙酮、甲醇和正丁醇,采用香草醛-硫酸法测定会出现假阳性,故在反应前用80 ℃水浴挥干溶剂。本研究中以洋葱醇提物中含有的薯蓣皂苷元为标准品,确定洋葱醇提物总皂苷含量测定的最佳显色条件。
3.2 洋葱抗肿瘤活性研究
研究发现,洋葱提取物对HepG2细胞[26-28]、HCT-116细胞[10]、Caco - 2 细胞[26]的增殖均有一定抑制作用。YANG 等[26]考察了美国地区不同种类的10种洋葱的提取物对HepG2 细胞和Caco - 2 细胞的半数效应浓度(EC50),发现Western Yellow 洋葱对HepG2 细胞的EC50为(61.9±2.10)mg/mL,New York Bold 洋葱和Western Yellow 洋 葱 对Caco - 2 细 胞 的EC50分 别 为(30.5 ±0.8)mg/ mL 和(32.0 ± 1.0)mg/ mL。通过激活半胱氨酸蛋白酶9内源性凋亡信号通路,从而发挥对HepG2 细胞的抑制作用,质量浓度为40 mL/ L 的洋葱汁提取物处理48 h 后,细胞凋亡率为(28.3 ± 1.2)%[27]。本研究中发现,洋葱醇提物不仅可抑制HepG2 细胞的增殖,还对HeLa细胞和A549细胞的增殖有一定抑制作用。
3.3 洋葱总皂苷及其抗肿瘤活性
洋葱中主要含有呋甾烷醇类和螺甾烷醇类甾体皂苷,包括吉托皂苷元、薯蓣皂苷元、β-chlorogenin、cepagenin、(25S)-ruscogenin 等苷元[7-10]。薯蓣皂苷可通过抑制肿瘤细胞的有丝分裂、诱导其凋亡发挥较好的抗肿瘤作用[6]。研究发现,洋葱具有一定的抗肿瘤活性,提示可用于治疗和预防肿瘤;而对于其抗肿瘤活性是多种有效成分(如皂苷、多酚、硫化物等)的协同效应,还是皂苷的个别效应,有待进一步深入研究。本研究中优选的洋葱醇提物中总皂苷含量测定的显色条件对于客观评价洋葱总皂苷的含量具有一定参考意义,可为洋葱的质量控制和进一步开发利用提供参考。
