浓香型白酒大曲生产园区土壤细菌群落结构及影响因素研究
2022-05-16陈识澳饶家权李佳鑫龚利娟马振兵周丽红吕丽茹
陈识澳,饶家权,文 静,李佳鑫,龚利娟*,马振兵,周丽红,吕丽茹
(1.四川轻化工大学生物工程学院,四川 宜宾 644005;2.四川省酿酒专用粮工程技术研究中心,四川 宜宾 644005;3.舍得酒业股份有限公司,四川 遂宁 629209)
大曲是白酒生产不可缺少的发酵剂,大曲中的微生物主要来源于环境[1-2]。周天慈等[3]对新大曲微生物来源的研究发现,新大曲中大量微生物来源于原料、室内器具以及室外地面。Du等[4]在类似的研究中发现新大曲中有82 %的细菌来源于原料,10%来源于室内外地面,2%来源于室内空气。然而这些研究均是对制曲车间室内环境的研究,缺乏对于外环境的研究。制曲车间不是封闭的空间,人员的活动和空气的流通均会带动物质和微生物的流动,外环境土壤中的微生物也可通过制曲工具、人员活动、风力、浮尘等进入大曲,进而影响大曲品质。
为了解浓香型白酒制曲园区土壤细菌群落组成情况,进一步探究制曲活动对土壤微生态的影响。本研究分别对制曲园区内距离制曲车间不同距离的土壤微生物群落特征进行了分析,旨在加深对制曲环境的了解,探究土壤中微生物群落分布与制曲生产活动的互作关系,为生态酿造环境保护以及新建制曲车间选址提供一定的理论依据。
1 材料与方法
1.1 样地设置和样品采集
采样时间为夏季8月,在制曲园区内环绕制曲车间设置3个取样圈。第一圈(近距离,J)为最靠近制曲车间厂房土壤,第三圈(远距离,Y)为园区内离制曲车间最远区域土壤,第二圈(中距离,Z)介于第一圈和第三圈之间,各圈之间相距约200m。每圈设置12个取样点,每个取样点在10m2范围内采用“五点取样法”采集10~20cm深度处土壤,采样时除去土壤表面动植物残体,每个样点采集约500g土壤,充分混匀后用无菌塑料袋于 4℃保温箱保存并迅速带回实验室分析测定。
1.2 理化性质测定
混匀后的样品取一部分放置风干处理,用于理化性质测定。土壤含水量(Moisture content,MC)采用烘干法测定;pH使用pH计测定;土壤容重(Soil bulk density,SBD)采用环刀法测定;有机碳含量(Total organic carbon content,TOC)采用重铬酸钾氧化法测定;土壤全氮含量(Total nitrogen content,TN)采用凯氏定氮法测定;水有效磷含量(Available Phosphorus content,AP)采用钼锑抗分光光度法测定;速效钾含量(Available potassium content,AK)用四苯硼钠比浊法测定。
1.3 土壤DNA提取及PCR扩增
每圈层12个土样每相邻3个土样混合为一个混合样品,用于总DNA提取,共计12个混合土样。土壤总DNA提取使用购于天根生化科技(北京)有限公司的TIANamp Soil DNA Kit试剂盒,按照操作步骤进行。引物使用ArBa515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增V3-V4高变区;PCR反应体系采用Pro Taq ,20 μL反应体系:2×Pro Taq 10 μl; Forward Primer(5 μm)0.8 μm;Reverse Primer5 μm)0.8 μl;Template DNA 10 ng,补ddH2O直20 μl。PCR参数为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环后,72 ℃延伸10 min,10 ℃保持至停止,随后用2%琼脂糖凝胶电泳检测。PCR产物目的条带大小正确,浓度合适,可进行后续实验。高通量测序由上海美吉生物医药科技有限公司完成。
1.4 数据处理分析
将原始测序数据进行过滤,获得Clean Data,序列拼接使用软件FLASH(Fast Length Adjustment of Short reads,v1.2.11),利用重叠关系将双末端测序得到的成对reads组装成一条序列,得到高变区的Tags,然后利用软件USEARCH(v7.0.1090)将拼接好的Tags在97 %相似度下聚类,得到OTU的代表序列,再通过RDP classifer(v2.2)软件将OTU代表序列与数据库有比对进行物种注释,注释数据库为Silva V119。置信度阈值设置为0.8,将所得结果以最小样品序列数抽平,然后进行后续分析。
理化数据统计分析使用SPSS 23进行,理化数据组间差异使用单因素ANOVA检验,显著水平设定为0.05;Mothur 1.30用于Alpha(α)多样性指数分析,使用丰富度指数Chao指数和多样性指数Shnnon指数分析土壤微生物的alpha多样性;使用R 3.3.1语言vegan包进行NMDS(Non-metric multidimensional scaling)及冗余分析(Redundancy analysis,RDA)并绘图,使用stat包进行属水平组间差异物种分析,将显著差异物种按序列数绘制热图并进行聚类,使用vegan包将聚类后的种群和理化因素进行Mantel tests分析。
2 分析与讨论
2.1 制曲园区土壤理化性质分析
不同距离的土壤理化性质差异较大(表1)。近距离土壤全氮、有效磷、速效钾含量均显著高于远距离土壤;有机碳含量中距离土壤最高,近距离土壤次之。整体来看,土壤营养水平与距离呈负相关。近距离土壤情况为紧实度高,含水量低,营养物质丰富;中距离土壤pH低,水分含量高,营养物质丰富;远距离土壤pH高而营养物质较缺乏。可见制曲活动影响了制曲车间附近土壤的理化性质。
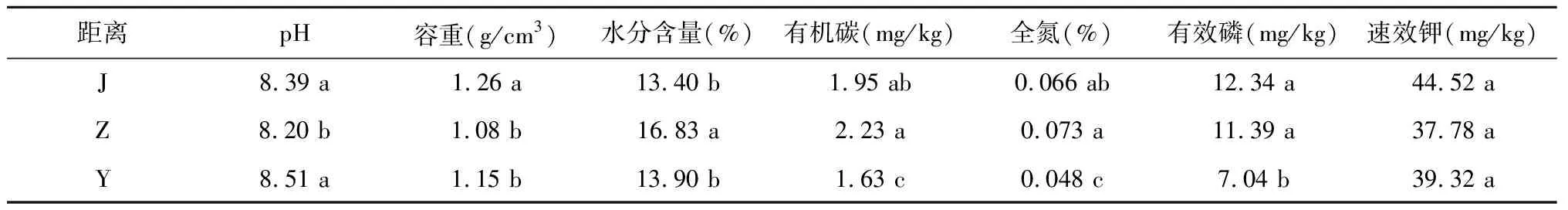
表1 制曲园区土壤理化性质测定结果
2.2 测序数据统计
以最小序列数样品为基准抽平后,各样品平均序列数为76198,制曲园区土壤共检测出39个门,124个纲,290个目,419个科,643个属细菌。在属水平构建物种累计曲线(Species accumulation curves,SAC)和稀释曲线(Rarefaction curve,RC)见图1。结果显示,随着测序样品的增加,出现新细菌属的数量逐渐减少,第12个样品时不再出现新属,说明测序样品数量较为充足;随着测序深度的增加各样品稀释曲线逐渐平缓,说明测序深度合理。
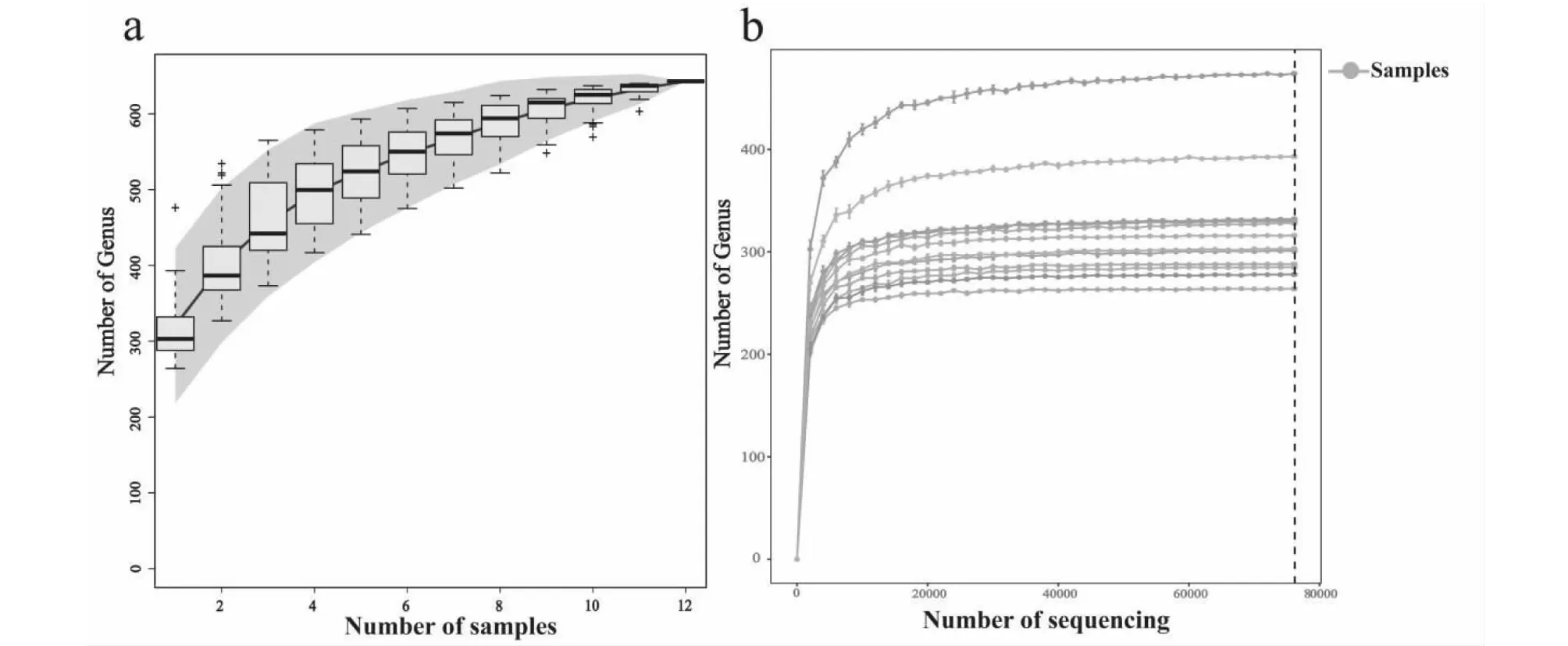
图1 属水平SAC和RC
2.3 土壤细菌群落α多样性分析
近距离土壤细菌丰富度(Chao指数)显著低于中、远距离,土壤细菌丰富度与距制曲车间的距离正相关;远距离土壤细菌Shannon指数最高,但不同距离土壤细菌Shannon指数差异不显著(表2)。近距离土壤细菌群落受到更严重的筛选,从远距离到近距离土壤细菌群落可能是一个选择性富集的过程。周森在研究中发现,从曲房室外的地面到曲房内环境微生物多样性逐渐降低,由此提出曲房室外到曲房室内是微生物菌种选择性富集的过程[5],土壤细菌从远距离到近距离可能也是一个类似的选择性富集过程。
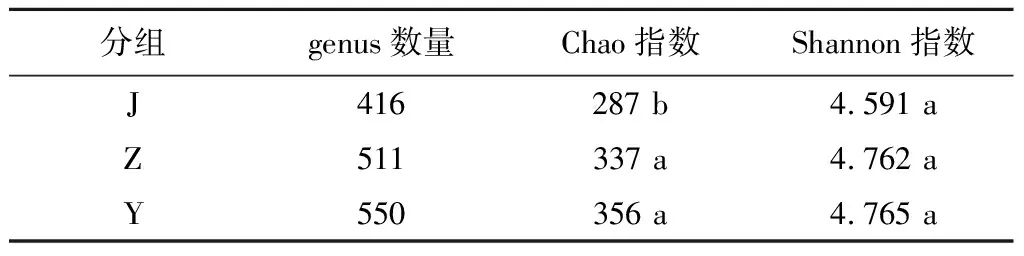
表2 土壤细菌alpha多样性指数
2.4 制曲园区土壤群落组成结构分析
分别统计制曲园区土壤门水平和属水平的优势菌(图2-a)。在门水平上,不同距离土壤优势菌种类相同,均以变形杆菌门(Proteobacteria)酸杆菌门(Acidobacteriota)和浮霉菌门(Planctomycetota)为主,三者累计相对丰度超过50 %。其中变形杆菌门酸杆菌门均是土壤中常见的细菌[6]。近距离土壤优势菌群所占总比例最高,近距土壤浮霉菌门和Methylomirabilota相对丰度高于其他区域,Methylomirabilota相对丰度与距离负相关,而远距离土壤Gemmatimonadota相对丰度最高;近距离土壤优势菌群所占总比例最高,这体现了微生物的选择性富集。在属水平上,不同距离土壤优势菌见图2-b,优势属主要包括g_norank_f_Vicinamibacteraceae、g_norank_f_Gemmatimonadaceae(芽单胞菌科)、小梨形菌属(Pirellula)、g_norank_f_Gemmataceae(出芽菌科);近、中距离土壤富集了更高丰度的小梨形菌属、鞘氨醇单胞菌Sphingomonas、Candidatus_Udaeobacter、Candidatus_Xiphinematobacter,而远距离土壤Nitrospira、norank_f_Gemmatimonadaceae相对丰度最高。从优势菌的角度来看,与制曲车距离的增加改变了优势菌的相对丰度,而没有使得优势菌种类发生变化。
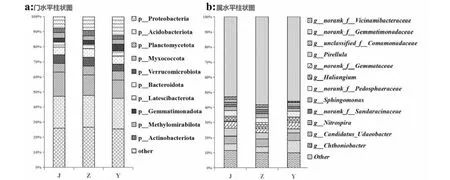
图2 制曲园区土壤门水平和属水平优势菌群
2.5 不同距离土壤细菌群落差异及影响因素分析
NMDS用于分析群落间的相似性和差异性,分析结果stress=0.145,NMDS模型较好(图3-a)。结果显示不同距离土壤群落差异显著(R=0.468),近、中距离土壤细菌群落组成更相似。RDA用于分析影响细菌群落组成的理化因素(图3-b),结果显示,土壤理化性质共解释了74.9 %的细菌群落差异,其中pH和全氮含量显著影响了土壤细菌群落结构,解释率分别为19.5%(P=0.022)、15%(P=0.03);速效钾含量对细菌群落结构的影响也较大(表3)。可见土壤理化性质显著影响了土壤细菌群落结构,而pH、全氮和速效钾含量共同起着主导作用,这与前人的研究结果相似[7]。pH通过影响微生物对营养的利用、胞外酶的产生和分泌等影响微生物群落结构[8]。
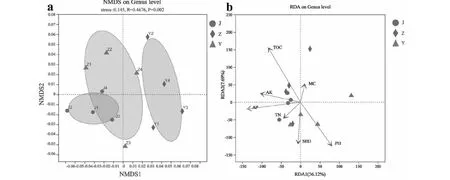
图3 属水平NMDS及RDA分析
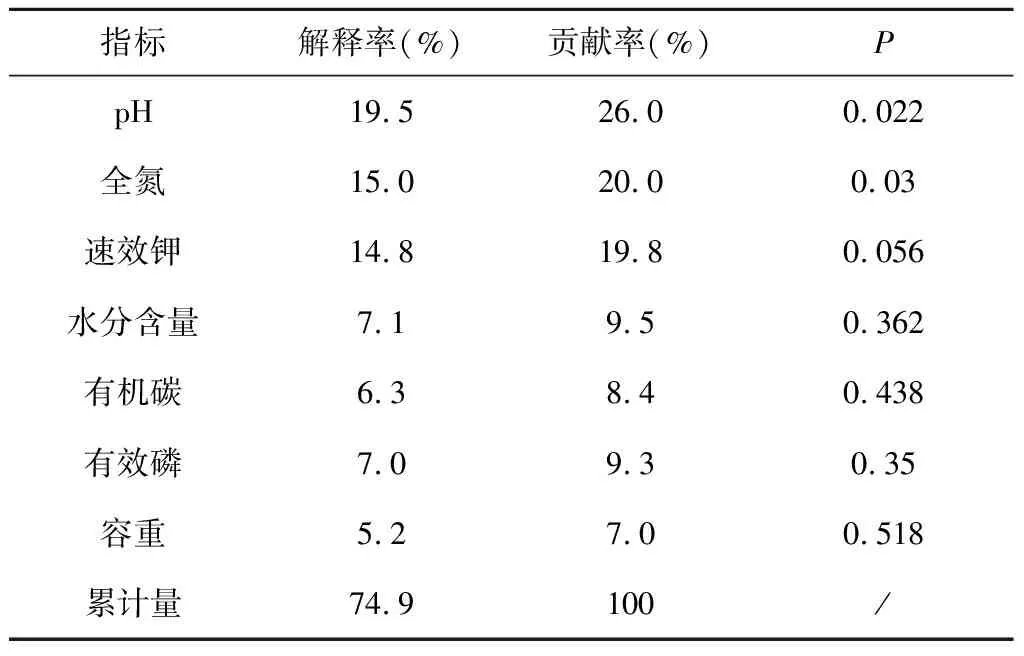
表3 RDA分析结果
2.6 不同距离土壤细菌差异物种分析
为了探究制曲活动对制曲园区土壤微生物种类的影响,在属水平上,使用Kruskal-Wallis H test对不同距离土壤进行组间差异分析,得到了15种各组间相对丰度差异显著的菌属(P<0.05),然后按序列数绘制热图并进行聚类分析,详见图4。聚类分析将15种差异菌属划分为G1(Group 1),G2(Group 2),G3(Group 3)3个群体,G1代表在远距离土壤富集的菌属,包括norank_f_Gemmatimonadaceae,瘤胃球菌属(Ruminococcus)、unclassified_f_Polyangiaceae、Alterococcus。Group 2(G2):代表在中距离土壤富集的菌属包括norank_f_Methyloligellaceae、Phenylobacterium和Stenotrophobacter。Group 3(G3):代表在近距离壤中富集的菌属。

图4 不同距离土壤差异菌属分析
2.7 差异菌属与理化性质的相关性分析
为了探究不同距离土壤差异菌属的影响因素,对3个代表菌群(G1-G3)与理化性质进行Mantel tests分析,结果如图5所示。结果显示,速效钾含量是造成远距离土壤产生差异菌属的主要理化因素,有机碳含量是造成中距离土壤产生差异菌属的主要理化因素,近距离土壤差异菌属则受pH、有效磷和速效钾含量共同作用。此外,pH与土壤全氮、有机碳含量显著负相关,有效磷与速效钾含量显著正相关。可见造成不同距离土壤菌属差异的理化因素不尽相同,近距离土壤菌属受pH、有效磷和速效钾含量影响显著,中距离土壤菌属则主要受有机碳含量影响,因此,针对不同的区域应采取不同的防控保护措施。
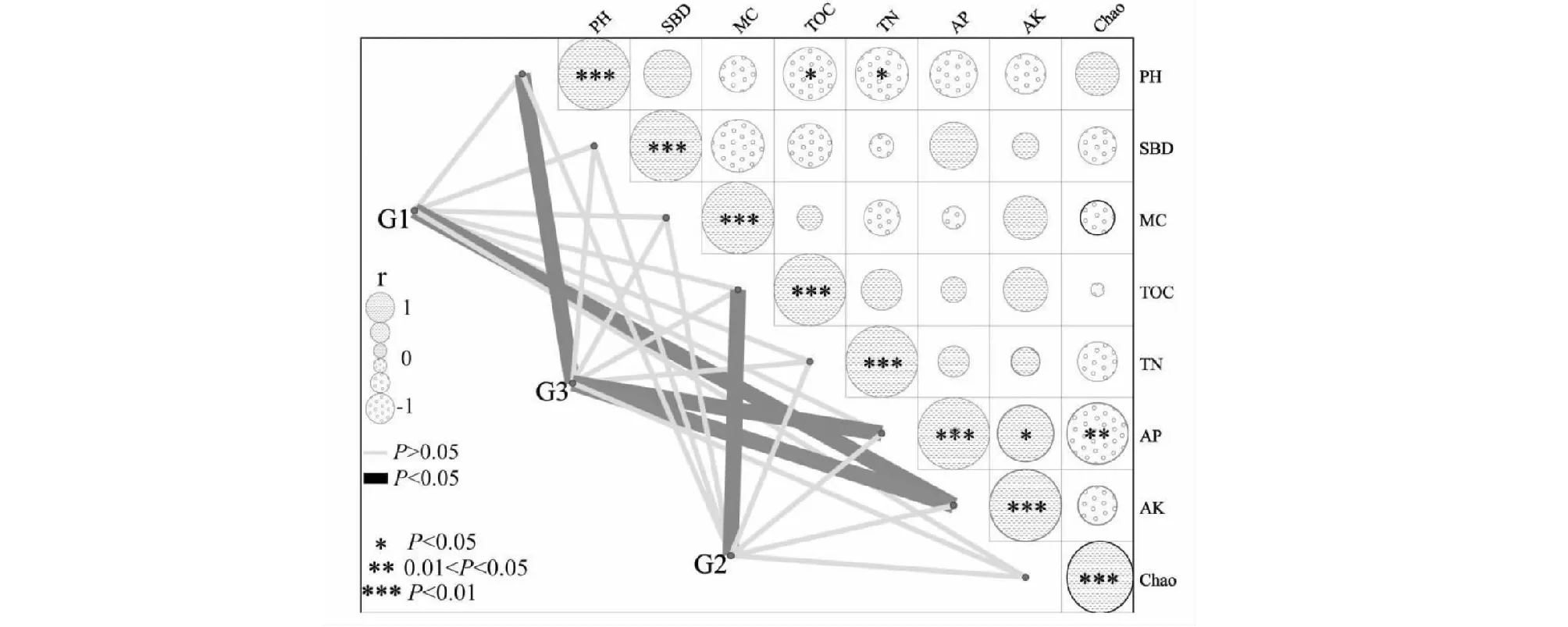
图5 差异菌属与理化性质Mantel tests
3 结论
制曲车间不是密闭的空间,空气、人员等的流动等带动制曲车间物质和微生物的转移,影响土壤理化性质以及土壤微生物群落。制曲原料在运输、生产过程中的洒落以及人员流动频繁是近距离土壤营养物质显著高于其他区域的主要原因,而近距离土壤丰富的营养物质扩大了优势菌群的优势(优势菌所占比例与距离负相关),优势菌群大量繁殖造成近距离土壤细菌Chao指数降低(表2),而制曲活动使得Chthoniobacter、Candidatus_Xiphinematobacter等菌属在制曲车间附近富集。本研究发现,制曲活动对土壤微生物的影响随距离的增加而减弱,从近距离到远距离,细菌群落差异逐渐增大,近中距离细菌群落结构更为相似,这种相似性具体体现在优势菌所占的比例和差异菌属相对丰度相近上。因此,在曲车间附近一定的范围如中距离范围(200m)内建立生态保护区域,避免农业和其他工业生产活动的进行,对于保护制曲生态环境有着重要意义。
制曲活动带动制曲园区的物质流动,影响了土壤理化性质,进而影响了土壤微生物的种类及相对丰度,而制曲活动对土壤的影响与距离负相关;制曲车间附近(近距离)土壤营养物质丰富,细菌丰富度较低;通过RDA分析确定了影响制曲园区土壤细菌群落结构的主要理化因素是pH、全氮含量和速效钾含量。研究加深了对制曲环境的认识,为酿酒、制曲生态环境保护和新厂区选址提供了研究方向和理论依据。
