细胞焦亡调控肿瘤免疫微环境的分子机制研究进展
2022-05-16黄小侠
董 婧 王 耀 黄小侠 李 林
(沈阳农业大学 动物科学与医学学院,沈阳 110866)
犬猫作为伴侣动物,深受大众喜爱,随着饲养条件和宠物诊疗技术的进步,寿命逐渐延长,但宠物肿瘤的发病率逐年增加,给宠主带来巨大的经济压力和心理压力。我国犬的肿瘤病例数量呈逐年增长趋势,数据显示在全国范围内,1983—2000年有536例,2000—2012年有1 163例,2018—2020年沈阳市宠物医院收治犬肿瘤病例数量达1 225例。癌症是犬最常见的死因之一,美国的一项犬尸检统计报告显示,2 002只犬中,23%死于癌症,而10岁以上高达45%。我国宠物临床上,犬乳腺肿瘤的发生概率最高,平均发病年龄9岁左右,是宠物肿瘤的主要类型,位居第二位的是皮肤肿瘤。犬乳腺肿瘤病例中,约有41%~53%为恶性,并有转移倾向,而猫乳腺肿瘤中85%以上为恶性或已转移。良性肿瘤可采用手术切除,恶性肿瘤即使采用手术或化疗药物治疗,也会伴随预后不良及高复发率。因此,寻找更优质的肿瘤防治方案成为兽医工作者面临的急需解决的难题。近年来对患癌犬的治疗中,肿瘤免疫调节成为一种有效的治疗策略,能有效延长患犬的生存期。
在肿瘤免疫微环境中,肿瘤细胞会受到间质细胞、间质外细胞、细胞因子、趋化因子和代谢产物等的保护,使得肿瘤细胞能够得以生存。细胞焦亡可以在肿瘤免疫微环境中对肿瘤细胞产生抑制和促进两种作用,既可以通过细胞渗透性裂解后释放出来的损伤相关分子模式(DAMPs)将肿瘤免疫微环境重新编程为免疫刺激状态,从而抑制肿瘤细胞生长和转移;又可以在炎症因子的作用下,促进肿瘤细胞生长。细胞焦亡可能会对肿瘤免疫微环境产生特定影响并促进免疫监视。越来越多的研究表明,可以通过化学药物治疗诱导使肿瘤细胞发生焦亡,如临床常用的紫杉醇、顺铂和阿霉素等。诱导细胞焦亡及其调控肿瘤免疫微环境的研究为抗肿瘤治疗提供了新思路。
1 细胞焦亡概述
细胞焦亡是由各种炎性体触发的溶解性及程序性细胞死亡,通过诱导癌细胞死亡或引发抗癌免疫在癌症进展中起重要作用。细胞发生焦亡时会释放大量的细胞内容物,如促炎因子和溶酶体,从而产生炎症级联反应,其特点是细胞形态逐渐扁平,线粒体和溶酶体受损,细胞核浓缩,DNA断裂降解,染色质凝聚,细胞膜形成膜孔,细胞逐渐膨胀至质膜破裂。细胞焦亡可以通过典型的含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)炎性途径和非经典的Caspase-4、5(人)和Caspase-11(鼠)途径完成。同时,Wang等证明Caspase-3通过裂解Gasdermin E(GSDME)参与细胞焦亡的调控。细胞焦亡失调可能会导致病原体清除效率降低和功能紊乱,从而无法刺激适应性免疫防御系统,导致组织受损。焦亡通路的关键GSDMs在许多癌症组织中处于沉默状态,即无法发挥其功能,因此对细胞焦亡分子生物学机制的深入研究有望为宠物临床提供一种前景广阔的新型治疗方法。
2 细胞焦亡的分子机制
2.1 介导细胞焦亡的关键因素
2
.1
.1
炎性小体炎性小体是由胞浆内识别受体(PRRs)介导组装的多聚体蛋白复合物,为天然免疫系统的主要组成成分。炎性小体包含传感器、适配器和酶原3个结构,种类多样,主要有核苷酸寡聚化结构域(NOD)和富含亮氨酸重复序列(LRR)的受体NLR、黑色素瘤2(AIM2)样受体ALR以及三联基序(TRIM)家族的成员Pyrin/TRIM20。炎性小体能够识别病原相关分子模式(PAMPs)和DAMPs,并由包括NLR、AIM2或Pyrin在内的传感器来招募含有胱天蛋白酶募集结构域(CARD)的凋亡相关斑点样蛋白(ASC),形成多聚体复合物,将Pro-caspase-1募集到复合物中形成活化的Caspase-1,诱导其切割GSDMD并促进白介素等细胞因子的成熟。有研究显示,NLRP1b可被炭疽致死因子直接切割,诱导N末端降解激活Caspase-1。NOD样受体(NLR)家族CARD结构域3(NLRC3)通过p38信号通路负调控树突状细胞(DCs)的抗原呈递功能,可作为治疗诱导过敏和自身免疫的误导性适应性免疫反应的潜在靶标。NLRC4对细胞质鞭毛蛋白以及细菌3型分泌系统的蛋白有反应,防御肠道内外病原体的入侵。NLRP4被证实可以抑制肿瘤坏死因子-α(TNF-α)和白细胞介素1β(IL-1β)介导的核因子-κB(NF-κB)激活,是病毒感染过程中诱导免疫反应的关键介质。AIM2被证明有助于监控和清除DNA损伤,通过药物靶向AIM2可能在放射治疗期间具有益处。
2
.1
.2
Caspase家族Caspase家族是一组存在于细胞质溶胶中的半胱氨酸蛋白水解酶。Caspase以无活性的酶原状态存在,在哺乳动物体内至少发现16种,其活化状态特异性地裂解天冬氨酸残基后的肽键,切割不同的底物来实现细胞凋亡和细胞焦亡等不同的细胞死亡类型。其中研究较为广泛的Caspase可以分为介导细胞凋亡的启动者Caspase-2、8、9、10和细胞凋亡的执行者Caspase-3、6、7以及介导细胞焦亡的Caspase-1、3、4、5、8、11。研究表明,介导细胞焦亡的Caspase成员可以被炎性小体激活,使细胞膜形成孔膜,进而实现对靶细胞的杀伤作用。
2
.1
.3
Gasdermin家族Gasdermins(GSDMs)是一类功能多样、结构保守的蛋白家族,在胃肠道、皮肤和免疫细胞等多种组织细胞中表达。在人体内,GSDMs包含GSDMA-E和PJVK(或常染色体隐性耳聋59型,DFNB59)。在小鼠体内,GSDMs包括GSDMA的3个同源物(GSDMA1-3)、GSDMC的4个同源物(GSDMC1-4)、GSDMD-E和PJVK。GSDMs蛋白全长处于自抑制状态,除了PJVK,均可由Caspases切割成N末端(GSDM-NT)和C末端(GSDM-CT)2个部分。GSDM-NT与细胞膜内小叶结合,形成内径10~14 nm 的膜孔,破环细胞离子梯度,使直径为4.5 nm 的IL-1β和7.5 nm的Caspase-1通过,诱导细胞焦亡。GSDMA主要在人的胃肠道、皮肤、食道和胃中表达。小鼠GSDMA3-NT与细胞膜上的心磷脂和磷酸肌醇相互作用形成孔,触发细胞焦亡。GSDMB主要在胃肠道、肺、淋巴细胞、肝脏、结肠和食管上皮等组织中有高表达。颗粒酶A(GZMA)能切割GSDMB,释放GSDMB-NT诱导细胞焦亡。Caspase-1在D236位点切割GSDMB也可释放GSDMB-NT诱导细胞焦亡。另一项研究显示,GSDMB可促进Caspase-4活性,与Caspase-4的CARD结构域结合,促进GSDMD释放GSDMD-NT,诱导细胞焦亡。Chao等研究表明,凋亡执行者Caspase-3、6、7能够切割GSDMB,释放GSDMB-NT诱导细胞焦亡。GSDMC主要在人的胃肠道、气管、脾脏、食管和胃上皮细胞中表达,在鼠的胃、小肠、结肠和盲肠中也有表达。Hou等研究表明,Caspase-8可以特异性切割GSDMC,将TNF-α诱导的乳腺癌细胞凋亡转变为细胞焦亡。GSDMD主要在皮肤、食道、胃和免疫细胞中表达,主要用于治疗细菌感染。在炎性小体的激活下,Caspase-1会切割高表达的GSDMD,释放GSDMD-NT诱导巨噬细胞、单核细胞和树突状细胞等发生焦亡。另外,胞质脂多糖(LPS)通过激活Caspase-4、5、11切割GSDMD也会诱导焦亡发生。GSDMD成孔释放危险信号和炎症因子,募集免疫细胞消除病原体。GSDME常见于癌症靶向疗法,可在大脑、心脏、肾脏和胎盘中检测出来,一般在正常细胞中表达,而不同癌细胞中由于受其启动子甲基化表达水平较低或不表达。GSDME可以被Caspase-3切割,诱导细胞焦亡。此外,颗粒酶B(GZMB)在接头区域切割GSDME也会诱导细胞焦亡。目前文献报道较多的GSDMs家族蛋白有GSDMB-E如表1所示。GSDMs作为致癌基因或抑癌基因参与癌症的发生发展,可作为癌症患者早期筛查、疗效评价和临床预后预测的前瞻性生物标志物,特别是与免疫治疗相结合,在肿瘤治疗方面具有广阔的前景。
2.2 激活细胞焦亡的重要途径
2
.2
.1
经典的细胞焦亡途径经典细胞焦亡作为最早被研究的焦亡途径,已经被人们所熟知,由炎性小体激活Caspase-1介导是其主要特征。当细胞受到PAMPs和DAMPs刺激时,PRRs接收危险信号分子,并通过Pyrin结构域(PYD)募集含有CARD的ASC,将炎性体传感器与Pro-caspase-1桥接,从而激活Caspase-1。活化的Caspase-1将GSDMD切割成N末端和C末端,N末端片段易位到质膜,与质膜上的心磷脂和磷酸肌醇相结合,使质膜出现寡聚化蛋白孔洞,进一步促进炎性因子的释放,随之产生细胞肿胀、破裂,最终导致细胞焦亡。激活的Caspase-1也会促进细胞内白细胞介素18(IL-18)、IL-1β前体的成熟,触发炎症反应。
2
.2
.2
非经典的细胞焦亡途径非经典的细胞焦亡途径与经典细胞焦亡途径不同,GSDMD的切割是由LPS激活Caspase-4、5(人)和Caspase-11(鼠)来完成。LPS可以直接与 Caspase-4、5、11的CARD结构域结合并使其活化,蛋白水解GSDMD,形成GSDMD-N端p30片段。同时,活化的Caspase-4、5、11可激活细胞膜上的泛连接蛋白-1(Pannexin-1)通道,释放出单价离子和ATP,激活细胞膜上的P2X7通道,形成孔隙,进而导致细胞肿胀破裂,内容物渗出,IL-1β和IL-18 释放,诱导细胞焦亡。
表1 GSDMs家族成员在机体内的功能
Table 1 The function of GSDMs family members in the organism
GSDM蛋白家族GSDMs活化酶Activating enzyme 功能Function参与焦亡途径Pathways involved in pyroptosisGSDMBCaspase-1、3、4、6、7细胞焦亡Caspase-1、3、4、6、7/GSDMB介导的细胞焦亡GZMA颗粒酶A介导的细胞焦亡GSDMCCaspase-8细胞焦亡Caspase-8/GSDMC 介导的细胞焦亡GSDMDCaspase-1焦亡、炎症、宿主防御经典的细胞焦亡Caspase-4、5、11非经典的细胞焦亡GSDMECaspase-3焦亡、抗肿瘤免疫Caspase-3/GSDME 介导的细胞焦亡GZMB颗粒酶B介导的细胞焦亡
2
.2
.3
Caspase-3/GSDME 介导的细胞焦亡途径GSDME是一种重要且新颖的线粒体成孔蛋白,可由Caspase-3切割活化,普遍用于肿瘤的治疗。当GSDME低表达或者不表达时,会发生细胞凋亡现象;当细胞内GSDME高表达时,Caspase-3能通过切割、活化GSDME蛋白导致膜孔形成,将细胞凋亡转变为细胞焦亡。GSDME在NCI-H522、SH-SY5Y和SGC-7901等肿瘤细胞系中高表达,在肿瘤治疗过程中,化疗药物使GSDME被活化的Caspase-3特异性切割成GSDME-NT和GSDME-CT两部分,分离出来的GSDME-NT识别并结合膜上的4,5-二磷酸磷脂酰肌醇,造成质膜穿孔,促进乳酸脱氢酶(LDH)和炎性物质的释放,诱导焦亡的发生。Zhang等研究证明顺铂和紫杉醇均能够促进Caspase-3切割GSDME,诱导肺癌细胞焦亡。Rogers等研究证明GSDME-NT作用后形成的线粒体孔道能够释放细胞色素C,激活凋亡小体,正反馈调节Caspase-3和GSDME的裂解,进一步促进细胞焦亡。
2
.2
.4
颗粒酶介导的细胞焦亡途径颗粒酶(GZM)是外源性丝氨酸蛋白酶,来自细胞毒性淋巴细胞(CTLs)和自然杀伤细胞(NK)释放的细胞浆颗粒。CTLs与靶细胞结合时,释放GZM和穿孔蛋白,穿孔蛋白在细胞膜上聚集,使细胞膜穿孔,为GZM进入靶细胞创造有利条件。已知GZMA/B可引起细胞焦亡,提供了触发炎性死亡的简单机制,比经典途径和非经典途径简单得多,是CTLs在抗肿瘤免疫中清除恶性细胞的关键机制。其中,活化的CTLs会释放干扰素,干扰素-g(IFN-g)可以促进GZMA在Lys处将GSDMB切割,NT成孔进而诱导细胞焦亡。GZMB可以在不需要Caspase-3参与的情况下,于D270后直接切割GSDME,诱导细胞焦亡。GZMB也可以通过激活Caspase-3间接诱导GSDME依赖性细胞焦亡。因此,GZMA/B对抗肿瘤免疫的研究具有重要意义。细胞焦亡重要途径如图1所示。
3 细胞焦亡对肿瘤免疫微环境的影响
肿瘤免疫微环境(TIME),是指在肿瘤微环境中,与T细胞、肿瘤相关巨噬细胞(TAMs)、髓源性抑制细胞(MDSCs)、NK细胞等免疫细胞相关的微环境。TIME可以分为三种类型,分别是浸润排斥的肿瘤免疫微环境(I-E TIME)、炎性浸润的肿瘤免疫微环境(I-I TIME)和三级淋巴样结构的肿瘤免疫微环境(TLS-TIME)。TIME是肿瘤微环境的重要组成部分,大多数肿瘤的形成过程都经历了由可控性炎性反应到不可控炎性反应的转变,从而产生适合其生长的微环境,促进肿瘤的增殖、侵袭、转移、血管生成及免疫逃逸。在TIME中,肿瘤细胞可以借助TIME来逃避免疫监视。通过诱导细胞焦亡可以将肿瘤微环境改变为免疫刺激状态,对于肿瘤的免疫治疗具有重要研究价值。GSDM在TIME中的作用机制如图2所示。
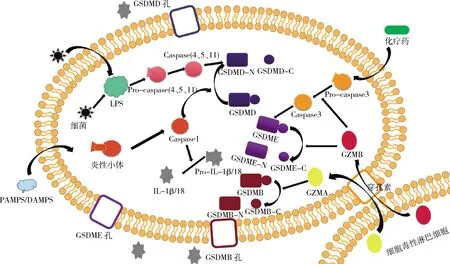
1)炎性小体识别病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),由包括NLR、AIM2或Pyrin在内的传感器来招募含有CARD的凋亡相关斑点样蛋白(ASC),上调Caspase-1,激活GSDMD,释放IL-1β/18。2)脂多糖(LPS)作用于Caspase-4、5、11,激活GSDMD,促进IL-1β/18的成熟和释放。3)化疗药物诱导Caspase-3将GSDME切割成GSDME-NT,并在细胞膜上打孔,将凋亡转化为焦亡。4)细胞毒性淋巴细胞释放GZMA/B,GZMA在Lys244处将GSDMB切割,N末端成孔进而诱导细胞焦亡。GZMB可以在D270后代替Caspase-3直接切割GSDME诱导细胞焦亡,或者通过激活Caspase-3间接诱导GSDME依赖性细胞焦亡。 1) Inflammasomes recognize pathogen-associated molecular patterns (PAMPs) and damage associated molecular pattern molecules (DAMPs). Sensors including NLR, AIM2 or pyrin recruit apoptosis-associated speck-like protein containing a CARD (ASC), up-regulate caspase-1, activate GSDMD and release IL-1β/18. 2) Lipopolysaccharide (LPS) acts on caspase-4,5 and 11 to activate GSDMD and promote the maturation and release of IL-1β/18.3) Chemotherapeutic drugs induce caspase-3 to cleave GSDME into the N-terminal and perforate the cell membrane to transform cell apoptosis into pyroptosis. 4) Cytotoxic lymphocytes release GZMA/B. GZMA cleaves GSDMB at Lys244, and N-terminal form spores and induces pyroptosis. GZMB can replace caspase-3 after D270 to directly cleave GSDME to induce pyroptosis, or indirectly induce GSDME-dependent pyrolysis by activating caspase-3.图1 4种主要焦亡途径示意图Fig.1 Schematic diagram of four main pyroptosis pathways
3.1 细胞焦亡对TIME中T细胞的影响
使用化疗药物诱导GSDME激活细胞焦亡,可以增强抗肿瘤免疫。TIME中的CD8+T淋巴细胞仅有较少的穿孔素,以至于其无法长时间穿透靶细胞。肿瘤中的GSDME可以避开CD8+T淋巴细胞,在遇到靶细胞时释放GSDME-NT结构域,插入细胞膜的内小叶并形成广泛的孔,将CD8+T细胞的毒性颗粒释放到靶细胞中,进而增加CD8+T淋巴细胞的抗肿瘤功能,将肿瘤细胞杀灭。随着毒性颗粒进入肿瘤细胞,GZMA/B直接或间接诱导肿瘤靶标中的GSDM依赖性细胞焦亡,进而形成一种免疫激活状态。可以将TIME分为T细胞缺失或排斥的“冷肿瘤”环境和T细胞浸润、免疫激活的“热肿瘤”环境。促炎细胞因子通过细胞焦亡成孔释放到TIME中,招募更多T细胞浸润,增强细胞毒性T细胞的免疫作用,使TIME由“冷”转“热”,导致激活状态的TIME能够有效地杀灭肿瘤细胞。然而,在嵌合抗原受体T(CAR-T)/GSDME免疫疗法介导靶肿瘤细胞焦亡的过程中,高迁移率族蛋白1(HMGB1)促进巨噬细胞中Caspase-1和GSDMD的激活,释放大量的IL-6和IL-1β,产生细胞因子释放综合征(CRS),降低T细胞疗法的有效性。因此,寻找最佳的细胞焦亡程度对TIME治疗是至关重要的。
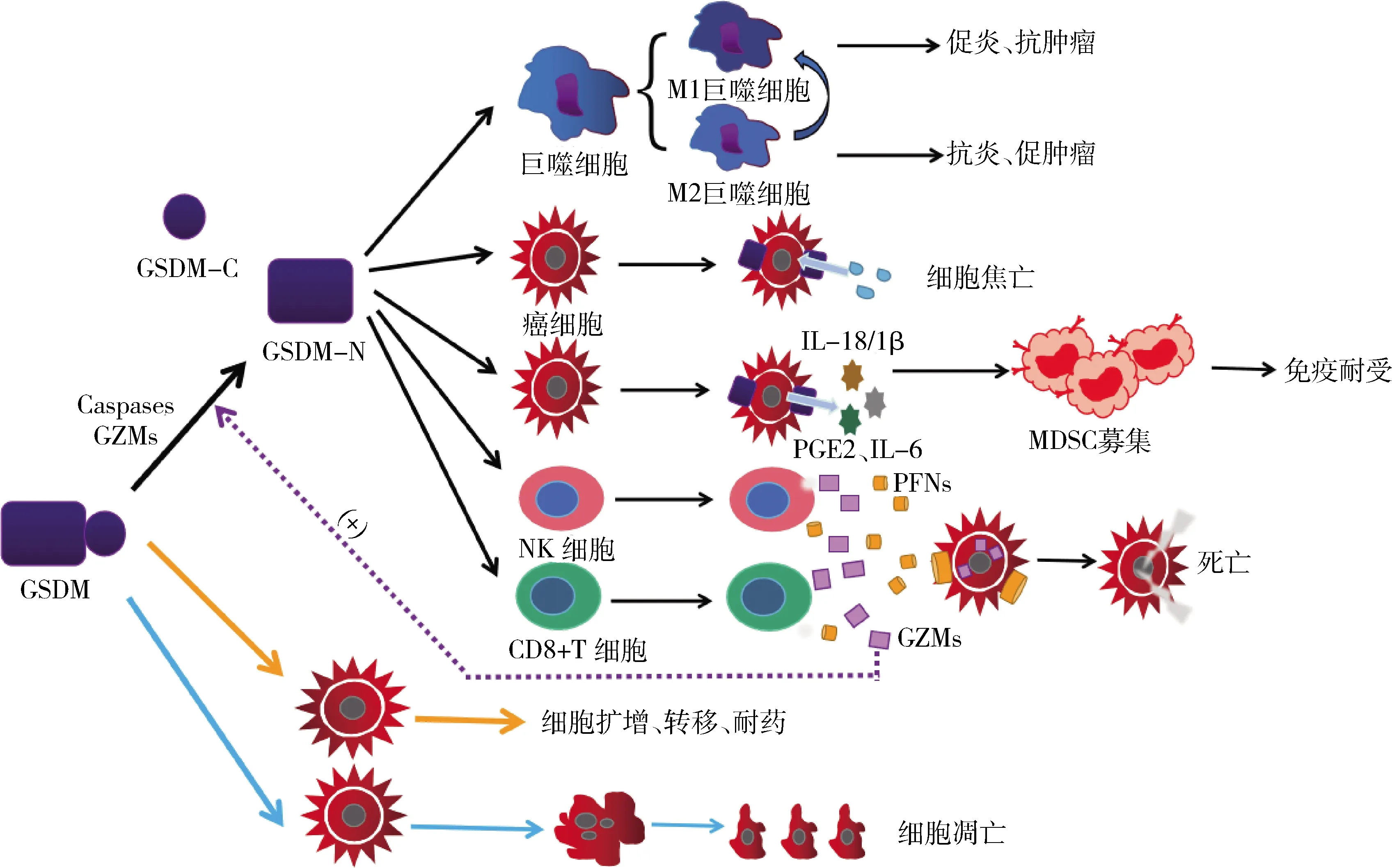
GSDM可以影响癌细胞的增殖、凋亡、侵袭、转移和耐药性。GSDM可以被Caspases和GZMs等蛋白酶切割,释放GSDM-NT。GSDM-NT能在细胞膜上打孔,诱导细胞焦亡,并作用于巨噬细胞、NK细胞、CD8+T细胞等免疫细胞协调抗癌免疫。GSDM-NT增强CD8+T细胞和NK细胞的浸润能力,并促进M2巨噬细胞向M1巨噬细胞转变。细胞焦亡产生大量的炎性因子募集MDSC,造成免疫耐受。 GSDM can affect the proliferation, apoptosis, invasion, metastasis and drug resistance of cancer cells.GSDM can be cleaved by proteases such as Caspases and GZMs to release GSDM-NT. GSDM-NT can punch holes in the cell membrane, induce pyroptosis and act on immune cells such as macrophages, NK cells, and CD8+T cells to coordinate anti-cancer immunity. GSDM-NT enhances the infiltration capacity of CD8+T cells and NK cells, and promotes the conversion of M2 macrophages to M1 macrophages. Pyroptosis produces a large number of inflammatory factors to recruit MDSC, resulting in immune tolerance.图2 GSDM在TIME中的作用机制Fig.2 The mechanism of GSDM in TIME
3.2 细胞焦亡对TIME中巨噬细胞的影响
TIME中含氧量较少,刺激嗜中性粒细胞释放各种趋化因子在炎症部位激活并募集巨噬细胞,这些巨噬细胞称为TAMs,占某些实体瘤的50%左右。TAMs分为M1和M2两种,M1与M2会以相反的方式影响免疫反应,既可以介导吞噬和氧化等抗肿瘤作用又可以为恶性细胞提供营养,两者可相互转化。在正常情况下,巨噬细胞能发挥其吞噬作用将病原体吞噬,随着巨噬细胞的生长,Caspase-3会切割GSDME产生GSDME-NT片段,靶向质膜以诱导细胞焦亡。但由于巨噬细胞的寿命较长,很多肿瘤细胞在巨噬细胞死亡前进行快速复制,将其变成为更易感染的靶标,就算是中性粒细胞也无法阻止巨噬细胞中病原体的复制,从而产生更多的病原体并释放出来。而当被炎性体激活或使用药物诱导细胞焦亡时,可以使巨噬细胞提前溶解,快速释放病原体,在其还没有复制时就暴露在清除机制中,被免疫细胞消灭。在TIME这种缺氧状态中,细胞程序性死亡配体1(PD-L1)可以与巨噬细胞产生的TNF-α相互作用,诱导Caspase-8激活GSDMC,进而促进细胞焦亡,使巨噬细胞产生诱导肿瘤细胞坏死的功能。Tan等研究表明,使用D2多巴胺受体可调节TIME,上调M1并限制NF-κB 信号通路,触发GSDME介导的乳腺癌细胞焦亡。因此,在临床治疗过程中,巧妙的运用巨噬细胞的免疫特性并联合用药,为实现靶向治疗肿瘤提供了新思路。
3.3 焦亡对TIME中髓源性抑制细胞的影响
MDSC是粒细胞、巨噬细胞和树突状细胞的前体,在病理条件下MDSC抑制免疫反应,促进肿瘤的生长、侵袭。在一些TIME中,由DAMPs触发的炎性小体NLRP3的激活促进NF-κB转录因子的易位,上调Pro-IL-18和Pro-IL-1β表达,Caspase-1介导细胞焦亡将肿瘤激活为免疫状态,释放IL-18和IL-1β等炎性因子,激活前列腺素E2(PGE2)回路诱导IL-6生成,募集MDSC,如S100A8/A9 诱导血清淀粉样蛋白A3直接在肺中募集MDSC并促进转移,HMGB1在腹部手术后大量释放,招募大量MDSC促进结肠癌腹膜转移,可见,过度的细胞焦亡产生大量炎性因子会促进MDSC的募集,导致免疫耐受。然而,Erkes等使用BRAF抑制剂和MEK抑制剂(BRAFi+MEKi)体内联合泊苷治疗中发现,通过BRAFi+MEKi处理,可诱导Caspase-3活化并切割GSDME促进细胞焦亡,在上调CD4+T和CD8+T细胞的同时,降低了MDSC的含量,减弱肿瘤的耐药性,使肿瘤细胞无处可逃。
3.4 细胞焦亡对TIME中NK细胞的影响
NK细胞是一种天然免疫细胞,可以杀伤肿瘤细胞。在癌细胞中,GSDME高表达显著增加了肿瘤内NK细胞数量,并促进NK细胞杀死肿瘤细胞,为持续的炎症微环境提供各种活性氮、活性氧、活性醛类、细胞因子、趋化因子和生长因子,将肿瘤微环境激活为免疫刺激状态,使细胞内促炎因子从焦亡细胞中快速有效地释放出来,从而引发肿瘤的炎症。同时,NK细胞对GSDME引导的焦亡也具有促进作用。在TIME中,肿瘤会逃避NK细胞所产生的凋亡,在凋亡信号通路受阻时,NK细胞常联合细胞毒性T细胞与靶细胞相互作用,产生特异性杀伤功能,并释放GZMB,代替或激活Caspase-3在D270位点后激活GSDME,促进肿瘤细胞焦亡,使毒性颗粒进入肿瘤细胞,发挥NK细胞的自然杀伤作用,抑制肿瘤生长。因此,细胞焦亡和NK细胞在TIME中的功能是互相促进的,在抗癌免疫中形成正反馈回路,将肿瘤的免疫微环境从“冷”改变为“热”。
4 展 望
细胞焦亡在肿瘤中的作用是复杂的,是一把双刃剑,影响到肿瘤发生的所有阶段。一方面,炎症小体介导的细胞焦亡和焦亡释放的细胞因子改变了肿瘤免疫微环境,且通过逃避免疫监视促进了肿瘤的发展。另一方面,细胞焦亡产生的细胞因子可以募集免疫细胞并激活免疫系统,从而提高肿瘤免疫治疗的效率。为了开发靶向细胞焦亡的肿瘤免疫疗法,需要进一步探索细胞焦亡对免疫系统的潜在功能。未来将对以下问题深入研究,①探索焦亡发挥抗肿瘤作用的其他途径及分子机制;②研究原发肿瘤发展中诱导细胞焦亡激活的因素,从而探寻避免肿瘤发生的策略;③明确细胞焦亡对免疫细胞的调节和免疫反应的功能,提高癌症治疗的效率以及探索更多的抗肿瘤疗法。
此外,细胞焦亡是由GSDMs介导的程序性细胞死亡,其在激活免疫系统方面的最新进展越来越被关注。因为GSDMs 在细胞焦亡和癌症进展中的重要功能,所以药物对其蛋白活性的正负调节成为焦亡发生后对TIME影响的关键。临床中化疗药物的副作用常限制了这些药物的使用剂量,而GSDME是抑瘤因子同时也是化疗副作用的关键分子。药物诱导不同组织细胞焦亡的广泛研究及GSDMs蛋白家族的每位成员在TIME中扮演的不同角色的深入研究将为动物癌症早期筛查、疗效评价、临床预后预测及寻找安全有效抗癌药物提供科学依据。
