LPS 诱发绵羊精子活力降低及TLR4 基因的介导作用
2022-05-16韩修远亓美玉姚玉昌
陆 奇,韩修远,赵 亮,刘 爽,亓美玉,姚玉昌*
(1.黑龙江普通高等学校动物遗传育种与繁殖重点实验室,黑龙江哈尔滨 150030;2.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030;3.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086)
精液质量是影响动物繁殖效率的重要因素。哺乳动物精子在生殖道内运行的过程中易受到细菌和病毒污染。由于大肠杆菌()、肺炎克雷伯菌()、奇异变形杆菌()等革兰氏阴性菌污染,会导致精子活力和受精能力下降,造成雌性受胎率降低,严重时雄性动物会丧失生育能力,给畜牧业生产带来严重损失。
精子活力是成功受精的基本保证。普遍认为精子中段的线粒体缺陷可能是精子活力受损的重要原因,进而影响精子顶体反应、获能、与透明带相互作用、精卵细胞融合等关键的能量依赖过程。有研究表明,精液中细菌污染主要通过增加精子中ROS 水平对线粒体功能造成损伤。适度低水平的ROS 是保证精子活力的要素,但异常高水平的ROS 将导致精子膜流动性发生不可逆的改变,造成精子活力下降,并持续破坏精子顶体反应和获能,进一步造成精子DNA 片段化。因此,精液中细菌污染可能通过损伤线粒体功能来降低精子活力。
革兰氏阴性菌细胞壁的主要成分脂多糖(Lipopoly saccharide,LPS),具有雄性生殖毒性,可诱发精子内ROS 的产生,损伤线粒体功能,进而降低精子活力。()作为LPS 的主要模式识别受体,被LPS 激活后,可在多种细胞中诱发炎症、凋亡、氧化应激等生物学反应。因此,本研究以LPS 作为模拟物处理绵羊精子,拟阐明精液中革兰氏阴性菌污染对精子活力、线粒体结构及功能的损伤,并揭示基因在此过程中的介导作用,为解析细菌侵染导致精子损伤的机制提供科学依据。
1 材料和方法
1.1 实验动物及样品收集 选择健康、体况良好、无繁殖疾病的2~3 岁德国肉用美利奴公羊8 只,其中过表达基因公羊和野生型公羊各4 只,饲养于东北农业大学绵羊新品种培育基地,每日提供全价精饲料 0.7 kg,自由采食饲草和饮水。利用常规假阴道方法采集公羊精液,经现场外观初评后,立即送至实验室检测精子活力。
1.2 精子上浮 精液经外观评定及活力检测合格后,立即使用37℃预热的精子BWW 培养液(HLCM0052,上海哈灵生物科技有限公司)完成精子上浮操作。具体操作步骤如下:精液经BWW 培养液等体积稀释后,吸取200 μL 稀释精液缓慢加于装有2 mL 培养液离心管的底部,移入37℃、5% CO环境的培养箱中倾斜45°放置30 min,使用剪掉尖端的枪头吸取适量的上浮精子悬液,用于活力及纯度检测。
1.3 上浮精子纯度鉴定 为避免精液中白细胞、上皮细胞、睾丸组织细胞等体细胞污染对精子试验产生影响,本研究采用CD4、E-Cadherin 和c-kit 基因作为细胞标志物检测上浮后精子样品。收集原精以及上浮精子样品,3 000 r/min 离心10 min 后,利用QIAGEN RNeasy Mini Kit(7410474106,Qiagen)提取总RNA,Transcriptor First Strand cDNA Synthesis Kit(04897030001,Roche)合成cDNA,具体操作步骤按照试剂盒说明书执行,产物置于-20℃冰箱保存,用于精子纯度检测。精子纯度鉴定所用的引物信息见表1,交由南京金唯智生物技术公司合成。

表1 PCR 引物序列
1.4 精子培养 将上浮纯化后的精子调整浓度至2×10/mL,置于12 孔板中,37℃、5% CO条件下培养。设置对照组、LPS(1 μg/mL)处理组(L4391,Sigma)、TAK-242(3 μmol/L)处理组(Cli095,Invivogen)和TAK-242(3 μmol/L)+LPS(1 μg/mL)共处理组,其中共处理组利用TAK-242 提前预处理30 min。每组设置3 个重复孔,分别于处理后的2、4 h 和6 h 收集样品用于后续分析。
1.5 精子活力检测 将样品放置于37℃温控板上,利用SCA 全自动精子质量分析仪(Sperm Class Analyzer)中的绵羊物种模块检测精子活力和质量。以精子活力抑制率作为评价精子活力的指标,活力抑制率=0 h 时精子活力百分数值-各检测时间点精子活力百分数值。
1.6 精子基因表达检测 利用免疫荧光方法检测精子外膜基因表达,操作过程如下:培养后的精子(1×10/mL)经推片后,PBS 浸洗3 次,BSA(A1933,Sigma)封闭2 h;一抗(AF7107,Affinity)4℃孵育过夜,加入cy3 标记的二抗避光孵育1 h,用含抗荧光淬灭剂的封片液封片,而后在荧光显微镜(Χ71,Olympus)下察看采集图像。
1.7 精子线粒体超微结构检测 将精子样品利用2.5%戊二醛和1% 锇酸固定,按照50% 乙醇8~10 min、70% 乙醇8~10 min、90% 乙醇8~10 min 和100% 乙醇8~10 min 的顺序梯度脱水,树脂包埋后切片,经醋酸铀和柠檬酸铅双染色后,利用透射电子显微镜(JEOL-1200EΧ,日本)观察精子线粒体结构并拍照。
1.8 精子线粒体膜电位检测 利用JC-1 膜电位检测试剂盒(65-0851-38,eBioScience)分析线粒体膜电位的变化,具体操作步骤如下:取1 mL 培养后的精子样品(1×10/mL),以1000 r/min 低速离心5 min 后获得样品沉淀,加入200 μL JC-1(2.5 μg/mL)工作液,将样品重悬后37℃孵育15 min,低速离心后的沉淀利用PBS 重悬,流式细胞仪上机检测(FACS Calibur,美国BD 公司)。
1.9 精子ATP 水平检测 利用ATP 合酶酶活性检测试剂盒(ab109714,Abcam)分析精子中ATP 水平,具体操作步骤如下:利用蒸馏水将ATP 标准溶液稀释为10~10mol/L 的梯度浓度,加入100 μL 细胞裂解液后,根据ATP 梯度荧光值绘制标准曲线;加入100 μL 细胞裂解液至待测精子样品中(1×10/mL),将样品荧光值带入标准曲线得到ATP 水平检测值。
1.10 统计分析 利用SPSS 18.0 软件对数据进行单因素方差分析(ANOVA)分析和Duncan 多重比较。*代表<0.05,表示差异显著;** 代表<0.01,*** 代表<0.001,表示差异极显著。所有数据均为平均值±标准误。
2 结果与分析
2.1 上浮处理后提高了精子样品的活力和纯度 研究结果表明,精子经上浮操作后精子活力提升(<0.05),由初始活力78%,提升到90%(图1)。
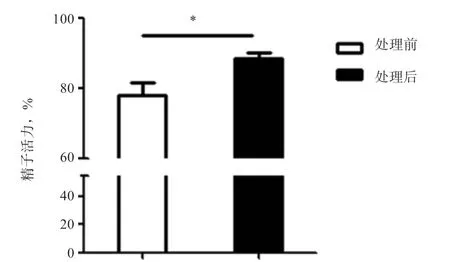
图1 绵羊精子上浮前后活力
图2 表明,精子经上浮处理后,纯度较高,无明显的白细胞(作为标记基因)、上皮细胞(作为标记基因)以及睾丸组织细胞(c-kit 作为标记基因)的污染,可用于进一步研究。
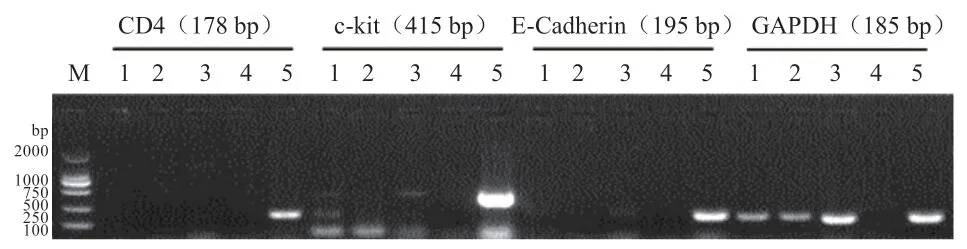
图2 上浮后精子中体细胞污染检测
2.2 LPS 对精子活力的影响 图3 表明,随着培养时间延长精子活力逐渐下降。精子经LPS(1 μg/mL)处理后,在6 h 时精子活力抑制率高于对照组(<0.001),精子活力呈现较大幅度的下降。因此,本研究后续分析均选择培养6 h 时的样品。
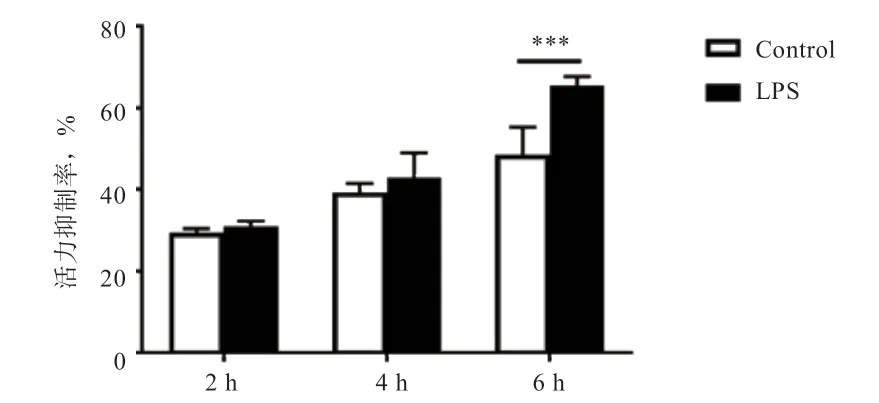
图3 LPS 处理后绵羊精子活力变化
2.3基因对LPS 诱发的精子活力下降的影响 免疫荧光染色结果表明,基因在绵羊精子外膜上表达;精子经LPS(1 μg/mL)处理后基因表达上调(<0.001),同时其表达位置发生变化,由主要表达在精子头部向尾部扩展(图4-A)。LPS 处理后6 h精子活力下降(<0.001)(图4-B、C),前向运动率和非前向运动率均降低(<0.05),不运动精子率极显著升高(<0.001)(图4-D)。但精子经LPS 处理后,过表达基因对其活力、前向运动率、非前向运动率、不运动精子率均无显著影响;利用TAK-242抑制TLR4 信号通路缓解了LPS 诱发的精子活力下降(<0.001),但对前向运动率、非前向运动率、不运动精子率无显著影响。
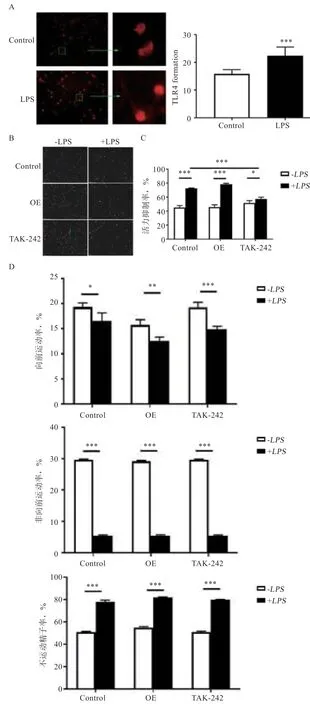
图4 绵羊精子TLR4 基因的表达及其表达水平对LPS 处理后精子活力的影响
2.4 LPS 对精子线粒体结构的影响 精子经LPS(1 μg/mL)处理后,线粒体结构发生明显变化,主要表现为线粒体排列不规则、膜间隙肿胀(Swollen,SW)和定向障碍(Disorientation,di),并产生大量液泡(Vacuole,Va)结构(图5)。

图5 LPS 处理后精子线粒体结构变化
2.5基因对LPS 诱发的线粒体膜电位和ATP 水平降低的影响 精子线粒体膜电位(JC-1)检测结果表明(图6-A),与对照组相比,精子经LPS 处理6 h 后其膜电位水平降低(<0.001),虽然过表达基因对线粒体膜电位无显著影响,但TAK-242 处理后对缓解线粒体膜电位水平降低具有明显作用(<0.05)。ATP 水平的检测结果表明(图6-B),与对照组相比,经LPS 处理6 h 后,精子中ATP 水平降低(<0.001),同样地,过表达基因对精子中ATP 水平无显著影响,而TAK-242 处理缓解了ATP 水平的降低(<0.001)。

图6 LPS 刺激后精子线粒体膜电位和ATP 变化
3 讨 论
细菌感染对动物和人类精子的发生过程造成不利影响,如金黄色葡萄球菌感染可引起少精子症(Oligospermia)、弱精子症(Asthenospermia)、畸形精子症(Teratospermia)和无精子症(Azoospermia)。大肠杆菌作为泌尿生殖系统感染的主要菌株可引起前列腺炎,造成睾丸损伤进而影响精子成熟;同时,细菌来源的LPS 也可破坏睾丸类固醇激素以及精子的发生,并诱导暂时性不育和睾丸功能障碍。细菌感染除损伤精子发生过程以外,也会导致成熟精子活力和受精能力下降,造成雌性受胎率降低,严重时雄性动物会丧失生育能力。在人类和猪上的相关研究也表明,LPS 显著影响精子的活力和凋亡,造成其穿透粘性介质的能力下降。本研究中,大肠杆菌来源的LPS 刺激绵羊精子后精子活力下降,前向运动率和非前向运动率均显著降低,不运动精子率升高,导致精液质量下降。
精子的活力与能量代谢密切相关。线粒体作为精子的主要供能单位,在ATP 和ROS 产生方面与其他细胞中的线粒体类似,还参与着精子获能以及顶体反应。对人类精子的研究表明,由细菌侵染引起的精子线粒体缺陷是导致男性不育的主要原因,将精子与支原体、溶血链球菌以及大肠杆菌共孵育后,造成线粒体的活性受损、氧化还原能力降低。线粒体出现结构损伤、ROS含量增加、膜电位降低均会造成线粒体功能障碍进而导致精子活力降低。本研究发现LPS 刺激绵羊成熟精子后,线粒体结构发生变化,表现为线粒体排列不规则、膜间隙肿胀(SW)和定向障碍(di),并产生大量液泡(Va)结构。有研究表明,线粒体结构异常会引起细胞色素氧化酶(Cytochrome Oxidase,CCO)、琥珀酸脱氢酶(Succinodehydrogenase,SDH)和乳酸脱氢酶同工酶(Lactate Dehydrogenase Isoenzyme,LDH)等多种与能量代谢相关的酶类含量发生变化,进而影响精子的能量供应,造成精子运动障碍。同时,线粒体膜电位和ATP 水平极显著降低。这与之前的报道一致,即无论是细菌还是其提纯的毒素如LPS 均可以直接或间接地负面影响精子的线粒体,引起线粒体功能下降,导致精子质量受损,从而降低精子的受精能力。正常的线粒体膜电位是保证ATP 产生的必需条件,是反映线粒体功能的主要指标,ATP 水解后释放能量维持精子的运动和活力。因此,LPS 刺激后引起精子线粒体结构和功能损伤,导致精子的活力下降,造成受精能力降低。
TLR4 作为LPS 的主要模式识别受体,可特异性识别LPS,进而在多种细胞中激活炎症、凋亡、氧化应激等生物学反应。近年来的研究表明,细菌除了通过白细胞和细胞因子等对精子造成损伤外,也可直接作用于精子进而影响精子的活力。有研究发现基因在精子顶体部位表达,白细胞精子症将引起其表达水平上调。本研究中,为阐明LPS 对绵羊成熟精子的直接作用,避免精液中白细胞、上皮细胞以及睾丸组织细胞等对试验的干扰,采用上浮法获得了高纯度的精子样品,用于进一步分析,结果表明LPS 刺激后精子表面基因表达上调,同时其表达位置由头部向尾部扩展。LPS 刺激精子后,过表达基因对精子活力、线粒体膜电位、ATP 水平均无显著影响;而抑制TLR4信号通路后,缓解了LPS 诱发的精子活力、线粒体膜电位水平和ATP 水平的降低。Barbonetti 等研究发现,LPS 可以通过TLR4/CD14 途径抑制精子线粒体膜电位,这与本实验结果相似。因此,TLR4 信号通路在介导LPS 诱发的绵羊精子活力降低、线粒体功能障碍方面扮演着重要角色。
4 结 论
本研究采用上浮法获得高活力、高纯度的绵羊精子样品,LPS(1 μg/mL)处理6 h 后,精子活力降低、线粒体结构及功能受损;同时,精子表面基因的表达上调,表达位置由头部向尾部扩展;过表达基因对精子活力、线粒体结构及功能无显著影响,抑制基因缓解了LPS 诱发的精子损伤。因此,TLR4信号通路在介导LPS 诱发的绵羊精子活力降低、线粒体功能障碍方面扮演着重要角色。
