蜂王浆对低温保存绵羊精子质量和糖转运蛋白GLUTs 表达的影响
2022-05-16牛宏泽马政禹靳天宇任有蛇
牛宏泽,马政禹,靳天宇,石 磊,任有蛇
(山西农业大学动物科学学院,山西太谷 030801)
目前,受精液保存技术限制,绵羊精液通过低温保存为主,这既能保存一定时间,还能保证较高的受胎率。在低温保存过程中,精子产生的大量活性氧(Reactive Oxygen Species,ROS)会损伤质膜,破坏精子的结构与功能。因此,精液低温保存的关键是在稀释液中添加一定量的牛血清蛋白、褪黑素、维生素E等抗氧化物质,从而缓解保存过程中精子受到的氧化损伤。
蜂王浆是工蜂下咽腺和下颌腺的分泌物,其含有多种能清除氧自由基的物质,可缓解氧化损伤。研究表明,在稀释液中添加适宜浓度的蜂王浆能显著提高精子的活率、活力、运动能力、质膜完整性和顶体完整率,从而延长精液保存时间,并且蜂王浆中的糖类能够为精子活动提供能源。精子摄能需要糖转运蛋白的转运,GLUTs 蛋白是由基因编码的膜转运蛋白,可转运葡萄糖、果糖等多种糖类,已知的GLUTs 结构有14种。目前发现与哺乳动物精子有关的糖转运蛋白有GLUT 1~3、GLUT 5 和GLUT 8。其中GLUT 3 是精子质膜上丰富的膜蛋白之一,介导糖转运,能够直接影响精子线粒体的活性;GLUT 8 是睾丸组织内主要的糖转运体,与精子的发生密切相关,靳天宇等发现绵羊精子中GLUT 3 和GLUT 8 的分布在精子中线粒体密集区域,表明它们与精子线粒体的能量代谢相关。
有关蜂王浆对低温保存绵羊精子质量的影响及其机制尚不明确,本实验在稀释液中添加不同浓度的蜂王浆,研究其对低温保存绵羊精子质量和糖转运蛋白GLUT 3和GLUT 8 表达的影响,为其在动物精液保存中的研究和应用提供依据。
1 材料与方法
1.1 实验试剂 蜂王浆来自山西农业大学养蜂实验室,由意大利蜜蜂采集油菜花蜜粉后分泌,收集时间为2018 年12 月,蜂王浆分装至-20℃长期保存。Tris、果糖、柠檬酸、二甲基亚砜(Dimethyl sulfoxide,DMSO)、青链霉素混合液、甘氨酸均购于北京索莱宝生物科技有限公司,JC-1、碘化丙啶(Propidium Iodide,PI)购于美国Med Chem Express 公司,Anti-GLUT 3 antibody、Anti-GLUT 8 antibody、-actin antibody 购于北京博奥森生物技术有限公司,荧光二抗购自美国LI-COR 公司,硝酸纤维膜、脱脂奶粉、SDS-PAGE 凝胶试剂盒、SDS-PAGE 蛋白上样缓冲液、RIPA 蛋白裂解液、广谱蛋白酶抑制剂购自武汉博士德生物有限公司。
1.2 实验动物 选用山西省太谷县保森畜牧集团有限公司体况良好的2~3 岁杜泊种公羊8 只,假阴道法采集精液后,将鲜精活率不低于0.8 的精液混池,用于后续试验。本研究采精时间为2018 年12 月—2019 年12 月。
1.3 精液处理 100 mL稀释液22.3 mmol/L Tris,5.3 mmol/L果糖,7.2 mmol/L 柠檬酸,15 mL 卵黄和10 mL 100 IU单位青链霉素,配置完成后摇匀并5℃保存。将稀释液分为5 组,分别添加0.00%、0.25%、0.50%、0.75%、1.00%的蜂王浆,分别将5 组精液逐步稀释至8 倍,放入5℃冰箱使其2 h 内降至5℃,然后保存。
1.4 实验方法 取保存0、24、48 h 和72 h 的精液,置于37℃水浴锅中孵育3 min,轻轻混匀,分别检测精子的活率(Motility)、活力(Viability)、运动参数、质膜完整性和线粒体活性。
1.4.1 精子运动能力测定 取10 μL 精液,压片后在400 倍镜下在计算机辅助精子分析系统中检测精子活率、活力、直线运动速率(Straight-line Velocity,VSL)、路径速度(Average Path Velocity,VAP)及曲线运动速率(Curvilinear Velocity,VCL)。
1.4.2 质膜完整性测定 采用低渗膨胀实验测定质膜完整性。吸取10 μL 精液加入预热的离心管中,再加入100 μL 预热的低渗溶液(称取1.35 g 果糖和0.375 g 柠檬酸钠,溶于100 mL 蒸馏水)37℃水浴锅孵育30 min后混匀,吸取混合液滴于载玻片涂片,风干后在400 倍显微镜下观察,随机拍取400 个以上精子。质膜完整性=(弯尾精子数/总精子数)×100%。
1.4.3 线粒体活性测定 通过JC-1 与PI 双荧光探针技术检测线粒体活性。吸取80 μL 精液加入预热的离心管中,加入4 μL JC-1 和2 μL PI,避光孵育30 min,然后加入总体积10%的Hancock's Solution 溶液混匀,吸取混合液于载玻片上,压片后400 倍荧光显微镜下观察,随机计数400 个以上精子。线粒体活性=(尾部呈黄色荧光的精子数/总精子数)×100%。
1.4.4 绵羊精子能量代谢蛋白的丰度的检测 采用Western Blot 法检测绵羊精子能量代谢蛋白的丰度。取保存0、24、48 h 和72 h 精子的总蛋白并测定蛋白浓度,按照精子蛋白:蛋白上样缓冲液=4:1,加入上样缓冲液,在95℃条件下变性10 min。保证每孔上样的蛋白量为50 μg,经SDS-PAGE 凝胶电泳(浓缩胶5% 80 V 30 min,分离胶10% 120 V 1.5 h)后将蛋白转至硝酸纤维膜,将膜浸于5% 脱脂奶粉中室温封闭1 h。然后将不同的膜浸于GLUT 3(1:500)、GLUT 8(1:800)、-actin(1:5000)蛋白抗体孵育4℃过夜。TBST 漂洗3 次,每次10 min,加入荧光二抗(1:15000)避光孵育1 h 后,TBST 漂洗3 次,每次10 min,用OdysseyCLΧ 双色近红外成像系统拍照。GLUT 蛋白丰度值=GLUT 蛋白灰度值/内参蛋白灰度值。
1.5 统计分析 用SPSS 22.0 软件进行单因素方差分析,用LSD 法进行多重比较。结果用平均值±标准误表示。Western Blot 结果用Image J 软件进行分析,通过Graphpad Prism 7.0 作图。<0.05 表示差异显著,>0.05 表示差异不显著。
2 结果
2.1 稀释液中添加蜂王浆对低温保存的绵羊精子运动能力的影响 由表1 和表2 可知,保存0 h 和24 h,5 个处理组间精子的活率和活力差异均不显著;在保存48 h和72 h 时,0.75% 蜂王浆组的精子活率和活力显著高于对照组,其余试验组与对照组间、试验组间精子活率和活力的差异均不显著。

表1 稀释液中不同浓度蜂王浆对低温保存绵羊精子活率的影响 %

表2 稀释液中不同浓度RJ 对低温保存绵羊精子活力的影响 %
由表3 可知,保存0 h 和24 h 时,5 个处理组间精子的VAP、VCL 和VSL 差异均不显著。保存48 h 时,试验组精子的VAP 均显著高于对照组,但试验组间差异不显著;0.75%蜂王浆组的VCL 和VSL 显著高于对照组,其他试验组与对照组间差异不显著。保存72 h时,试验组精子的VAP 均显著高于对照组,其中0.75%蜂王浆组精子VAP 显著高于0.25%、1.00%蜂王浆组;0.75%、0.50%蜂王浆组精子的VCL 均显著高于对照组,但与其他2 个试验组间差异不显著;0.75%蜂王浆组精子的VSL 显著高于对照组。

表3 稀释液中不同浓度蜂王浆对低温保存绵羊精子运动参数的影响 μm/s
2.2 稀释液中添加RJ 对低温保存绵羊精子质膜完整性和线粒体活性的影响 由表4 可知,保存0 h 和24 h 时,5个处理组间精子的质膜完整性差异均不显著。保存48 h,0.50%、0.75%蜂王浆组精子的质膜完整性均显著高于对照组。保存72 h,0.75%蜂王浆组精子的质膜完整性显著高于对照组,而其他间的差异均不显著。

表4 稀释液中不同浓度RJ 对低温保存绵羊精子质膜完整性的影响 %
由表5 可知,保存0 h,5 个处理组间精子的线粒体活性差异不显著。保存24 h 时,0.75% 蜂王浆组的线粒体活性显著高于对照组。保存48 h 和72 h 时,试验组精子的线粒体活性均显著高于对照组,0.75%蜂王浆组精子的线粒体活性显著高于0.25% 蜂王浆组;保存48 h 时0.50%蜂王浆组精子的线粒体活性也显著高于0.25%蜂王浆组,但与0.75%、1.00%蜂王浆组间差异不显著;保存72 h,0.50%、0.75%、1.00% 蜂王浆组间精子的线粒体活性差异不显著。

表5 稀释液中不同浓度蜂王浆对低温保存绵羊精子线粒体活性的影响 %
2.3 保存时间和0.75% 蜂王浆对绵羊精子蛋白GLUT 3表达量的影响 由图1 和图2 可知,精子GLUT 3 的蛋白丰度随保存天数延长而下降,但差异不显著;保存72 h,0.75%蜂王浆组精子的GLUT 3 蛋白丰度显著高于对照组。
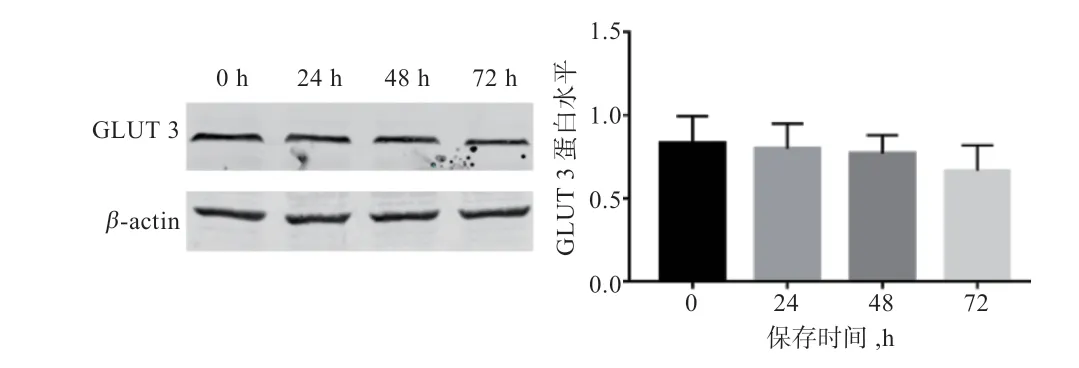
图1 低温保存0~72 h 精子GLUT 3 蛋白丰度变化

图2 精子蛋白GLUT 3 保存72 h 后丰度结果
2.4 保存时间和0.75% 蜂王浆对绵羊精子蛋白GLUT 8表达量的影响 图3 和图4 显示,保存72 h GLUT 8蛋白丰度显著低于0 h;与对照组相比,72 h 时0.75%蜂王浆组的GLUT 8 蛋白丰度显著提高。
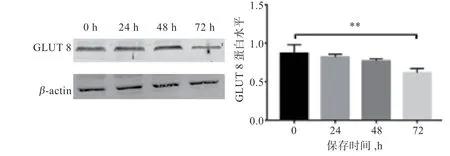
图3 低温保存0~72 h 精子GLUT 8 蛋白丰度变化
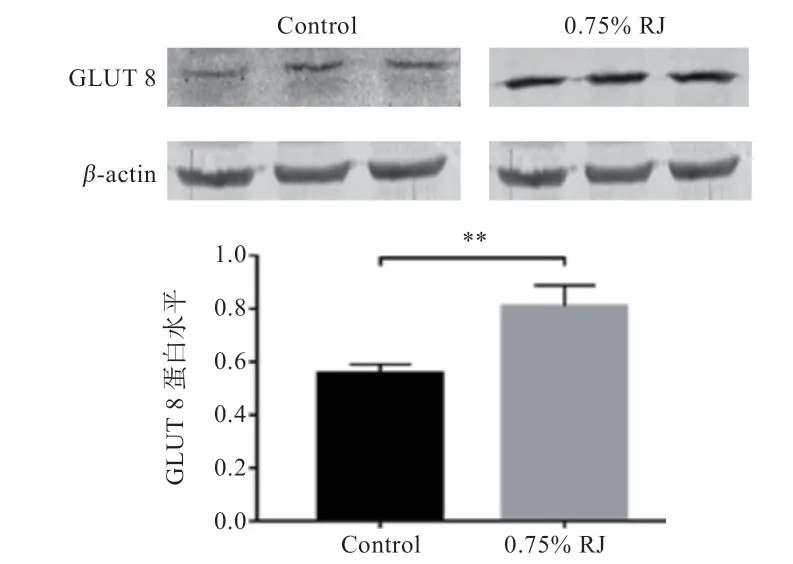
图4 精子蛋白GLUT 8 保存72 h 后丰度结果
3 讨 论
精液低温保存过程中,精子会产生大量的ROS,引起氧化应激,对精子造成损伤,降低精子质量。低温保存会使精液中ROS 和丙二醛(Malondialdehyde,MDA)水平升高,从而降低精液中抗氧化酶的活性,导致精子的质膜完整性和顶体完整率降低,使精子受到损伤。本实验在5℃保存72 h,各组精子的活率和活力均有所下降,精子已经发生氧化应激,其运动能力、质膜完整性和线粒体完整性均显著降低,这表明5℃保存过程中绵羊精子质量会有所下降。同时低温引起精子的膜损伤会影响其对外界营养物质的摄取,Sancho 等研究发现,冷冻后的精子细胞膜上的GLUT 3 表达量显著下降。本研究的Western Blot 结果显示在精液5℃保存72 h 的过程中,精子中GLUT 3 和GLUT 8 的表达量随着保存时间延长而逐渐下降,这可能是由于保存过程中精子产生过量的ROS,改变了线粒体膜的通透性,引起线粒体吸水膨胀导致外膜破裂。
有研究表明,蜂王浆的抗氧化特性源于其成分中含有可以清除自由基的酚类物质。Asadi 等研究发现,对精索静脉曲张诱导的大鼠补充200 mg/kg/d蜂王浆,其睾丸的总抗氧化能力(Total Antioxidant Capacity,T-AOC)较对照组显著提高,超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)活性也显著增加,这表明添加适宜浓度的蜂王浆能够缓解精子的氧化应激,提高精子质量。本研究中,添加0.75%的蜂王浆具有缓解氧化应激造成的精子活率、活力下降与质膜完整性降低的作用,还能维持保存过程中绵羊精子的线粒体活性,这与前人的研究结果一致。
精子中最重要的细胞器是线粒体,它具有促进细胞能量转换,参与细胞凋亡的作用,与氧化应激密切相关。本实验结果显示,低温保存过程中0.75% 蜂王浆组的线粒体活性在72 h 显著高于对照组,这是由于蜂王浆缓解了氧化应激对线粒体的损伤,降低了线粒体通透性,减缓细胞色素的释放,防止线粒体功能发生障碍。Shahzad 等研究表明0.1%的蜂王浆可提高水牛精子的运动性能与活力,维持质膜完整性,这与本研究结果一致。另外本研究发现,在稀释液中添加0.75% 的蜂王浆,5℃保存72 h 后GLUT 3 和GLUT 8 的表达较对照组显著提高。这是因为蜂王浆中含有的黄酮类物质能够降低精子细胞内Ca浓度和酪氨酸激酶磷酸化程度,从而抑制精子获能,保护GLUTs 蛋白,与本实验中的线粒体活性和质膜完整性结果相互映证。
本研究中,保存72 h 时1.00% 蜂王浆组精子的各项参数均低于0.75% 蜂王浆组但高于对照组,这是因为ROS 在体内参与众多正常生理反应,但过量会导致机体内部的氧化还原系统失衡,如果机体补充外源性抗氧化剂则会防止这一现象发生。若是外源性抗氧化剂补充过量,即使有一定的抗氧化作用,但ROS 会继续与这些过量的抗氧化剂结合,导致机体的氧化还原状态依然不平衡。本实验中添加蜂王浆能缓解精子受到的氧化应激,但补充过量又会使精子再次处于异常的氧化还原状态中。
4 结 论
本实验结果显示,在绵羊精液的低温保存过程中,稀释液中添加0.75 %的蜂王浆能显著提高精子活率、活力、质膜完整性和线粒体活性,并通过影响绵羊精子中GLUT 3 和GLUT 8 的表达,调节绵羊精液低温保存过程的能量代谢,从而改善低温保存绵羊精子的质量。
