UV-C处理对采后香蕉贮藏防御性成分和品质的影响
2022-05-16陈铭中钟旭美林海生秦小明
陈铭中 钟旭美 林海生 秦小明




摘要:為了提高香蕉的贮藏品质,研究短波紫外线(UV-C)对香蕉贮藏过程中主要酶活性和抗氧化性的影响,用0.02 kJ/m2剂量的UV-C处理香蕉后,于25 ℃贮藏18 d,研究UV-C处理对香蕉果实腐烂率、失质量率、总叶绿素含量、总酚(TP)含量、总黄酮(TF)含量、纤维素酶(CL)活性、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除率、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率、铁离子抗氧化能力(FRAP值)、苯丙氨酸解氨酶(PAL)活性、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性的影响。结果表明,UV-C处理显著降低了香蕉果实的腐烂率,减少了失质量,同时显著减缓了香蕉皮中叶绿素的降解,抑制了纤维素酶活性,激活了PAL、SOD和POD的活性,提高了多酚、总黄酮含量。通过对12个指标的相关性和聚类分析发现,经UV-C处理后,PAL的激活,对诱导增加防御性成分TF、TP、SOD和POD有显著影响,有利于维持香蕉果实在贮藏过程中的品质。由此可见,0.02 kJ/m2剂量UV-C处理可以提高香蕉果实抗病相关酶活性和抗氧化能力,延缓香蕉成熟,增强香蕉的抗病性,提升香蕉在贮藏期间的品质。
关键词:香蕉;短波紫外线(UV-C)照射;抗病相关酶;抗氧化能力
中图分类号:TS255.3;S668.1文献标识码:A文章编号:1000-4440(2022)02-0528-11
Effects of UV-C treatment on defensive components and quality of postharvest banana during storage
CHEN Ming-zhong ZHONG Xu-mei LIN Hai-sheng QIN Xiao-ming
Abstract:In order to improve the storage quality of banana, the effects of short wave ultraviolet (UV-C) on the main enzyme activity and antioxidant activity of banana during storage were studied. Bananas were stored at 25 ℃ for 18 days after being treated with 0.02 kJ/m2 UV-C. The effects of UV-C treatment on decay rate, weight loss rate, total chlorophyll content, total phenol (TP) content, total flavonoids (TF) content, cellulase (CL) activity, 2,2′-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) radical scavenging rate, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging rate,ferric reducing antioxidant power (FRAP) value, phenylalanine ammonia lyase (PAL) activity, superoxide dismutase (SOD) activity, peroxidase (POD) activity in banana fruits were investigated. The results showed that UV-C treatment significantly reduced the decay rate and the weight loss rate, slowed down the degradation of chlorophyll significantly, inhibited the cellulase activity, promoted the activities of PAL, SOD, POD, and improved the contents of total polyphenols and flavonoids. The correlation and cluster analysis of 12 indices showed that the activation of PAL after UV-C treatment had a significant effect on the induction of the increase of defensive components TF, TP, SOD and POD, which was beneficial to the quality maintenance of banana fruit during storage. In conclusion, 0.02 kJ/m2 UV-C treatment can improve the activity of disease resistant-related enzymes and antioxidant capacity of banana fruit, delay the ripening, enhance the disease resistance, improve the quality of banana during storage.
Key words:banana;short wave ultravidet (UV-C) irradiation;disease resistant-related enzymes;antioxidant capacity
江苏农业学报2022年第38卷第2期
陈铭中等:UV-C处理对采后香蕉贮藏防御性成分和品质的影响
香蕉是一种深受消费者喜爱的水果,其产量在世界水果产量中排第3[1],在中国水果产量中排第5(国家统计局2020年的数据),国内香蕉主产区在广东、广西和海南等地[2]。香蕉的生长周期较长,营养价值高,含有多种生物活性化合物,如类胡萝卜素、酚类、生物胺和植物甾醇等[3-4],属于呼吸跃变型水果,收获后会快速软化,并发生氧化损伤,出现皮斑和真菌腐烂等,在常温下的保质期相对较短,而低温贮藏会造成冷害[5-7]。常规的水果蔬菜保鲜方法有化学方法(如1-甲基环丙烯处理法[8])、生物方法(如壳聚糖涂膜法[9])和物理方法(如低温法)等,早期的保鲜方法主要是应用化学方法贮藏,但是随着人们生活水平的提高,对食品质量安全的意识逐渐增强,无残留、绿色的保鲜方法逐渐开始代替化学保鲜方法。
短波紫外线(Ultra-violet,UV-C)处理是一种安全、环境友好、经济型的无化学残留的物理方法[10]。相关研究结果表明,合适剂量的UV-C处理对采后西红柿[11]、草莓[12]、桃子[13]、葡萄[14]等水果有抑制软化、延缓成熟和诱导有益次生代谢物产生、增强抗病性等作用,能够较好地保持采后果蔬的品质[15]。本研究主要分析UV-C处理香蕉的合适剂量,对比处理前后的香蕉果实品质和抗氧化能力,旨在为将UV-C技术应用于香蕉乃至其他水果保鲜中提供技术支撑和理论依据。
1材料与方法
1.1试验材料
1.1.1试验原料本试验香蕉采摘自广东省阳江市阳春市果园,于采摘当天运至实验室处理备用。
1.1.2试验试剂甲醇、硝酸铝、无水碳酸钠、没食子酸、无水乙酸钠,购自天津市大茂化学试剂厂;乙醇、冰乙酸,购自天津市富宇精细化工有限公司;亚硝酸钠、氢氧化钠,购自天津市凯通化学试剂有限公司;福林酚、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl, DPPH)、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐[2,2’-Azino-bis(3-ethylbenzthiazoline-6- sulphonate), ABTS]、2,4,6-三吡啶基三嗪[2,4,6-Tri(2-pyridinyl)-1,3,5-triazine,TPTZ],购自北京欧卡技术有限公司;芸香苷,购自上海源叶生物科技有限公司;过硫酸钾,购自山东西亚化学工业有限公司。
1.1.3主要仪器与设备TGL-18台式高速冷冻离心机,购自上海卢湘仪离心机仪器有限公司;KQ-250E超声清洗器,购自昆明超声仪器有限公司;FA224电子天平,购自上海舜宇恒平科学仪器有限公司;UV-2600紫外-可见分光光度计,购自岛津中国有限公司;DK-S24恒温水溶锅,购自上海精宏实验设备有限公司;A11分析研磨机,购自德国IKA公司;超低温冰箱,购自中科美菱公司;TN-2254型紫外辐射照度计,购自广州泰纳电子科技有限公司。
1.2试验方法
1.2.1合适剂量的UV-C处理香蕉绿熟香蕉采摘于广东省阳春市果园,挑选八成熟、大小一致、无病害、无损伤的香蕉,当天运回实验室,将香蕉去柄分开后,用自来水缓慢清洗香蕉果实表面的物理杂质,再用蒸馏水润洗3遍,用风扇吹干后,随机分为对照组和处理组。在前期试验中,用0.01 kJ/m2、0.02 kJ/m2、0.03 kJ/m2、0.04 kJ/m2、0.06 kJ/m2、0.08 kJ/m26种不同剂量的UV-C处理香蕉,观察其外观和贮藏效果,发现在常温(25 ℃)下贮藏5 d后,与对照相比,0.06 kJ/m2、0.08 kJ/m2剂量UV-C处理的香蕉果实发生了明显褐变,0.03 kJ/m2、0.04 kJ/m2剂量UV-C处理的香蕉果实在贮藏7 d时出现褐变,与Ding等[16]的报道类似,而0.01 kJ/m2、0.02 kJ/m2 剂量UV-C处理的香蕉则无褐变。结合贮藏效果发现,0.02 kJ/m2剂量UV-C处理效果最佳,因此确定本试验的UV-C照射剂量为0.02 kJ/m2,这与Pongprasert等[17]报道的剂量(0.03 kJ/m2)不同,可能是香蕉品种不一致造成的。先将UV-C灯(飞利浦,20 W)打开,待能量稳定后,用0.02 kJ/m2剂量的紫外线照射香蕉,对照不照射紫外线。将对照组、处理组香蕉放置于恒温恒湿箱(温度为25 ℃,湿度为85%)中避光贮藏[18],分别于贮藏起始阶段与贮藏4 d、8 d、12 d、15 d、18 d采集对照组和处理组样品,将香蕉皮快速切碎,用液氮预冷后放入超低温冰箱(-86 ℃)中保存,用于各项指标的测定。
1.2.2腐烂率(DR)和失质量率(MLR)的测定本试验用果实的腐烂率和失质量率来评价贮藏效果,分别按照公式(1)、公式(2)计算,当贮藏的香蕉果实出现可见的腐烂斑点即視为腐烂。
DR=(腐烂果实数量/试验果实总数量)×100%(1)
MLR=(贮藏前质量-贮藏后质量)/贮藏前质量×100%(2)
1.2.3总叶绿素(TChl.)含量的测定叶绿素含量的测定采用曹建康等[19]的方法并稍作修改。准确称取0.50 g香蕉果实粉末,加入1 ml 80%丙酮,在弱光条件下充分研磨,定容至10 ml后于黑暗条件下浸提,每隔3 h振摇1次,浸提至样品残渣颜色变为白色。采用分光光度法测定663 nm、645 nm处的吸光度,分别记为A663、A645,按照公式(3)计算CTChl.(mg/g,鲜质量含量):
CTChl.=(20.29A645+8.05A663)×V×F/m/1 000(3)
式中,A663、A645分别为样品测定液在663 nm、645 nm处的吸光度;V为提取液体积,10 ml;F为稀释倍数;m为样品质量,g。
1.2.4纤维素酶(CL)活性的测定CL活性的测定参照曹建康等[19]的方法并稍作修改,准确称取1.00 g香蕉果实粉末,置于离心管中,用乙醇溶液提取法提取,于540 nm处测定吸光度,计算样品(鲜质量)的CL活性[单位:μg/(h·g)]。
1.2.5苯丙氨酸解氨酶(PAL)活性的测定准确称取0.10 g香蕉果实粉末,加入0.5 ml 0.1 mol/L pH值为8.8的硼酸缓冲液[含40 g/L聚乙烯吡咯烷酮(PVP)、2 mmol/L乙二胺四乙酸(EDTA)和5 mmol/L β-巯基乙醇],冰浴下研磨成匀浆,于4 ℃、10 000 r/min离心15 min,收集上清液,即为粗酶提取液[19]。根据苯丙氨酸解氨酶试剂盒说明书,按照公式(4)计算PAL活性(U/g,以鲜质量计):
PAL活性=16.6×(As-Ab)/Ab(4)
式中,As表示样品测定管在290 nm处的吸光度;Ab表示空白对照管在290 nm处的吸光度。
1.2.6超氧化物歧化酶(SOD)活性的测定准确称取0.10 g香蕉果实粉末,加入0.4 ml提取液(0.1 mol/L磷酸鹽缓冲液,pH值为7.0~7.4),冰浴下研磨成均浆,于4 ℃、8 000 r/min离心10 min,收集上清液,即为粗酶提取液。参照超氧化物歧化酶试剂盒说明书,按照公式(5)计算SOD活性(U/g,以鲜质量计):
SOD活性=11.4×抑制百分率/(1-抑制百分率)/m×F(5)
式中,m为样品质量,g;F为稀释倍数。
1.2.7过氧化物酶(POD)活性的测定准确称取0.10 g香蕉果实粉末,加入0.4 ml生理盐水,冰浴下研磨成均浆,4 ℃、8 000 r/min离心10 min,收集上清液即为粗酶提取液。根据过氧化物酶试剂盒说明书,按公式(6)计算POD活性(U/mg,以鲜质量计):
POD活性 =(As-Ac)×(V1/V2)/360/Cprot×1 000(6)
式中,As、Ac分别表示样品测定管、对照管在420 nm处的吸光度;V1为反应液总体积,ml;V2为取样量,ml;Cprot为匀浆蛋白浓度,mg/ml。
1.2.8甲醇提取液的制备参考Silva等[20]的甲醇提取法并略作修改。准确称取0.50 g香蕉果实粉末,加入2 ml 80%甲醇,在水浴振荡器中于60 ℃、50 r/min振荡25 min,然后于5 000 r/min离心10 min,收集上清液,重复以上步骤提取2次。收集、合并上清液,用80%甲醇定容至10 ml,于-20 ℃保存备用,测定总酚(Total phenolic content,TP)含量、总黄酮(Total flavonoid content, TF)含量、DPPH自由基清除能力、ABTS自由基清除能力和铁离子还原能力(Ferric reducing antioxidant power,FRAP)。上清液在所有环节均用铝箔覆盖,避免提取物受到光破坏。
1.2.9总酚含量的测定取0.50 ml按方法1.2.8制备的甲醇提取液,加入0.5 ml 福林酚溶液(甲醇溶液、95%福林酚的体积比为1∶10)手动摇晃15 s,加入1 ml 7.5%碳酸钠溶液和1 ml蒸馏水,在室温黑暗处放置1 h,于725 nm处测吸光度。以没食子酸为标准品制作标准曲线,得到标准方程:Y=0.188 5x+0.026 5,R2=0.999 0。将于725 nm处测定的吸光度代入标准曲线中计算香蕉果实的总酚含量[21]。
1.2.10总黄酮含量的测定取2.00 ml按方法1.2.8制备的甲醇提取液置于10 ml比色管中,加入0.4 ml 5%亚硝酸钠溶液,摇匀后静置5 min;加入0.4 ml 10%硝酸铝溶液,摇匀后静置5 min,加入4 ml 4%氢氧化钠溶液,用60%乙醇定容至10 ml;静置显色10 min后于510 nm处测吸光度。以芸香苷为标准品制作标准曲线,得到标准方程:Y=0.157 0x+0.153 4,R2=0.999 9。将于510 nm处测定的吸光度代入标准曲线中计算香蕉果实的总黄酮含量[22]。
1.2.11对DPPH自由基清除能力的测定取0.10 ml按方法1.2.8制备的甲醇提取液,加入3.90 ml 0.063 mmol/L DPPH甲醇溶液中混合均匀,在室温下放置20 min,在波长515 nm处测定吸光度[21]。根据公式(7)计算香蕉果实样品提取液对DPPH自由基的清除能力:
DPPH自由基清除率=(Ab-As) /Ab×100%(7)
式中,Ab表示空白对照管的吸光度;As表示样品测定管的吸光度。
1.2.12FRAP值的测定FRAP工作液:20 mmol/L TPTZ溶液(用40 mmol/L HCl溶液配制)、20 mmol/L FeCl3·6H2O溶液、0.3 mol/L pH值为3.6的乙酸钠缓冲液,按10∶1∶1的体积比混合配制(现配现用)[23]。
取90 μl样品提取液,加入900 μl FRAP工作液,定容至10 ml并混匀后,于37 ℃水浴反应30 min,在593 nm处测定吸光度。以FeSO4为标准品制作标准曲线,得到标准方程:Y=0.191 4x+0.031 6,R2=0.999 8,将于593 nm处测定的吸光度代入标准曲线中计算香蕉果实的FRAP值。
1.2.13对ABTS自由基清除能力的测定ABTS+储备液的配制:配制2.45 mmol/L过硫酸钾,用其溶解ABTS+,配成7 mmol/L ABTS+储备液[24],在室温、避光条件下静置12~16 h,这种储备液可稳定3~4 d。ABTS+测定液的配制:将ABTS+储备液用磷酸盐缓冲液(10 mmol/L,pH值为7.4)稀释,使其在734 nm处的吸光度达到0.700±0.020。
香蕉果实样品待测液对ABTS自由基清除能力的测定:取4.00 ml ABTS+测定液,加入40 μl样品待测液,振荡30 s,反应一定时间后于734 nm處测定吸光度。根据公式(8)计算香蕉果实样品待测液对ABTS自由基的清除能力:
ABTS自由基清除率=(1-As/0.700) ×100%(8)
式中,As表示样品在734 nm处的吸光度。
1.3数据处理与分析
本试验平行测定3次,结果以“平均值±标准差”表示,用OriginPro 2019b软件绘图,用SPSS 21.0统计软件进行显著性检验,用R语言进行相关性分析。
2结果与分析
2.1UV-C处理对香蕉果实腐烂率、失质量率的影响
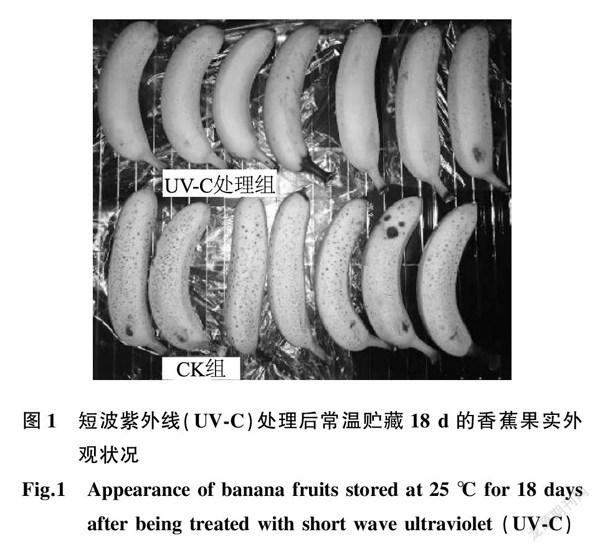
在25 ℃贮藏18 d后,UV-C处理香蕉的色泽青黄、外形饱满、有光泽,个别香蕉果实出现很少的黑点,而对照组香蕉色泽淡黄,已经出现大量黑点,同时部分香蕉果实开始出现腐烂斑块,表明经过合适剂量UV-C处理后,香蕉能够保持良好的外观状态。UV-C处理后常温贮藏18 d的香蕉外观状况见图1。
由图2A可以看出,在常温条件下贮藏0~8 d,UV-C处理和对照的样品均未腐烂;贮藏12~18 d,UV-C处理和对照的样品腐烂率均呈上升趋势,并且对照的样品腐烂率一直极显著高于UV-C处理(P<0.01),表明UV-C处理可以显著降低贮藏周期中香蕉果实的腐烂率。由图2B可以看出,在贮藏周期内,对照、UV-C处理的失质量率均呈上升趋势,但对照的失质量率始终高于UV-C处理,并且它们之间的差异极显著(P<0.01),说明UV-C处理可较好地抑制香蕉果实水分流失,降低香蕉果实的失质量率,避免采后香蕉果实因失水而形成皱褶,维持香蕉果实的感官品质,有利于香蕉果实的采后贮藏。
2.2UV-C处理对香蕉果实TChl.含量的影响
叶绿素含量是水果品质的重要指标,在香蕉等果蔬果实的贮藏过程中,随着果实的成熟、衰老,其叶绿素含量不断下降。由图3可以看出,在香蕉果实贮藏期间,UV-C处理的TChl.含量始终高于对照,并且在贮藏12~18 d,相同采样时间的UV-C处理的TChl.含量均极显著高于对照(P<0.01),对照的TChl.含量在贮藏12 d时出现最大幅度的下降,UV-C处理的TChl.含量在贮藏15 d时才出现较大幅度的下降,其最大降幅出现的时间相对于对照所有延迟,表明UV-C处理延缓了采后香蕉果实TChl.的分解,延迟了其在贮藏期颜色的变黄。
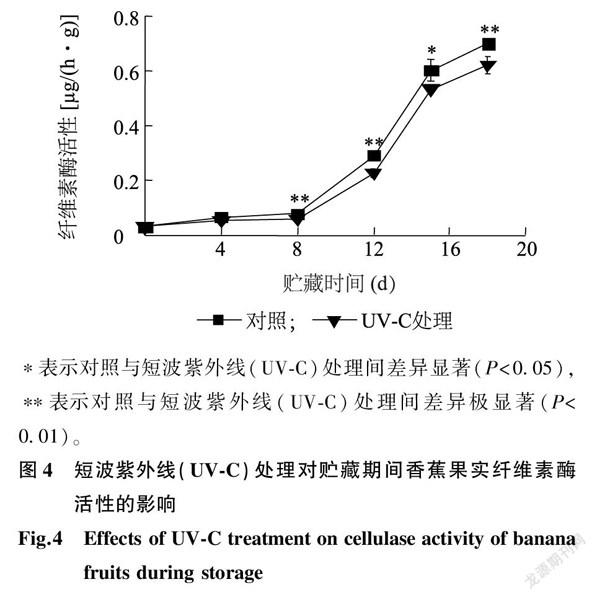
2.3UV-C处理对香蕉果实纤维素酶活性的影响
纤维素酶是催化分解果蔬细胞壁中纤维素的一种酶,其活性影响了果蔬的硬度和品质[25-26]。本研究用合适剂量的UV-C处理香蕉后,测定香蕉果实中的纤维素酶活性。由图4可以看出,随着贮藏时间的延长,香蕉果实逐渐成熟,纤维素酶活性逐渐增大,UV-C处理的纤维素酶活性在贮藏前8 d变化不显著,对照的纤维素酶活性在贮藏8 d时就表现出极显著变化(P<0.01),贮藏8 d至采样结束期间,相同采样时间的2个处理的纤维素酶活性相比,UV-C处理均极显著(P<0.01)或显著(P<0.05)低于对照,表明UV-C处理可以抑制采后香蕉果实的纤维素酶活性,有利于保持香蕉果实在采后贮藏期的硬度和品质。
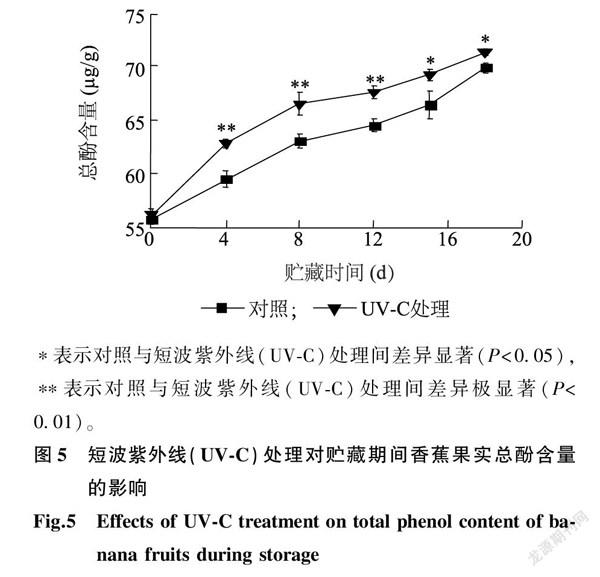
2.4UV-C处理对香蕉果实TP、TF含量的影响
香蕉果实中富含酚类化合物,如儿茶素、表儿茶素和单宁,对维持香蕉品质十分重要[27-28]。由图5可以看出,香蕉果实中的总酚含量随着香蕉成熟度的增加而不断升高,UV-C处理与对照的总酚含量在贮藏4~12 d时差异极显著(P<0.01),在贮藏15~18 d时差异显著(P<0.05),可能由于贮藏前期(4~12 d)在短波紫外线的诱导下,有利于果实中总酚的生物合成,而在贮藏后期(15~18 d),短波紫外线的诱导增长作用没有前期那么明显。UV-C处理下,香蕉果实中的总酚含量均高于对照组,与番茄[29]、鲜切草莓[30]短波紫外线保鲜的研究结果一致。之所以出现上述现象,可能由于黄酮类化合物是天然的植物抗氧化剂,具有螯合金属离子和清除自由基的特性,也被报道有延缓许多慢性疾病发展和抑制脂质过氧化等作用[31]。
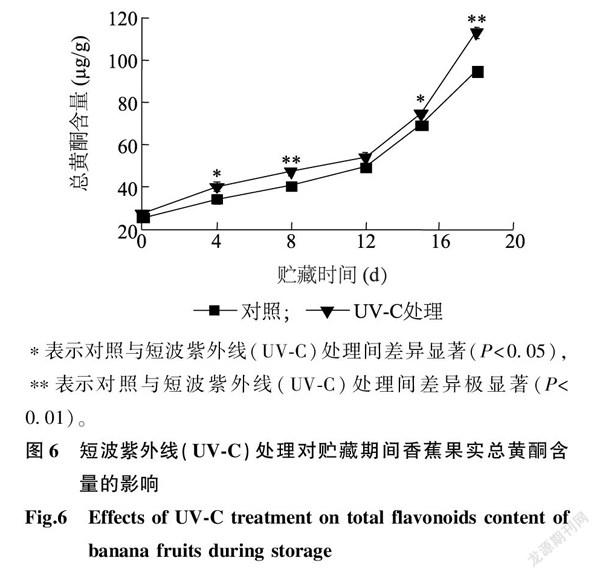
由图6可以看出,香蕉果实中的总黄酮含量随着贮藏时间的延长而增加,在UV-C处理下,香蕉果实中的总黄酮含量在贮藏12 d时与对照间的差异不显著,在其他时间则与对照间差异显著(P<0.05)或极显著(P<0.01),并且在同一时期始终高于对照,与焦中高等[32]采用UV-C处理采后甜樱桃总黄酮含量的变化相似。本研究结果表明,用UV-C处理采后香蕉,能够诱导香蕉在贮藏期抑菌成分(总酚和总黄酮)含量的增长,有利于增强采后香蕉的抗病性,降低其腐败率。
2.5UV-C处理对香蕉果实PAL活性的影响
PAL是植物响应低温、干旱和紫外线等逆性胁迫的一种重要酶,同时也是苯丙烷类代谢生物合成途径的关键酶[33]。由图7可以看出,在整个贮藏期间,香蕉果实的PAL活性随贮藏时间的延长而增加,UV-C处理的PAL活性一直高于对照,在贮藏4 d、18 d,两者之间的差异显著(P<0.05),在贮藏8~16 d,两者之间的差异极显著(P<0.01),其中贮藏8 d时的差异最大,UV-C处理的PAL活性是对照的1.34倍,这与Huyskens-Keil等[34]报道的经UV-C处理后,白芦笋PAL活性增强的研究结果一致。
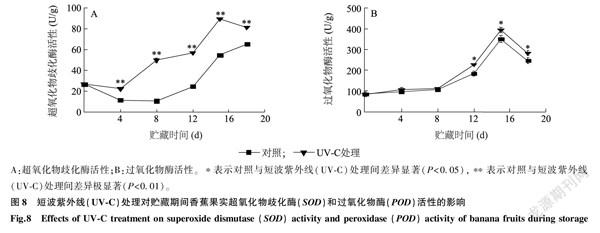
2.6UV-C处理对香蕉果实SOD、POD活性的影响
POD、SOD是采后果蔬抗氧化、抗衰老系统中不可缺少的酶,SOD通过催化超氧阴离子自由基歧化反应生成O2和H2O2,POD进一步将H2O2分解为H2O等无害物质[35]。由图8A可以看出,香蕉果实的SOD活性在贮藏前期均出现短暂的下降,随后出现较大幅度的升高。在贮藏期间,UV-C处理的SOD活性始终高于对照,并且差异极显著(P<0.01),贮藏8 d时的差异最大,UV-C处理的SOD活性是对照的4.75倍,在贮藏18 d时,UV-C处理的SOD活性比对照高25%。结果表明,UV-C处理能够有效诱导香蕉果实中SOD活性的增强,有利于香蕉果实清除贮藏期间因成熟、衰老而产生的氧自由基,保护细胞膜的完整性,提高采后香蕉的贮藏品质。
POD能够清除细胞中多余的H2O2,是植物抗氧化系统中的关键酶,能够维持植物体内活性氧代谢的动态平衡[36]。由图8B可以看出,香蕉果实的POD活性在贮藏前8 d的变化不大,UV-C处理的POD活性高于对照组,但两者间没有显著差异,UV-C处理的POD活性在贮藏4 d时与贮藏起始阶段间的差异显著(P<0.05),与贮藏8 d时的差异不显著,对照的POD活性在贮藏起始阶段与贮藏4 d、8 d时的差异不显著;在贮藏8~15 d,对照、UV-C处理的POD活性大幅度增强,同期UV-C处理的香蕉果实POD活性显著高于对照(P<0.05);在贮藏18 d时,对照、UV-C处理的POD活性有所下降,但UV-C处理仍高于对照且二者间差异显著(P<0.05)。结果表明,用UV-C处理采后香蕉果实,能够诱导其在贮藏期POD活性的增强。
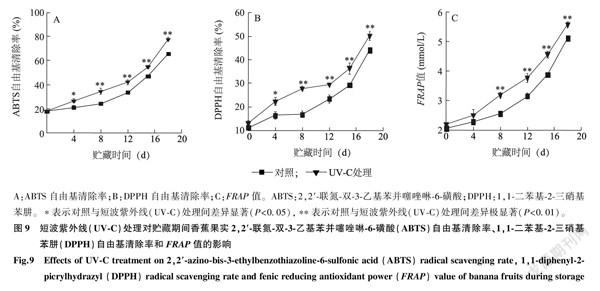
2.7UV-C处理对香蕉果实中ABTS、DPPH自由基清除率和FRAP值的影响
本试验采用ABTS、DPPH自由基清除率和FRAP值3个指标来评价UV-C处理前后香蕉果实的抗氧化能力。由图9A可以看出,对照、UV-C处理香蕉的ABTS自由基清除率在贮藏期间不断升高,UV-C处理的ABTS自由基清除率始终高于对照,且二者在贮藏4 d时的差异显著(P<0.05),在贮藏8 d、12 d、15 d、18 d时差异极显著(P<0.01)。由图9B可以看出,香蕉的DPPH自由基清除率在贮藏期间不断升高,UV-C处理的DPPH自由基清除率始终高于对照,二者在贮藏4 d时差异显著(P<0.05),在贮藏8 d、12 d、15 d、18 d时差异极显著(P<0.01)。由图9C可以看出,对照、UV-C处理香蕉的FRAP值在贮藏期间不断上升,并且UV-C处理的FRAP值始终高于对照,二者间的差异在贮藏4 d内不显著,在贮藏8 d、12 d、15 d、18 d时差异极显著(P<0.01)。由此可见,与对照相比,经UV-C处理的采后香蕉在贮藏期的抗氧化能力显著提高。
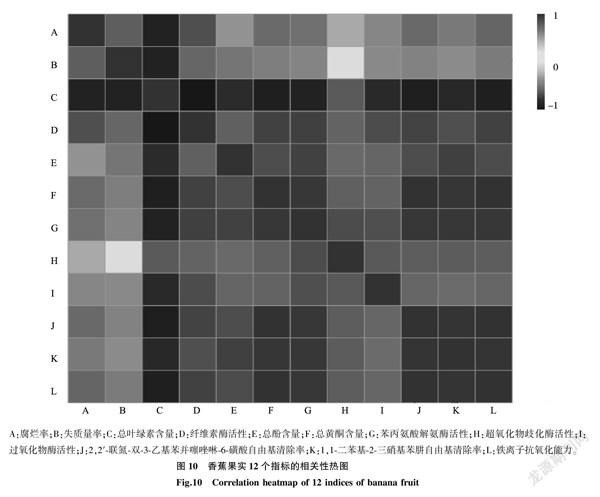
2.8香蕉果实不同指标间的相关性
为了明确不同指标之间的相关性,对测得的香蕉果实的12个指标进行相关性分析。由图10可以看出,香蕉果实的腐烂率与失质量率、总叶绿素含量、纤维素酶活性、总黄酮含量、苯丙氨酸解氨酶(PAL)活性、ABTS自由基清除率和FRAP值呈极显著相关;MLR与DR、TChl.含量和CL活性呈极显著相关;TChl.含量与其他指标呈极显著负相关(除了与SOD活性呈显著负相关);CL活性與TF含量、PAL活性、ABTS自由基清除率和FRAP值呈极显著强正相关[37](当r=0.90~1.00时表示呈强正相关);TP含量与PAL活性和DPPH自由基清除率呈极显著强正相关;TF含量与FRAP值、ABTS和DPPH自由基清除率、PAL活性呈极显著强正相关;PAL活性与FRAP值、DPPH和ABTS自由基清除率、TF含量、CL活性、TP含量呈极显著强正相关;SOD活性与PAL活性、POD活性、DPPH和ABTS自由基清除率、FRAP值呈极显著较强正相关(当r=0.80~0.89时表示呈较强正相关);POD活性与CL、PAL、SOD活性呈极显著较强正相关。
用不同采样时间对照、UV-C处理香蕉果实对应的12个指标作聚类热图,探究样品与指标之间的总体关联度。由图11可以看出,样品的12个指标可以归为4大类,第1类指标包含TChl.含量1个指标,能够反映香蕉果实的成熟度,该指标随着对照、UV-C处理香蕉果实贮藏时间的增加而下降,并且UV-C处理的TChl.含量比对照高,表明用UV-C处理后,香蕉的总叶绿素含量相对较高,延缓了香蕉果实成熟;第2类指标包含DR、MLR,能够反映香蕉果实的腐烂情况,对照DR、MLR均高于UV-C处理,表明UV-C处理后,香蕉的腐败程度受到抑制,从而维持了香蕉的品质;第3类指标包含TP含量、TF含量、ABTS自由基清除率、FRAP值、PAL活性、DPPH自由基清除率,是植物类样品中评价抗氧化能力的相关指标,可以反映香蕉果实的抗氧化能力,UV-C处理的这6个指标均高于对照,表明用UV-C处理采后香蕉果实,激活了香蕉果实的PAL活性,会诱导香蕉果实产生TP、TF等抗逆物质[29],从而增强了香蕉的抗氧化能力;第4类指标包含SOD、CL、POD活性,能够反映香蕉果实的抗衰老能力,对比图11中的数值可以看出,UV-C处理第4类指标中的SOD、POD活性相对较高,有利于UV-C处理香蕉果实清除在成熟、衰老过程中产生的过多自由基,避免其破坏细胞膜,从而维持细胞的完整性,而CL活性相对较低,也有利于UV-C处理香蕉果实维持细胞壁的固有状态。由此可见,经UV-C处理后,香蕉果实的抗衰老能力增强,品质也得到较好的维持。
此外,对UV-C处理采后香蕉果实的相关指标进行相关性分析可知,香蕉果实腐烂率与失质量率、TChl.含量、CL活性、TF含量、PAL活性呈极显著相关;PAL活性与FRAP值、DPPH和ABTS自由基清除率及TF含量、CL活性、TP含量这6个指标呈极显著正相关,与SOD、POD活性这2个指标呈极显著正相关,与TChl.含量呈较强负相关。由聚类热图分析结果可知,UV-C处理延缓了TChl.的分解,激活了PAL活性,可见PAL在香蕉的整个成熟、衰老和UV-C照射后的贮藏过程中起到了很关键的作用,促进了TP、TF含量的增加,这与Gonzlez-Aguilar等[38]研究采后紫外线处理可诱导芒果PAL活性升高、总酚含量增加的结果一致,对降低香蕉果实腐烂率、增强其抗氧化能力和自由基清除率等都有效果。
3结论
本研究结果表明,0.02 kJ/m2 UV-C为处理采后香蕉的最佳剂量,采用该剂量照射采后香蕉,分析贮藏期香蕉果实品质的变化,对处理、对照香蕉果实的12个生理生化指标进行评价,结合相关性分析和聚类热图整体分析得出,采用合适剂量的UV-C处理采后香蕉果实,可以延缓香蕉果实中叶绿素的分解,抑制CL活性,较好地维持香蕉果实的硬度,激活PAL活性,诱导TP、TF含量提升和抗病相关酶(SOD、POD)活性升高,显著降低香蕉的超氧阴离子自由基和H2O2的积累,提高ABTS、DPPH自由基清除率与FRAP值,增强香蕉果实的抗氧化能力,从而延缓香蕉的成熟,对降低香蕉果实的腐烂率、失质量率均有良好效果,较好地维持了香蕉的贮藏品质。由此可见,合适剂量的UV-C处理可以降低贮藏期香蕉的腐烂率,延缓香蕉品质的下降,使香蕉在贮藏期间维持较高的品质和抗氧化能力,达到保鲜效果,从而延长香蕉的货架期,为香蕉采后贮藏保鲜和品质评价提供理论参考和借鉴。
參考文献:
[1]DALE J, PAUL J Y, DUGDALE B, et al. Modifying bananas: from transgenics to organics?[J]. Sustainability, 2017, 9(3):333.
[2]洪佳敏,何炎森,郑云云,等. 香蕉成分及其保健功能研究进展[J]. 中国农学通报, 2016,32(10):176-181.
[3]SINGH B, SINGH J P, KAUR A, et al. Bioactive compounds in banana and their associated health benefits-a review[J]. Food Chemistry, 2016,206:1-11.
[4]PEREIRA A, MARASCHIN M. Banana (Musa spp) from peel to pulp: ethnopharmacology, source of bioactive compounds and its relevance for human health[J]. Journal of Ethnopharmacology, 2015,160:149-163.
[5]HUANG H, JIAN Q J, JIANG Y M, et al. Enhanced chilling tolerance of banana fruit treated with malic acid prior to low-temperature storage[J]. Postharvest Biology and Technology, 2016,111:209-213.
[6]WANG Y S, LUO Z S, MAO L C, et al. Contribution of polyamines metabolism and GABA shunt to chilling tolerance induced by nitric oxide in cold-stored banana fruit[J]. Food Chemistry, 2016,197:333-339.
[7]HAO J S, LI X, XU G Z, et al. Exogenous progesterone treatment alleviates chilling injury in postharvest banana fruit associated with induction of alternative oxidase and antioxidant defense[J]. Food Chemistry, 2019,286: 329-337.
[8]ZHU X Y, LIN S, FU D, et al. Effects of the combination treatment of 1-MCP and ethylene on the ripening of harvested banana fruit[J]. Postharvest Biology and Technology, 2015,107:23-32.
[9]SUSENO N, SAVITRI E, SAPEI L, et al. Improving shelf-life of Cavendish banana using chitosan edible coating[J]. Procedia Chemistry, 2014,9:113-120.
[10]XU Y Q, CHARLES M T, LUO Z S, et al. Preharvest UV-C treatment affected postharvest senescence and phytochemicals alternation of strawberry fruit with the possible involvement of abscisic acid regulation[J]. Food Chemistry, 2019,299:125138.
[11]ESUA O J, CHIN N L, YUSOF Y A, et al. Effects of simultaneous UV-C radiation and ultrasonic energy postharvest treatment on bioactive compounds and antioxidant activity of tomatoes during storage[J]. Food Chemistry, 2019,270:113-122.
[12]JIN P, WANG H Y, ZHANG Y, et al. UV-C enhances resistance against gray mold decay caused by Botrytis cinerea in strawberry fruit[J]. Scientia Horticulturae, 2017, 225:106-111.
[13]ZHOU D D, SUN Y, LI M Y, et al. Postharvest hot air and UV-C treatments enhance aroma-related volatiles by simulating the lipoxygenase pathway in peaches during cold storage[J]. Food Chemistry, 2019, 292:294-303.
[14]PINTO E P, PERIN E C, SCHOTT I B, et al. The effect of postharvest application of UV-C radiation on the phenolic compounds of conventional and organic grapes (Vitis labrusca cv. ‘Concord’)[J]. Postharvest Biology and Technology, 2016,120:84-91.
[15]ZHANG W L, JIANG W B. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance[J]. Trends in Food Science & Technology, 2019, 92(3):71-80.
[16]DING P, LING Y S. Browning assessment methods and polyphenol oxidase in UV-C irradiated Berangan banana fruit[J]. International Food Research Journal, 2014,21(4):1667-1674.
[17]PONGPRASERT N, SEKOZAWA Y, SUGAYA S, et al. A novel postharvest UV-C treatment to reduce chilling injury (membrane damage, browning and chlorophyll degradation) in banana peel[J]. Scientia Horticulturae, 2011,130(1):73-77.
[18]王甲水,贾彩红,张建斌,等. 香蕉果实乙烯释放量GC的测定方法及其不同处理下的变化趋势[J]. 热带作物学报, 2013,34(6):1188-1191.
[19] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[20]SILVA K D R R, SIRASA M S F. Antioxidant properties of selected fruit cultivars grown in Sri Lanka[J]. Food Chemistry, 2018,238:203-208.
[21]KHALIQ G, MUDA MOHAMED M T, GHAZALI H M, et al. Influence of gum arabic coating enriched with calcium chloride on physiological, biochemical and quality responses of mango (Mangifera indica L.) fruit stored under low temperature stress[J]. Postharvest Biology and Technology, 2016,111:362-369.
[22]孙丹,黄士淇,蔡圣宝. 不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响[J]. 食品与发酵工业, 2016,42(1):141-147.
[23]THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006,19(6/7):669-675.
[24]WU L C, HSU H W, CHEN Y C, et al. Antioxidant and antiproliferative activities of red pitaya[J]. Food Chemistry, 2006,95(2):319-327.
[25]王馨悦,姜爱丽,胡文忠,等. 乳酸钙处理对采后蓝莓品质的影响[J]. 现代食品科技, 2019,35(7):47-54.
[26]连政,黄圆博,贾佳林,等. 不同采收期对软枣猕猴桃采后品质和细胞壁降解的影響[J]. 中国果树, 2019(4):69-71.
[27]SHARAF A, SHARAF O A, HEGAZI S M, et al. Chemical and biological studies on banana fruit[J]. Zeitschrift für Ernhrungswissenschaft, 1979,18(1):8-15.
[28]VU H T, SCARLETT C J, VUONG Q V. Phenolic compounds within banana peel and their potential uses: a review[J]. Journal of Functional Foods, 2018,40:238-248.
[29]LIU C H, ZHENG H H, SHENG K L, et al. Effects of postharvest UV-C irradiation on phenolic acids, flavonoids, and key phenylpropanoid pathway genes in tomato fruit[J]. Scientia Horticulturae, 2018,241:107-114.
[30]LI M L, LI X A, HAN C, et al. UV-C treatment maintains quality and enhances antioxidant capacity of fresh-cut strawberries[J]. Postharvest Biology and Technology, 2019,156:110945.
[31]KONDAPALLI N, SADINENI V, VARIYAR P S, et al. Impact of γ-irradiation on antioxidant capacity of mango (Mangifera indica L.) wine from eight Indian cultivars and the protection of mango wine against DNA damage caused by irradiation[J]. Process Biochemistry, 2014,49(11):1819-1830.
[32]焦中高,刘杰超,刘慧,等. 短波紫外线辐照处理对采后甜樱桃果实营养品质和抗氧化活性的影响[J]. 中国食品学报, 2017,17(1):170-178.
[33]WANG Y, CHEN J Y, JIANG Y M, et al. Cloning and expression analysis of phenylalanine ammonia-lyase in relation to chilling tolerance in harvested banana fruit[J]. Postharvest Biology and Technology, 2007,44(1):34-41.
[34]HUYSKENS-KEIL S, EICHHOLZ-DNDAR I, HASSENBERG K, et al. Impact of light quality (white, red, blue light and UV-C irradiation) on changes in anthocyanin content and dynamics of PAL and POD activities in apical and basal spear sections of white asparagus after harvest[J]. Postharvest Biology and Technology, 2020,161:111069.
[35]ZHOU H W, YUAN B, CHEN W, et al. Effect of monooxygenase purified from Mycobacterium JS60 combined with sodium alginate on the preservation of banana[J]. Postharvest Biology and Technology, 2020,161:111079.
[36]LO’AY A A, EL-KHATEEB A Y. Antioxidant enzyme activities and exogenous ascorbic acid treatment of ‘Williams’ banana during long-term cold storage stress[J]. Scientia Horticulturae, 2018,234:210-219.
[37]羅钦,李冬梅,黄敏敏,等. 不同生长阶段墨瑞鳕脂肪酸组成及主成分分析[J]. 核农学报, 2020,34(4):788-795.
[38]GONZLEZ-AGUILAR G A, ZAVALETA-GATICA R, TIZNADO-HERNNDEZ M E. Improving postharvest quality of mango ‘Haden’ by UV-C treatment[J]. Postharvest Biology and Technology, 2007,45(1):108-116.
(责任编辑:徐艳)
收稿日期:2021-06-19
基金项目:亚热带果蔬加工与利用技术研究项目(2013050214);广东省普通高校特色创新类项目(2019GKTSCX122);广东省科技专项基金项目(SDZX2020028)
作者简介:陈铭中(1979-),男,广东阳江人,博士,副教授,研究方向为食品加工与贮藏。(E-mail)gdyjchendan@163.com
通讯作者:秦小明,(E-mail)qinxm@gdou.edu.cn
