高压静电场处理对乌拉尔甘草生理特性影响
2022-05-14李倩郭九峰高海荣
李倩,郭九峰,*,高海荣
高压静电场处理对乌拉尔甘草生理特性影响
李倩1,郭九峰1,*,高海荣2
1.内蒙古大学物理科学与技术学院 离子束生命工程重点实验, 呼和浩特 010020 2.内蒙古大学生命科学院 呼和浩特 010020
以取自赤峰和鄂尔多斯的两品种乌拉尔甘草为供试材料, 采用组织培养方式栽培, 研究了高压静电场处理对叶绿素含量、渗透调节物含量及抗氧化酶活性等生理特性的影响。结果发现, 适当的高压静电场作用对甘草幼苗的生长代谢等生命过程起到促进作用。与对照组相比, 经电场处理之后的甘草幼苗体内的可溶性蛋白、叶绿素含量、相对电导率、根系活力及抗氧化性酶均发生一定的变化。研究表明, 两品种甘草苗叶片的叶绿素在电场处理均遭到不同程度的阻碍, 但均能通过增加体内抗氧化性酶活性、渗透调节物质含量及根系活力进行缓解调节, 从而说明高压静电场处理种子使得甘草表现出更强的耐受能力, 为抵抗逆境胁迫提供新思路。
高压静电场; 乌拉尔甘草; 叶绿素; 根系活力; 抗氧化酶
0 前言
Murr. L对电生物效应研究[1]开启静电生物效应研究的大门, 随着工业技术的进步与发展大大推进了高压静电场技术的应用, 研究者们从不同广度、不同深度和不同角度探究电场对生物体的影响。高压静电场对玉米植株进行处理, 测定其叶片叶绿素含量及蛋白质含量增加, 并且观察叶绿素光谱吸收特性得到改善, 植株生长速度明显加快[2]。小麦种子的发芽率、生长速率、抗氧化性酶和渗透调节物质等在高压静电场处理之后都与未处理之前存在很大的差异[3]。有研究者认为, 出现这种现象与植物种子中的抗氧化性酶的活性被提高, 种子的质膜透性和膜脂的过氧化作用被降低有关[4-5]。经过高压静电场处理的植物种子, 发芽率得到大大提升, 生长周期也相对缩短, 植株体内会不同程度发生生理特性及抗性机制的变化[6-9]。因此, 高压静电场处理以其操作简单、无污染、节能等特性成为提高种子生理特性的新兴方法。本文以室内组织培养的两个品种乌拉尔甘草幼苗为实验材料, 选用对甘草种子发芽率提高最为显著的三个电场条件处理甘草种子, 研究短期生长内高压静电场处理对其叶绿素含量、渗透调节物质及抗氧化酶活性等生理生化指标的影响, 旨在了解高压静电场处理对乌拉尔甘草的有效意义提供可靠参考。
1 材料与方法
1.1 植物材料
甘草种子, 选用人工栽培的乌拉尔甘草, 分别取自内蒙古赤峰及鄂尔多斯生态甘草种植基地(赤峰甘草和鄂尔多斯甘草), 在内蒙古大学离子束实验室组培种植。
1.2 材料预处理
将甘草种子用98%浓硫酸溶液灭菌10 min, 无菌水洗涤数次, 洗净种子表面残留酸液, 晾干。将经浓硫酸处理过的种子分成若干份, 进行高压静电场处理。以实验室前人对不同电场处理条件(电场强度、处理时间)对甘草种子萌发影响的实验为基础[10], 选取对甘草种子发芽影响显著的3个电场处理条件对本实验甘草种子进行处理。电场强度E=12 kV/cm, 处理时间T=15 min, 记做E1; 电场强度E=15 kV/cm, 处理时间T=15 min, 记做E2; 电场强度E=18 kV/cm, 处理时间T=25 min, 记做E3.未加电场处理的设置为对照, 记做CK。
高压静电场处理之后, 10%次氯酸钠溶液消毒15 min, 无菌水洗涤数次, 晾干。播种于MS培养基中, MS培养基的配制参照关于甘草组培的研究[11-12]培养生长条件为(25±2) ℃, 12 h光照培养/12 h暗培养周期。取生长14 d的甘草苗, 每种处理包括 3 个重复, 每个重复包含 10颗幼苗。以备实验使用。
1.3 部分生理数据采集
使用乙醇提取叶绿素, 测波长663 nm和645 nm处的OD值, 计算叶绿素含量[13]。
使用考马斯亮蓝G-250染色法测定可溶性蛋白的含量, 提取甘草幼苗的可溶性蛋白, 测定波长595 nm处测定OD值, 以牛血清白蛋白为标准计算蛋白含量[14]。
使用电导率测定法检测叶片质膜透性, 计算相对电导率[15-16]。
使用TTC(氯化三苯四氮唑)染色法测量根系活力, 测定波长480 nm处测定OD值, 计算还原量[15-16]。
使用紫外吸收法测定甘草中的过氧化氢酶(CAT)活性, 记录240 nm处的吸光度OD值, 计算过氧化氢酶的活性[17]。
使用愈创木酚法测定甘草中的过氧化物酶(POD)活性, 记录470 nm处的吸光度OD值, 计算过氧化物酶的活性[18]。
使用氮蓝四唑(NBT)还原法测定甘草中的超氧化物歧化酶(SOD)活性, 记录560 nm处的吸光度OD值, 计算超氧化物歧化酶的活性[15-16]。
1.4 数据处理与分析
实验数据采用 Excel 2007 和Origin 9软件处理和绘图, 并用SPSS 23进行不同处理间的指标显著差异分析。
2 结果与分析
2.1 高压静电场处理对叶绿素的影响
由表1, 不同电场处理对甘草幼苗叶绿素含量影响不同。“赤峰甘草”E1组幼苗叶片Chl a、Chl b 与CK无显著性差异, E2组、E3组幼苗叶片Chl a、Chl b 增加减少量较为显著, 说明较低的电场场强对“赤峰甘草”幼苗叶绿素造成的影响不大。对“鄂尔多斯甘草”品种来说, E1组幼苗叶片Chl a 含量比CK组降低约6.41%, Chl b 比CK组降低约14.56%,差异不显著; E2组Chl a 含量比CK组降低约13.58%, Chl b 降低23.36%; E3组Chl a降低约16.20%, 而Chl b增加8.14%。这些结果表明, 高压静电处理对两个品种甘草幼苗叶绿素均造成不同程度的影响。植物在不断生长衰老过程中, 叶绿素会不断遭到分解和破坏[5, 19]。当叶绿素含量维持相对稳定时, 可有助于植物缓解衰老的进程。
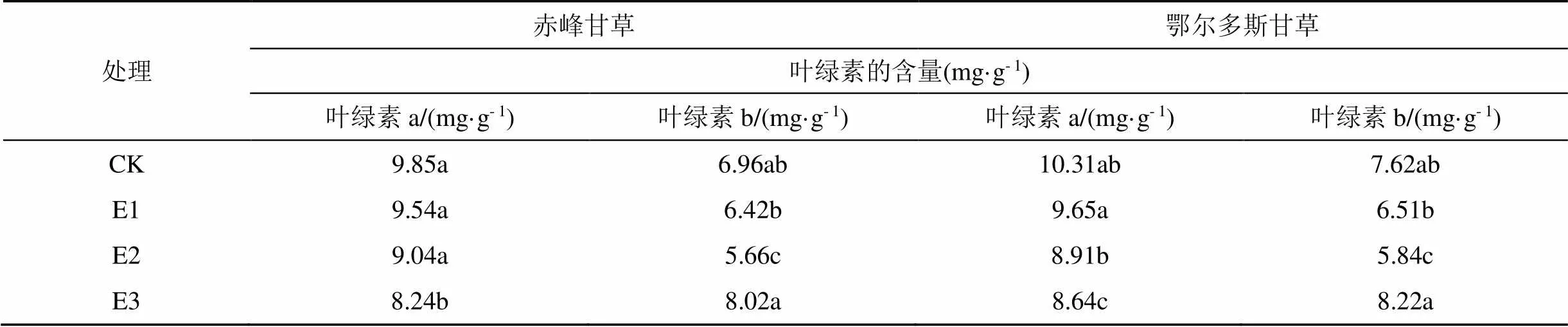
表1 电场处理后幼苗的叶绿素含量
注: 不同小写字母代表同列差异显著。
2.2 高压静电场处理对可溶性蛋白的影响
在研究有关植物营养、代谢等作用以及生长发育等生命活动时, 测定样品中可溶性蛋白质含量成为一个必要指标。如表2, “赤峰甘草”E1组可溶蛋白含量与CK组相比提高36%, 显著增加; E2组增加幅度不大, 仅6.4%; E3组提高显著, 幅度高达47%。各组别之间相互对比, 可溶性蛋白含量显示出明显的差异。就“鄂尔多斯甘草”而言, E1、E2组有所提高, 但幅度不大; E3组增加幅度明显, 约达33.89%.甘草多生长在干旱、半干旱的荒漠草原、沙漠边缘和黄土丘陵地带, 生长环境较为恶劣多变。高含量的可溶性蛋白可以协助维持甘草细胞的渗透势[20], 减少不良环境胁迫的伤害。
2.3 高压静电场处理对甘草幼苗叶片相对电导率的影响
如图1, 不同静电场处理, 同一生长阶段的两品种甘草的相对电导率不同。就“赤峰甘草”品种而言, E3组相对电导率最低, 大约降低50%, E2组降低最少, 大致有40%。而“鄂尔多斯甘草”品种甘草, E1、E2、E3组均低于CK组, 但波动情况和“赤峰甘草”不一致。降低最明显的是E2组, 大致为53%; 降低最少的是E3, 大致为37%。电导率与细胞膜的透性息息相关。经过高压静电场处理后, 两品种甘草幼苗叶片均表现低水平的相对电导率, 膜系统处于健康通透的状态。
2.4 高压静电场处理对根系活力的影响
植物根系活力是权衡植物体根系生理特性的重要参数。从图2可以看出, 两品种甘草在 E1, E2, E3场强条件下, 根系活力均比CK有所提高。“赤峰甘草”中, E1 条件下, 根系活力提高幅度最大, 约为对照组的2.1倍; E2, E3组根系活力分别提高23%, 50.3%。“鄂尔多斯甘草”中, E3条件下, 根系活力增加最显著, 约为对照组的2.9倍; E1, E2组根系活力分别是CK组的2倍、2.5倍, 差异显著(< 0.05)。因此, 可以知道高压静电场处理将提高根系活力, 不同品种适合的电场强度有所不同。
2.5 高压静电场处理对抗氧化性酶的影响
CAT活性变化在植物体氧化和抗氧化的平衡中扮演着重要的角色[18]。从图3可以看出, 高压静电场处理促使两种甘草幼苗的CAT活性变化。E1、E2、 E3三种处理条件下赤峰甘草CAT活性分别较CK组增加110%、10%和115%。而“鄂尔多斯甘草”在不同强度电场处理下幼苗叶片的CAT活性变化趋势与“赤峰甘草”表现不同, E1组明显高于CK, 约达2.2倍, 达到差异水平(< 0.05); E3组CAT活性提高约43%; 而E2组较CK组而言, CAT活性些许降低。表明低强度的静电场可使两品种甘草幼苗叶片CAT活性均升高。

表2 电场处理后可溶蛋白含量的变化
注: 不同小写字母代表同列差异显著。

图1 电场处理后相对电导率的变化
Figure 1 Effects of HVEF treatment on relative conductivity of licorice system

图2 电场处理之后根系活力的变化
Figure 2 Effects of HVEF treatment on vigor of licorice root system
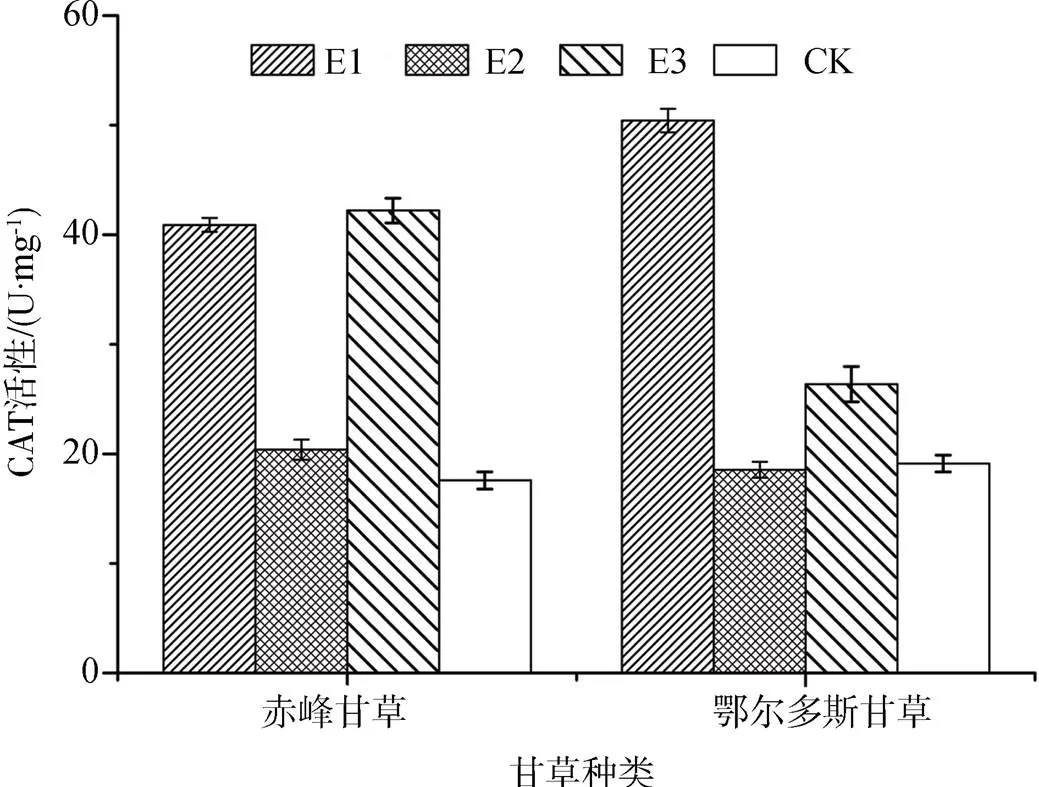
图3 电场处理后甘草幼苗叶片的CAT活性
Figure 3 Effects of HVEF treatment on CAT activity of licorice seedling leaves
POD不仅是植物体内重要的氧化还原酶, 还是细胞呼吸代谢的末端氧化酶[5, 21-23]。如图4, “赤峰甘草”和“鄂尔多斯甘草”在不同电场处理条件下, 表现出不同形势的变化。“赤峰甘草”中E1组POD活性没有明显到的激活效应, 而E2、E3组POD活性均发生明显变化, 约为CK组的120%和145%。三种电场处理使“鄂尔多斯甘草”幼苗叶片POD活性分别增加为对照的133%、121%和117%。这些结果说明POD在电场处理后两品种甘草的抗氧化损伤方面发挥着重要的调节作用。
SOD不仅是植物体内重要的保护酶之一, 也是重要的活性氧清除剂[23-24]。从图5可以看出, 三种电场处理下, “赤峰甘草”幼苗叶片SOD活性激活效应相差不大, 依次增加到CK组的133%, 135%, 131%, 差异较为显著。就“鄂尔多斯甘草”而言, E1、E2、E3组SOD活性较CK组依次增加145%, 151%, 148%, 差异达到显著水平(< 0.05)。由此可见, 三种电场处理后两品种甘草幼苗叶片SOD活性均升高, 表明甘草中SOD 对电场处理感应效果敏感, 且在保护甘草免收外来刺激中发挥着重要的作用。

图4 电场处理后甘草幼苗叶片的POD活性
Figure 4 Effects of HVEF treatment on POD activity of licorice seedling leaves

图5 电场处理后甘草幼苗叶片的SOD活性
Figure 5 Effects of HVEF treatment on SOD activity of licorice seedling leaves
3 讨论
研究记录, 世界上, 甘草属的植物有20种, 在我国有12种, 其中3种经《中国药典》[25]认定为甘草药材植物。乌拉尔甘草就是其中之一。野生乌拉尔甘草主要分布在新疆、内蒙古、宁夏、甘肃等地区; 人工种植甘草主产于新疆、内蒙古、甘肃的河西走廊, 陇西的周边, 宁夏部分地区。由于对甘草的大量需求量, 野生甘草严重供不应求[26], 研究中多以人工栽培种子为主, 为兼顾种子来源地域差异性, 本文特使用两地来源的乌拉尔甘草作为实验材料。
静电场是一种综合的效应场, 集聚电磁辐射、恒定电场及粒子束的作用, 电场作用在生物膜上, 等同于作用在等价RC电路[27]; 置于电场中的植物种子作为电解质受到极化作用, 植物体内发生着变化[28]。高压静电场场强不同, 甘草幼苗的响应不同。两品种乌拉尔甘草种子经不同强度高压静电场处理一定时间之后, 幼苗的叶绿素含量、相对电导率、根系活力、可溶性蛋白质含量和各种抗氧化性酶活性有明显的变化。结果表明, 就叶绿素而言, 高压静电场处理延缓了叶绿素的合成进程, 其中鄂尔多斯甘草比赤峰甘草响应更为明显, 两品种中均发现叶绿素b受电场影响程度高于叶绿素 a; 可溶性蛋白含量不同程度的提高, 这可能是因为在静电效应下, 植物体内蛋白质长链结构被破坏、蛋白解体, 分散、凝聚成新的蛋白[28-31]。相对电导率与细胞膜的透性息息相关, 从这一指标中, 静电场作用对细胞膜的正常运作起到促进作用, 一定程度上增强抗逆能力; 根性活力的增强意味着适当的高压静电场作用增强甘草的根部系统的能力。CAT、POD、SOD 三者皆为重要的抗氧化酶, 负责维持植物细胞内抗氧化酶清除系统[32-33]。上述结果中, 两品种甘草种子经过高压静电场处理后, 幼苗CAT、POD、SOD酶活性显著高于对照组, 这是由于电场效应改变了生物体的电特性, 电场处理种子, 使甘草种子生物膜上的电荷分布发生变化, 导致膜电位发生变化, 使种子在吸水之后, 离子扩散与电致离子泵系统转运活跃, 与此同时更多的ATP被合成, 静电场不仅影响了膜透性, 而且也改变了酶的活性。两品种甘草叶片中SOD酶表现出对静电场处理的敏感性响应要高于CAT和POD, 这可能是因为SOD处于清除活性氧系统的第一道防线, 可将超氧阴离子歧化为H2O2[32]。经过适当的高压静电场处理, 抗氧化性酶活性升高, 说明生物体经电场作用, 生物体内的酶呈现出更多种有利于植物生长代谢的构象。因此, 生物表现各指标生理生化响应与静电场效应有明显的相关性。是促进作用还是阻碍作用, 决定于选择电场处理条件中的电场强度、处理时间等。
干旱区、半干旱的沙土区、沙漠、黄土丘陵地区是种植生长植物最为艰难的地方。甘草以其独特的生长特性, 是少数适合艰苦、恶劣条件的多用型植物之一[28]。植物固着生长贯穿整个生命过程, 完全暴露于自然环境中, 不能主动躲避不良环境的侵害, 只能通过自身的防御机制来抵御和适应逆境胁迫, 而适当静电场效应在调控植物应对不良环境胁迫中起帮助作用, 有利于种子的萌发及植株的生长, 使其拥有更强的抗逆能力, 并增强其形成稳定群落的能力[34-35], 为提高甘草的抗胁迫能力提供参考。
高压静电场处理两品种乌拉尔甘草种子对幼苗的生理生化指标既起到促进作用又产生阻碍作用, 造成不同的作用效果决定于选择处理条件的电场强度、处理时间等。经过高压静电场处理的两品种甘草种子, 通过室内组织培养的方式培育幼苗, 与对照组比较, 两品种甘草幼苗的叶绿素含量、相对电导率、根系活力、可溶性蛋白质含量以及抗氧化性酶活性均发生了显著性变化。结果表明, 两品种甘草经过电场处理后叶片叶绿素含量鄂尔多斯甘草比赤峰甘草变化明显, 叶绿素b受电场影响程度高于叶绿素 a; 相对电导率在赤峰甘草叶片敏感程度高于鄂尔多斯甘草, 而在根系活力这一项中, 与对照相比, 鄂尔多斯甘草的电场效应更为明显; CAT、POD、SOD 三者皆为重要的抗氧化酶, 负责维持植物细胞内抗氧化酶清除系统[25-26]。上述结果中, CAT活性在低电场中表达最佳。CAT、POD两种酶的活性在两品种甘草中, 表达量有差异, 可能是由于CAT和POD 都是负责催化H2O2形成H2O, 减小细胞免受伤害[27-28]; 两品种甘草叶片中SOD酶表现出对静电场处理的敏感性响应要高于CAT和POD, 这可能是因为SOD处于清除活性氧系统的第一道防线, 可将超氧阴离子歧化为H2O2[25]。这说明高压静电场处理甘草种子具有增强甘草幼苗各类生理生化指标作用, 同时为延缓衰老和抵抗逆境提供可能性。
干旱区、半干旱的沙土区、沙漠、黄土丘陵地区是种植生长植物最为艰难的地方。甘草以其独特的生长特性, 是少数适合艰苦、恶劣条件的多用型植物之一。恰当的高压静电电场处理此类植物, 有利于种子的萌发及植株的生长, 使其拥有更强的抗逆能力, 并增强其形成稳定群落的能力[29-30], 增强其固土、固沙的能力。本研究只是探讨了高压静电场对两品种甘草幼苗阶段生理生化特性的影响, 不能反映整体生命周期相关生理生化指标变化情况。在自然界中, 所有的生物体都有属于自己的生理生化特性和电磁效应[31], 不同植物对不同电场条件响应是不同的, 想要深层次的了解高压静电场处理对植物种子的影响机制, 建议进一步从分子层面研究。
[1] MURR L E. Mechanism of Plant Cell Damage in an Electrostatic Field[J]. Nature. 1964, 210: 1305.
[2] 吴连连, 李新建. 高压静电场保鲜技术的研究现状[J]. 现代农业科技, 2007(3): 123–124.
[3] 杨秀兰. 高压静电场对小麦种子及幼苗某些生理性状的影响[D]. 长春: 东北师范大学, 2004.
[4] 马福荣, 许守民, 王树斌, 等. 静电场对植物叶片光合性能和蛋白质含量的影响[J]. 东北师大学报(自然科学版), 1991(4): 53–56.
[5] 陈庆. 高压静电场对采后绿芦笋生理特性影响的研究[D].南昌: 江西农业大学, 2015.
[6] RADU C, VICTOR D, MONA P. The biological effect of the electrical field treatment on the potato seed: agronomic evaluation[J]. Journal of Electrostatics, 2005, 63: 837–846.
[7] KATARZYNA D, PETR D, VALENTINA P. Effect of pulsed electric field on the germination of barley seeds[J]. LWT-Food Science and Technology, 2012, 47(1): 161–166.
[8] CHRISTIAN J E, SIMONE B, MICHAEL P. Effect of nanosecnd pulsed electric field exposure on Arabidopsis thaliana [J]. IEEE Transactions on Dielectrics and Electrical Insulation, 2009, 16(5): 1322–1328.
[9] EVELINA C. The influence of an electric field on the growth of soy seeding [J]. Journal of Electrostatics, 2008, 64: 417–420.
[10] 李亚娇. 负高压静电场对甘草种子萌发及几项生理指标的影响[D]. 呼和浩特: 内蒙古大学, 2016.
[11] 满淑丽, 刘延涛, 张咪, 郭松波, 高文远. 甘草组培与栽培主要成分的提取及活性比较[J]. 天津科技大学报, 2015, 30(4): 17–20.
[12] 苏姗. 优质甘草组培快繁及遗传稳定性分析[D]. 石家庄:河北科技大学, 2015.
[13] 郑炳松. 现代植物生理生化探究技术[M]. 北京: 气象出版社, 2009.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dyebinding[J]. Analytical Biochemistry, 1976, 72: 248–254.
[15] 李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000.
[16] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003.
[17] AEBI H. Catalase in vitro[J]. Methods in Enzymology, 1984, 105: 121–126.
[18] RAO M V, PALIYATH C, ORMROD D P. Ultraviolet-B and ozone-induced biochemical changes in antioxidant enzymes of Arabidopsis thaliana[J]. Plant Physiology, 1996, 110: 125–136.
[19] 闫晓花, 郁继华. LED补光对温室黄瓜幼苗抗衰老及抗氧化酶系统的影响[J]. 中国沙漠, 2016, 36(2): 392–398.
[20] 张盼盼, 冯佰利, 王鹏科, 等. PEG胁迫下糜子苗期抗旱指标鉴选研究[J]. 中国农业大学学报, 2012, 17(1): 53–59.
[21] 邱琳, 王娜, 周青. 镧对酸雨胁迫下高粱种子萌发及POD活性和MDA含量的影响[J]. 中国生态农业学报, 2009, 17(2): 343–347.
[22] 魏学玲. 重金属铅胁迫对小麦种子萌发及幼苗生理生化特性的影响[D]. 兰州: 西北师范大学, 2010.
[23] 高静鸿. 高压静电场对采后葡萄果实品质及花色素还原酶表达的影响[D]. 晋中: 山西农业大学, 2015.
[24] 高雪红. 高压静电场预处理黄豆对其幼芽生物成份的影响[D]. 西安: 陕西师范大学, 2008.
[25] 国家药典委员会. 中国药典(第一版)[S]. 北京: 中国医药科技出版社, 2010.
[26] 李倩, 高海荣, 郭九峰. 甘草主要化学成分及药效活性与环境关系研究进展[J]. 黑龙江农业科学, 2019(9): 146– 149.
[27] 黄洪云. 高压静电场对大豆幼苗生长的影响[J]. 大豆科学, 2012, 31(6): 1030–1032.
[28] 李倩. 甘草DNA甲基转移酶基因在高压静电场胁迫下的表达及其系统发育分析[D]. 呼和浩特: 内蒙古大学, 2019.
[29] LEE H K. Electrical sterilization of Escherichia coli by electrostatic atomization [J]. Electrostat, 2001, (5/52): 71–75.
[30] ICHIM D, CREANGA D, RAPA A. The influence of the electrostatic stress on cell proliferation in plants[J]. Journal of Electrostatics, 2007, 65(7): 408–413.
[31] 田芹. 静电场胁迫处理诱导不同基因型水稻DNA甲基化变异[D]. 长春: 东北师范大学, 2010.
[32] 孙小霞.高羊茅对铅递进胁迫的生理响应[J]. 河南科技大学学报, 2006, 27(6): 75–78.
[33] 张刚, 李里特, 丹阳.果蔬成熟衰老中的活性氧代谢[J]. 食品科学, 2004, 25: 225–229.
[34] 黄洪云, 那日, 杨生. 电场处理对毛乌素沙地沙生植物抗逆性影响的研究进展[J]. 中国水土保持, 2007(1): 43–46.
[35] 那日, 杨生, 杨体强, 等. 模拟沙地干旱环境研究电场对两种沙生植物抗旱性的影响[J]. 中国沙漠, 2005(1): 115–119.
Effect of high voltage electrostatic field treatment on physiological characteristics of
LI Qian1, GUO Jiufeng1,*, GAO Hairong2
1. Key Experiment of Ion Beam Life Engineering, College of Physical Science and Technology, Inner Mongolia University, Huhhot 010020, China 2.College of Life Sciences,Inner Mongolia University,Huhhot 010020, China
Two kind of licorice from Chifeng and Ordos cultivated by tissue culture were used as materials for research. The effects of high voltage electrostatic field treatment on physiological characteristics such as chlorophyll content, permeability regulator content and antioxidant enzyme activity were studied. It was found that the suitable high-voltage electrostatic field effect promoted the growth process and metabolism of licorice seedlings. Compared with the control group, the soluble protein, chlorophyll content, relative conductivity, root activity and antioxidant enzymes of the licorice seedlings after electric field treatment were all changed. Studies indicated that the chlorophyll of the leaves of the two varieties of licorice seedlings was hindered to varying degrees in the electric field treatment, but they could alleviate the regulation by increasing the antioxidant enzyme activity, osmotic adjustment substance content and root activity in the body, thus indicating the high voltage electrostatic field treatment to seeds could make licorice more tolerant and it could provide a new ideareliable solution for resisting stress.
high voltage electrostatic field;; chlorophyll; root activity; antioxidant enzyme
李倩, 郭九峰, 高海荣. 高压静电场处理对乌拉尔甘草生理特性影响[J]. 生态科学, 2022, 41(3): 142–148.
LI Qian, GUO Jiufeng, GAO Hairong. Effect of high voltage electrostatic field treatment on physiological characteristics of[J]. Ecological Science, 2022, 41(3): 142–148.
10.14108/j.cnki.1008-8873.2022.03.016
S157.2
A
1008-8873(2022)03-142-07
2019-12-07;
2020-02-14
国家自然科学基金(51467014)
李倩(1993—), 女, 硕士, 主要从事环境生物物理和分子技术研究, E-mail: 934192500@qq.com
郭九峰, 教授, 主要从事生物物理与生物技术研究, E-mail: guojf101@sina.com
