响应面法优化玉米浸液蛋白提取工艺及单细胞蛋白发酵的研究
2022-05-14骆杨庆吴增林李升福张俊杰
骆杨庆,吴增林,李升福,张俊杰,段 蕊,
(1.江苏海洋大学食品科学与工程学院,江苏连云港 222005;2.连云港环海化工有限公司,江苏连云港 222066;3.罗盖特(中国)营养食品有限公司,江苏连云港 222005;4.江苏省海洋生物技术重点实验室,江苏连云港 222005)
玉米浸液是玉米深加工过程中产生的副产物[1],含有丰富的营养物质,如可溶性蛋白质、游离脂肪酸、可溶性糖类和维生素等[2]。目前玉米浸液用途单一,一般经过浓缩后作为工业发酵的氮源使用,没有充分体现其营养价值[3]。近几年,学者做了关于玉米浸液用途的研究。利用玉米浸液为原料,通过树脂吸附、离心分离去除杂质,采用两次加碱法生产医用植酸钙,提高了玉米浸液的附加值[4]。用玉米浸液生产植物蛋白调味液[5−7]。高健等研究了玉米蛋白双酶水解产物的体外脾淋巴细胞增殖活性[8]。Gudina Eduardo J和Danyelle Khadydja F等以玉米浸液为原料,用芽孢杆菌、酵母菌生产表面活性剂[9−10]。李小雨等以玉米浸液和废糖蜜为原料,用混合酵母菌生产单细胞蛋白[11]。Lin等用玉米皮渣的酸水解液为主要原料,加入适量玉米浸液及无机盐,通过发酵生产药用单细胞蛋白[12]。玉米浸液中含有40%蛋白质,可以作为优质的蛋白来源。2020年国内消耗2.9亿吨玉米,产生上亿吨的玉米浸液,如将该部分蛋白质充分利用,开发具有附加值产品,可进一步增加玉米加工企业的经济效益[13]。
本文用等电点法[14]提取玉米浸液中的蛋白质,并以酿酒酵母、产朊假丝酵母发酵提取蛋白质后的上清液,生产单细胞蛋白。通过单因素实验、响应面试验确定等电点法提取蛋白质的工艺参数,并研究了用酿酒酵母、产朊假丝酵母发酵离心上清液生产单细胞蛋白的条件。以期进一步开发利用玉米浸液,使其营养成分得到更加广泛的应用,促进我国玉米深加工的发展[15]。
1 材料与方法
1.1 材料与仪器
玉米浸液 罗盖特(中国)营养食品有限公司;产朊假丝酵母(Candida utilis) 中国普通微生物菌种保藏管理中心;酿酒酵母(Saccharomyces cereviae) 安琪酵母股份有限公司;蛋白胨、酵母膏 赛默飞世尔科技(中国)有限公司;其它常规试剂 国药集团化学试剂有限公司。
YXQ-LS-50SII立式压力蒸汽灭菌锅 上海博迅实业有限公司;BM-1000生物显微镜 南京江南永新光学有限公司;754N紫外可见分光光度计 上海奥谱勒仪器有限公司;CP313电子精密天平 奥豪斯仪器(上海)有限公司;D-37520冷冻离心机 赛默飞世尔科技(中国)有限公司;TC-2102C振荡培养箱 上海福玛设备有限公司;PB-10 pH计 上海精密科学仪器有限公司;磁力搅拌器 丹瑞仪器。
1.2 实验方法
1.2.1 等电点法提取玉米浸液蛋白工艺

取适量玉米浸液,用NaOH调节pH,在一定温度下静置一段时间,采用离心机以转速5000 r/min、离心时间20 min分离粗蛋白及离心上清液,通过双缩脲法测定蛋白质含量并计算粗蛋白提取率。以离心上清液培养酿酒酵母和产朊假丝酵母,生产单细胞蛋白。
1.2.1.1 提取pH试验单因素设计 参照李晓明、孙小斐等[16−17]的方法并作适当修改。取80 mL玉米浸液,用10 mol/L NaOH溶液将其pH分别调至5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,15 ℃静置15 min。采用离心机5000 r/min、20 min分离粗蛋白,通过双缩脲法分别检测玉米浸液、离心上清液的蛋白质含量,依据粗蛋白提取率确定最佳提取pH。
1.2.1.2 提取温度试验单因素设计 取80 mL玉米浸液,用10 mol/L NaOH溶液调节玉米浸液pH为7.0,分别于5、15、30、45、60 ℃下静置15 min。采用离心机5000 r/min、20 min分离粗蛋白,通过双缩脲法分别检测玉米浸液、离心上清液的蛋白质含量,依据粗蛋白提取率确定最佳提取温度。
1.2.1.3 提取时间试验单因素设计 取80 mL玉米浸液,用10 mol/L NaOH溶液调节玉米浸液pH至7.0,15 ℃分别静置5、10、15、20、25、30 min。离心测定蛋白质含量,确定最佳提取时间。
1.2.1.4 等电点法提取玉米浸液蛋白工艺优化响应面设计 使用Design Expert 8.0.6软件进行响应面设计。以pH、提取温度、提取时间3个考察因素及其变化水平设计三因素三水平响应面方案,试验因素设计如表1[18−20]。

表1 响应面设计因子水平表Table 1 Factors and levels of the response surface analysis
1.2.1.5 粗蛋白提取率的计算 取适量玉米浸液、离心上清液样品,以1:4的比例加入双缩脲试剂,混匀后置于25 ℃水浴锅发色30 min,用紫外分光光度计在波长为560 nm处测定其吸光值,通过牛血清蛋白标准曲线计算出玉米浸液中的蛋白质量C1、离心上清液中的蛋白质量C2,并以下列公式计算粗蛋白的提取率W。

式中:W表示粗蛋白提取率,%;C1表示玉米浸液中的蛋白质量,g;C2表示离心上清液中的蛋白质量,g。
1.2.2 单细胞蛋白发酵工艺
1.2.2.1 种子培养液制备 制备酵母浸出粉胨葡萄糖培养基(YPD培养基):酵母膏1.0%、蛋白胨2.0%、葡萄糖2.0%、琼脂1.5%,pH6.8。将2 g葡萄糖溶于100 mL蒸馏水中,分别向溶液中加入1 g酿酒酵母、产朊假丝酵母,放入30 ℃的水浴锅中活化30 min,并在YPD培养基中培养,挑选菌落大、菌体壮的纯酵母制成种子培养液供发酵使用。
1.2.2.2 上清液中干物质浓度对发酵的影响 参照裴璞花、刘延波等[21−22]的方法并作适当修改。将离心后的上清液干物质浓度分别配制成5%、8%、10%,调pH至6.5,分别接种10%的酿酒酵母菌种、产朊假丝酵母菌种,置于震荡培养箱中,在温度29 ℃、转速160 r/min下培养24 h,依据平板计数法得出菌落数量,确定最佳上清液的发酵浓度。
1.2.2.3 葡萄糖添加量对发酵的影响 将干物质浓度为10%的离心上清液pH调至6.5,分别接种10%酿酒酵母菌种、产朊假丝酵母菌种,并以添加量0、0.5%、1%、1.5%加入葡萄糖,在温度29 ℃、转速160 r/min下培养24 h,依据平板计数法得出菌落数量,确定最佳葡萄糖添加量。
1.2.2.4 pH对发酵的影响 将干物质浓度为10%的离心上清液,pH分别调至5.0、5.5、6.0、6.5,并接种10%酿酒酵母菌种、产朊假丝酵母菌种,在温度29 ℃、转速160 r/min下培养24 h,依据平板计数法得出菌落数量,确定最佳发酵pH。
1.3 数据处理
本试验每次数据重复3次,取平均值,用Microsoft Excel进行数据图表处理,用SPSS 23.0软件进行显著性分析,用Design Expert 8.0.6进行响应面试验数据分析[23]。
2 结果与分析
2.1 等电点法提取玉米浸液蛋白工艺研究结果
2.1.1 pH对蛋白提取率的影响 玉米浸液的pH对蛋白质提取有重要影响,蛋白质为两性电解质,在酸性、碱性条件下,其表面的带电性质增强了其溶解性,当溶液达到其等电点时,溶液呈电中性,分子间的斥力消除,蛋白质分子慢慢结合成大分子,形成沉淀[13,24]。蛋白质在不同pH下的提取率如图1所示,当pH由5.5上升至7.5时,蛋白质提取率显著上升(P<0.05),这是因为溶液慢慢接近其等电点,蛋白质分子间的氢键被打破,促进了蛋白质分子的溶出,形成大分子沉淀[25];当pH为7.5时,蛋白提取率达到72.4%;但是随着pH由7.5上升至9.0,蛋白质的提取率差异不显著(P>0.05),这是因为pH7.5时,大部分蛋白质已经形成大分子沉淀,当溶液pH超过蛋白质的等电点后,溶液中剩余的蛋白质重新带电,出现斥力[26−27]。因此,初步判定玉米浸液的等电点为7.5。

图1 不同pH条件下玉米浸液中蛋白提取率Fig.1 Protein extraction rate of corn steep liquor under different pH
2.1.2 温度对蛋白提取率的影响 蛋白质在热变性过程中,吸收热量时由一个有序状态变成无序状态,蛋白质变性是它的构象以任何方式的改变(二级、三级或四级),它并不伴随着一级结构中肽键的断裂而改变。热是引起蛋白质变性最普通的物理因素[15,28]。由图2可知,提取温度在15到30 ℃范围时,粗蛋白提取率显著上升(P<0.05),这是因为适当的温度有利于玉米浸液中蛋白质沉淀。当温度高于45 ℃时,玉米浸液中的蛋白质发生变性,提取率下降[29]。因此,初步判定提取温度为30 ℃。
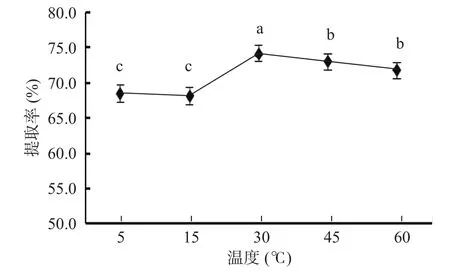
图2 不同温度条件下玉米浸液中蛋白提取率Fig.2 Protein extraction rate of corn steep liquor under different temperature
2.1.3 静置时间对蛋白提取率的影响 由图3可以看出,蛋白质提取率随着静置时间呈现先增加后降低的趋势,当静置时间为5~20 min之间时,蛋白质提取率随静置时间的升高显著上升(P<0.05)。分析原因可能是液碱与蛋白质接触需要一定时间才能使蛋白质逐步沉淀,时间过短液碱与蛋白质接触不充分,蛋白沉淀效果不好。而随着静置时间继续增长时,提取率呈现下降趋势,这可能是由于在该pH条件下,部分蛋白质没有达到等电点,随着时间增长,分子间的斥力增加[15]。根据图3判定最佳的提取时间为20 min。

图3 不同静置时间玉米浸液中蛋白提取率Fig.3 Protein extraction rate of corn steep liquor under different standing time
2.1.4 等电点法提取玉米浸液蛋白工艺优化响应面设计结果 以pH、提取温度、提取时间为变量,以粗蛋白提取率为响应值,设计响应面分析试验,试验结果见表2,方差分析结果见表3。

表2 响应面试验结果Table 2 Response surface test results

表3 响应面方差分析结果Table 3 Analysis of variance results of response surface test
用Design Expert 8.0.6软件对表2中的相应值进行多元二次分析,得到粗蛋白提取率的回归模型方程如下:

该方程的R2为99.42%,模型达到显著水平(P<0.0001),失拟项不显著,表明该模型拟合性能良好、方法可靠[30]。模型的R2=99.42%,说明响应值变化的99.42%与选择的变量相关,模型校正决定系数R2Adj=0.9866,表明此回归方程可以表示响应值变化具有可行性[31]。
根据以上回归方程绘制响应面交互作用曲面图,研究pH、提取温度、提取时间三个因素对粗蛋白提取率的影响,响应面如图4~图6。

图4 pH和提取温度对粗蛋白提取率的交互影响Fig.4 Interactive effects of pH and extraction temperature on the extraction rate of crude protein

图5 pH和提取时间对粗蛋白提取率的交互影响Fig.5 Interactive effects of pH and extraction time on the extraction rate of crude protein

图6 提取温度和提取时间对粗蛋白提取率的交互影响Fig.6 Interactive effects of extraction temperature and time on the extraction rate of crude protein
pH、提取温度、提取时间对粗蛋白提取率的影响趋势可以通过图4~图6直接得出,pH对粗蛋白提取率的影响较大,表现为曲线较陡;提取温度、提取时间对粗蛋白提取反映率的影响较小,表现为曲线相对平滑。通过软件分析,确定等电点法提取玉米浸液蛋白工艺的最佳提取条件:pH为7.6、提取温度为26.4 ℃、提取时间为20 min,在此条件下粗蛋白提取率为77.8%。验证试验得到的粗蛋白提取率为77.5%,这与模型预测值的相对偏差为0.39%,说明该模型的提取条件可以反映粗蛋白提取率,具有较好的实际应用价值。
2.2 单细胞蛋白发酵试验研究结果
2.2.1 种子培养基 图7是经过活化、平板涂布及三区划线得到的酿酒酵母与产朊假丝酵母菌种形态。酿酒酵母菌落圆润饱满,表面光滑、湿润、黏稠,质地均匀柔软,边缘与中央部位的颜色较一致,为乳白色,有酒香味;产朊假丝酵母的菌落呈灰奶油色,半暗,软而平滑,符合酵母菌的特征[32]。

图7 酿酒酵母与产朊假丝酵母三区划线Fig.7 Zone marking of Saccharomyces cerevisiae and Candida utilis
2.2.2 上清液浓度对发酵的影响 用酿酒酵母与产朊假丝酵母对不同干物质浓度的离心上清液进行发酵培养。由图8可知,离心上清液干物质浓度为5%、8%时,酿酒酵母发酵得到的菌落数量不显著(P>0.05);干物质浓度为8%时,酿酒酵母发酵得到的菌落数为7.5×107CFU/mL;干物质浓度为10%时,酿酒酵母发酵得到的菌落数量下降显著(P<0.05),为5.8×107CFU/mL。离心上清液干物质浓度由5%增加至8%时,产朊假丝酵母发酵得到的菌落数量上升显著(P<0.05),干物质浓度为5%时得到的菌落数为1.24×108CFU/mL,浓度为8%时得到的菌落数为1.93×108CFU/mL。对比数据发现产朊假丝酵母的菌落数量比酿酒酵母的菌落数量多,这是由于产朊假丝酵母能够同化六碳糖、五碳糖,能够耐受高浓度的SO2,菌体中含有大量的蛋白质, 并含有大量赖氨酸和较多的维生素及多种微量元素[33]。酿酒酵母的蛋白质含量高, 发酵过程中能够产生醇、醛、酸、酯等风味物质,赋予饲料特殊的酸甜、香味, 但是酿酒酵母不耐亚硫酸盐,微量SO2即可阻碍其生长[34]。两种酵母中产朊假丝酵母优于酿酒酵母。离心上清液干物质浓度为8%时,产朊假丝酵母发酵得到的菌落数量最大,故选干物质浓度为8%的离心上清液进行发酵。
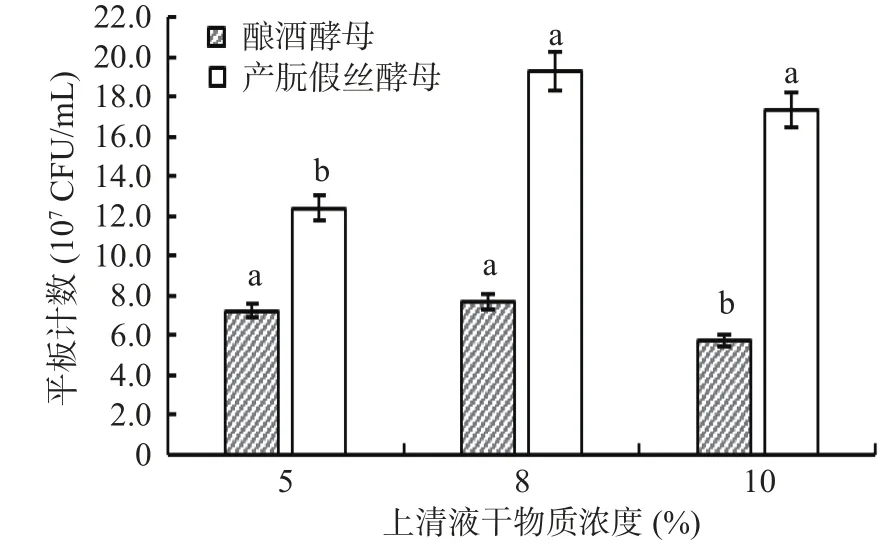
图8 两种酵母对不同上清液浓度的发酵效果Fig.8 Fermentation effects of two yeasts on different supernatant concentrations
2.2.3 不同葡萄糖添加量对发酵的影响 由图9可知,随着葡萄糖添加量增加,酿酒酵母发酵得到的菌落数量显著增加(P<0.05),当葡萄糖添加量为1.5%时,酿酒酵母发酵得到的菌落数量最大,达到1.54×108CFU/mL。这说明酿酒酵母在离心上清液中的发酵需要额外添加碳源,适宜的糖浓度可使酿酒酵母的代谢更旺盛[35]。随着葡萄糖添加量增加,产朊假丝酵母发酵得到的菌落数量变化不显著(P>0.05),这说明产朊假丝酵母利用离心上清液进行发酵时不需要额外增加碳源,菌落数量可以达到1.8×108CFU/mL,比添加量为1.5%葡萄糖时,酿酒酵母得到的菌落数量还要多。由此可得,不增加碳源情况下,产朊假丝酵母发酵要优于酿酒酵母。

图9 不同葡萄糖添加量对发酵的影响Fig.9 Effects of different glucose additions on fermentation
2.2.4 pH对发酵的影响 从图10可以得出,当pH由5.0升至5.5时,酿酒酵母发酵得到的菌落数量显著增加(P<0.05);pH由5.5升至6.0时,酿酒酵母发酵得到的菌落数量显著下降(P<0.05),之后菌落数量变化不明显,pH为5.5时,菌落数量最高,为7.6×107CFU/mL。产朊假丝酵母菌落数量的变化为:当pH由5.0升至5.5时,产朊假丝酵母菌落数量增长极显著(P<0.01),达到1.58×109CFU/mL,当pH由5.5升至6.0时,产朊假丝酵母菌落数量显著下降(P<0.05)。图中产朊假丝酵母菌落数量比酿酒酵母菌落数量多,说明该pH条件下,产朊假丝酵母更容易利用离心上清液进行发酵。由图10可知,pH为5.5时,产朊假丝酵母菌落数量最大,为其最适发酵pH[36]。

图10 不同pH对发酵的影响Fig.10 Effects of different pH on fermentation
3 结论
在本课题研究中,探索了用等电点法提取玉米浸液中蛋白质的方法,并把提取粗蛋白后的上清液也充分利用来生产单细胞蛋白。结果显示,等电点法提取蛋白的优化条件为:pH7.6、提取温度26.4 ℃、提取时间20 min,此条件下粗蛋白的提取率可以达到77.5%。酿酒酵母、产朊假丝酵母发酵离心上清液的研究可以得出:产朊假丝酵母发酵不需要额外添加碳源,更适合用于离心上清液生产单细胞蛋白,上清液浓度为8%,发酵pH为5.5,该条件下菌落数量可以达到1.6×109CFU/mL。本试验用到的试剂、酵母较为常见,操作简单,可提高玉米浸液的附加值,为玉米浸液的综合利用提供了一定的理论依据。
