去脂软肝方对非酒精性脂肪性肝炎大鼠FXR-FGF19通路的影响
2022-05-14夏恩蕊田格格张素妍张顺贞
夏恩蕊, 田格格, 张素妍, 张顺贞
云南中医药大学 中药学院, 昆明 650000
非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)中的炎症亚型,随着肥胖及其他代谢疾病的发病率增加,NASH的患病人数也逐步攀升[1]。已有研究[2]表明,对法尼醇X受体(FXR)进行调节,可使NASH得到不同程度的改善。在FXR-成纤维细胞因子19(FGF19)通路中,肠道FXR激活上调FGF19,FGF19随门静脉循环系统与肝细胞FGF受体4(FGFR4)结合,进而抑制胆汁酸合成酶CYP7A1,降低胆汁酸表达[3-4],减少机体对脂质的吸收。去脂软肝方在临床治疗NASH方面取得了较好疗效[5],本实验旨在探讨去脂软肝方对NASH大鼠FXR-FGF19通路的影响,为临床治疗NASH提供参考。
1 材料与方法
1.1 材料与仪器 雄性SD大鼠(180~220 g)44只购自湖南斯莱克景达实验动物有限公司,生产许可证号: SCXK(湘)2019-0004,实验单位使用许可证号: SYXK(滇)K2013-0002。去脂软肝方(兰花参、莪术、白术、山楂、菊花、三七、青皮);辛伐他汀片(Merck Sharp & Dohme BV,RO13440)。高脂饲料(82.5%普通饲料、10%猪油、2%胆固醇、0.5%胆酸钠、5%蛋黄粉)[6]。普通饲料购自楚商生物有限公司。IL-18、IL-1β、FGF19、胆汁酸(BA)试剂盒(江苏酶免,MM-20263R1)。FXR抗体(Affinity,DF12511)、CYP7A1抗体(Affinity,DF2612)。显微镜(德国ZEISS)、HE染色套装(Phygene,20200706)、饱和油红O(索莱宝,20200824)。ltrapure RNA Kit RNA提取试剂盒(康为世纪,CW0581S);HiFiScript cDNA Synthesis Kit(康为世纪,CW2569M);UltraSYBR Mixture(康为世纪,CW0957M)。垂直板电泳装置(TanonVE-180P RE)、垂直板电泳胶转膜仪装置(Tanon VE-586)、荧光定量PCR仪(Heal Force,CG)。
1.2 方法
1.2.1 动物造模、分组及给药 44只雄性SD大鼠适应性喂养1周后,随机分为正常组(Control组,n=8)、模型组(HFD组,n=12)、辛伐他汀组(Simvastatin组,n=8)、去脂软肝方高剂量组(QH组,n=8)、去脂软肝方低剂量组(QL组,n=8),Control组给与普通饲料喂养,其余组高脂饲料喂养。HFD组分别于4周末、8周末取2只大鼠验模,其余10周末取材。Control组、HFD组以生理盐水(2 mL/d)灌胃,Simvastatin组以辛伐他汀灌胃(给药剂量为1.8 mg/kg);QH组、QL组以去脂软肝方药液按生药量灌胃,给药剂量分别为27.72 g·kg-1·d-1、13.86 g·kg-1·d-1。
1.2.2 样本处理 10周末收集大鼠肝脏、血清、小肠。肝大叶用4%多聚甲醛固定常温保存,其余肝组织分装5份于2 mL离心管中。小肠取10 cm于4%多聚甲醛中固定,其余分装5份于2 mL离心管中。所有样品(4%多聚甲醛固定除外)保存于-80 ℃冰箱。
1.2.3 生化指标检测 采用全自动血清生化仪,检测大鼠血清中ALT、AST、TC、TG、HDL-C、LDL-C。
1.2.4 病理切片HE染色、油红O染色 取4%多聚甲醛固定后的10周大鼠肝脏,常规制备肝组织石蜡切片,进行HE染色,镜检。取相同周次样本,常规操作制备冰冻切片,油红O染色后封片,镜检。使用Image-Pro Plus 6.0软件统计油红O切片橘红色阳性区域累计光密度(IOD)与所选区域总面积(Area),计算阳性率(IOD/Area)。
1.2.5 ELISA试剂盒检测 根据试剂盒说明书,检测8周大鼠肝脏、小肠中FGF19,以及肝脏中BA。
1.2.6 qRT-PCR 按试剂盒步骤提取RNA,测定浓度和纯度。利用Primer 3软件设计引物序列,由华大基因合成,以RT-PCR方法检测小肠中FXR mRNA、肝脏中CYP7A1 mRNA。通过2-ΔΔCt法计算相对表达量。
1.2.7 免疫组化法 肝脏切片进行常规脱蜡复水、抗原修复、过氧化物酶结合、抗原封闭。滴加一抗4 ℃孵育过夜,37 ℃复温30 min,PBS冲洗;滴加二抗,37 ℃孵育20 min,PBS冲洗。DAB显色5 min,PBS冲洗,苏木精复染5 min,盐酸酒精分化1~3 s,自来水冲洗10 min,常规脱水,透明,封片,镜检。观察大鼠小肠中FXR、肝脏中CYP7A1表达情况。免疫组化结果使用Image-Pro Plus 6.0软件统计棕色阳性区域累计光密度(IOD)与所选区域总面积(Area),计算阳性率(IOD/Area)。

2 结果
2.1 肝脏病理变化 Control组大鼠肝细胞形态规则且排列有序,细胞核边缘清晰;HFD组肝细胞呈现大量脂肪空泡及气球样变,细胞排列紊乱,伴随肝细胞水肿和炎性渗出。与HFD组相比,各用药组脂肪变性情况改善,脂肪空泡减少,无明显炎性渗出,细胞形态较规则,肝索较为清晰。
Control组肝组织油红O染色切片细胞核清晰,大部分为蓝紫色,少见脂滴;HFD组出现大面积橘红色脂滴,数量较多,细胞形态不规则,呈现明显脂肪变性。与HFD组相比,各用药组橘红色脂滴阳性率均减少,其中QH组效果较为明显(图1、表1)。

表1 大鼠肝脏油红O切片阳性率比较

图1 肝脏病理切片(×400)
2.2 血脂和肝功能指标变化 与Control组相比,HFD组大鼠HDL-C显著下降,ALT、AST、TC、TG、LDL-C均显著上升(P值均<0.05)。与HFD组相比,各用药组的HDL-C显著升高,ALT、AST、TC、TG、LDL-C均显著下降(P值均<0.05)(表2)。

表2 大鼠血脂、血清肝功能指标比较
2.3 FXR-FGF19通路相关指标变化
2.3.1 ELISA检测结果 与Control组相比,HFD组大鼠小肠FGF19显著下降(P<0.05)、肝脏BA显著升高(P<0.05)。与HFD组相比,各用药组的小肠中FGF19显著升高(P值均<0.05),肝脏BA显著下降(P<0.05)。HFD组大鼠与Control组相比肝脏FGF19有下降趋势,各用药组与HFD组相比肝脏FGF19有升高趋势,其中Simvastatin组呈现显著升高(P<0.05)(表3)。

表3 大鼠肝脏、小肠中FGF19和肝脏中BA水平比较
2.3.2 qRT-PCR检测结果 与Control组相比,HFD组大鼠FXR mRNA显著下降(P<0.05),CYP7A1 mRNA显著升高(P<0.05)。与HFD组相比,QH组FXR mRNA显著升高(P<0.05),QL组显著降低(P<0.05),QH组CYP7A1 mRNA显著下降(P<0.05)(表4)。

表4 大鼠小肠FXR mRNA、肝脏CYP7A1 mRNA相对表达量比较
2.3.3 免疫组化检测结果 与Control组相比,HFD组大鼠FXR阳性率显著下降(P<0.05),CYP7A1阳性率显著上升(P<0.05)。与HFD组相比,Simvastatin组、QH组FXR阳性率显著升高(P值均<0.05),Simvastatin组、QH组、QL组CYP7A1阳性率显著下降(P值均<0.05)(表5、图2)。

表5 小肠FXR、肝脏CYP7A1阳性率
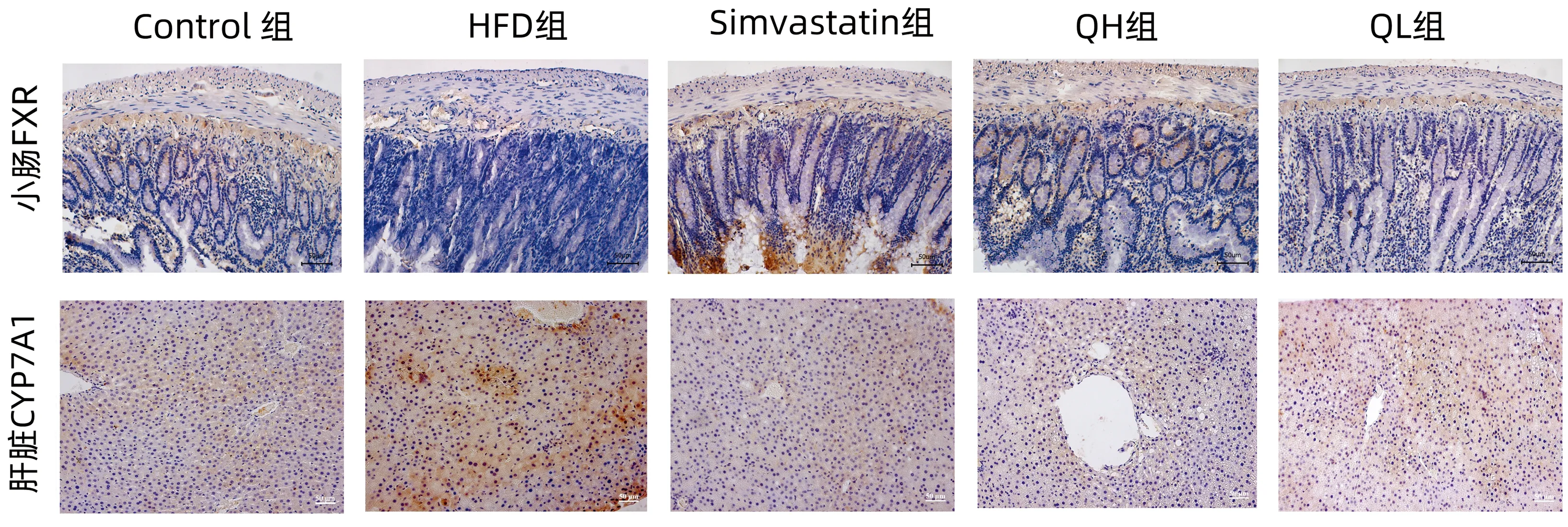
图2 大鼠免疫组化切片(×400)
3 讨论
脂质在肝脏中过度沉积,是NASH的主要成因之一,在NASH状态下机体常出现异常升高的BA[3],BA进一步促进肠道对脂质的摄取,加速脂肪在肝脏的堆积。FXR-FGF19通路抑制BA合成不仅能减少机体对脂质的吸收,也能减少过度产生的BA对肝脏的刺激,减轻炎症反应[7-8]。
在正常状态下,BA的合成与负反馈调控共同维持其稳态,但在NASH的病理状态下FXR-FGF19通路受到抑制,无法正常发挥BA的调节功能[9-11]。本实验中,NASH模型大鼠出现了显著的BA合成量增加(P<0.05),可能与病理状态下FXR-FGF19通路抑制有关。去脂软肝方干预后,FXR-FGF19通路重新激活,小肠FXR、肝脏FGF19上升,肝脏BA得到了显著的抑制(P<0.05),且肝组织病理切片的脂质沉积有所改善,提示去脂软肝方可能具有调节FXR-FGF19通路的功能,并可能通过该途径减少脂质吸收,改善NASH脂质沉积。
去脂软肝方由云南省肝病专家、荣誉名中医苏涟教授拟方,临床疗效较好,课题组研究发现,去脂软肝方能改善高脂诱导脂肪肝大鼠血脂、肝脂及肝组织脂肪变性[12],以及血液流变学相关指标[13],减少肝组织血管性血友病因子(vWF)分泌,抑制血小板聚集[14],并通过调节Oatp2b1等有机离子转运肽在不同器官的表达来改善NAFLD病变程度[15],且对NLRP3炎症小体合成有抑制作用[16]。现代研究表明,方中白术[17]、山楂[18]、菊花[19]皆有保肝作用;青皮含有右旋柠檬烯,橙皮苷等有效成分,具有抗休克、抑制胃肠平滑肌收缩等作用[20];三七中含有丰富的皂苷类、黄酮类等化学成分,具有预防心脑血管系统疾病、抗肿瘤、调节新陈代谢和生理功能、保护机体肝肾功能等作用[21]。
本研究采用高脂饮食建立NASH模型,发现去脂软肝方对FXR-FGF19通路有激活作用,这可能是该方发挥降脂作用的机制之一。 FXR在肠、肝、肾均有分布,通路复杂,且与糖脂代谢密切相关,本研究只初步探索了去脂软肝方对FXR-FGF19通路的影响,而该方对其他FXR相关通路的影响还有待研究。
伦理学声明:本研究方案于2020年6月1日经由云南中医药大学实验动物伦理委员会审批,批号:R-06202016,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:夏恩蕊负责课题设计,资料分析,撰写论文;夏恩蕊、张素妍、田格格参与动物造模及实验,修改论文;张顺贞负责实验设计拟定写作思路,指导撰写文章并最后定稿。
