人工肝治疗HBV相关慢加急性肝衰竭的血小板计数变化及其影响因素
2022-05-14许文雄李学俊陈苑莉
王 璐, 许文雄, 朱 姝, 李学俊, 陈苑莉, 谢 婵, 彭 亮
中山大学附属第三医院 感染科, 广州 510635
慢加急性肝衰竭(ACLF)是临床常见的危重症,其病情进展迅速,短期病死率高,严重危害着国民健康[1-2]。HBV是我国ACLF的最主要病因[3]。人工肝支持系统(artificial liver assistant system, ALSS)作为治疗肝衰竭的有效方法之一,其通过体外的机械、理化和生物装置,清除有害物质,补充有益成分,稳定机体内环境[4-5]。研究[6-7]发现ACLF患者接受ALSS治疗后PLT计数有不同程度的下降,这与血浆分离器的生物相容性差和抗凝剂肝素对PLT作用有关。但不同人工肝术式、治疗次数等因素对PLT计数的影响尚不清楚。其次,有研究[8]报道PLT水平是影响肝衰竭患者人工肝治疗疗效和短期预后的重要因素。由于肝衰竭患者本身凝血因子缺乏,人工肝治疗对PLT的破坏会在一定程度上加剧出血的风险。因此准确评估启动人工肝治疗的PLT界值对于提高治疗的安全性及有效性至关重要。目前有关于人工肝治疗乙型肝炎相关慢加急性肝衰竭(HBV-ACLF)对PLT影响的研究报道尚缺乏,为此本文将重点阐述HBV-ACLF患者接受人工肝治疗后PLT的变化趋势,探讨其影响因素及启动人工肝治疗的最佳PLT界值,以期为临床医生开展人工肝治疗提供更优化的治疗决策。
1 资料与方法
1.1 研究对象 选取2018年1月—2021年11月在中山大学附属第三医院住院接受人工肝治疗的HBV-ACLF患者152例,其中血浆置换(plasma exchange, PE)组102例,双重血浆分子吸附系统(double plasma molecular absorb system, DPMAS)联合低剂量PE (low-volume plasma exchange, LPE) 组50例。入组标准:(1) 合并慢性乙型肝炎,ACLF诊断符合中国重型乙型肝炎小组(Chinese group on the study of severe hepatitis B, COSSH)-ACLF诊断标准[9];(2)年龄在18~65岁;(3) 人工肝治疗次数3~5次;(4) 住院超过1天;(5) 临床资料完整。排除标准:(1) 其他原因引起的肝脏疾病,例如甲型肝炎、丙型肝炎、戊型肝炎、自身免疫性肝病、遗传代谢性肝病等;(2) 合并肝脏肿瘤以及其他器官肿瘤;(3) 合并HIV或其他免疫缺陷性疾病;(4) 合并其他严重并发症(如严重感染、活动性出血、弥漫性血管内凝血)的患者;(5) 合并严重的肝外脏器功能障碍,例如慢性肾病、肾衰竭、糖尿病合并严重并发症、冠心病心功能三级等。
1.2 诊断标准 慢性乙型肝炎诊断符合中华医学会制定的《慢性乙型肝炎防治指南(2015年更新版)》[10],ACLF诊断符合COSSH-ACLF诊断标准[9],根据患者病情严重程度分为以下3级:ACLF 1级,单一肾衰竭;单一肝衰竭(TBil≥12 mg/dL)合并INR≥1.5或肾功能障碍(血肌酐1.5~1.9 mg/dL)或肝性脑病Ⅰ~Ⅱ期单一器官衰竭(凝血、循环、呼吸)合并肾功能障碍或肝性脑病Ⅰ~Ⅱ期;单一脑衰竭合并肾功能障碍;ACLF 2级,包含两个器官衰竭;ACLF 3级,包含3个及以上器官衰竭。各器官衰竭定义如下:肝衰竭即血清TBil≥12 mg/dL,肾衰竭即血肌酐≥2 mg/dL,凝血衰竭即INR≥2.5或PLT≤20×109/L,脑衰竭即存在肝性脑病Ⅲ~Ⅳ期,循环衰竭即使用多巴胺、多巴酚丁胺等血管活性药物,呼吸衰竭即动脉血氧分压/吸入氧分数(PaO2/FiO2)≤200或血氧饱和度/吸入氧分数(SpO2/FiO2)≤200。
1.3 治疗方法 入院后均给予内科综合治疗:卧床休息,补充能量和维生素,维持水、电解质平衡;对于HBV DNA阳性患者,给予核苷(酸)类似物抗病毒治疗(恩替卡韦或替诺福韦或丙酚替诺福韦);输注新鲜冰冻血浆、人血白蛋白对症治疗,及防治感染、肝性脑病、上消化道出血等并发症的治疗。
单纯PE治疗采用日本旭化成IQ-21血液净化装置,血浆分离器为意大利贝而克公司的 MICROPLAS MPS07, 血浆置换量为2000 mL/次,置换血流速度为80~120 mL/min,血浆分离速度为25~30 mL/min,置换时间为2~3 h。DPMAS联合LPE治疗,血浆分离器同PE治疗, 吸附柱为珠海健帆公司BS330胆红素吸附柱和HA330-II中性大孔树脂吸附柱,DPMAS每分钟血浆处理量为25~30 mL,每次血浆处理总量为5000~6000 mL;每次血浆总置换量为1000 mL。置换前常规使用葡糖糖酸钙注射液抗过敏,DPMAS治疗前根据患者的凝血酶原活动度和PLT水平给予普通肝素抗凝,单纯PE治疗采用无肝素化治疗。治疗过程中严密监测患者生命体征,同时观察有无皮疹、呼吸困难及神志改变等病情变化,每次治疗完毕继续心电监护2~3 h,密切观察置管处有无渗血。根据患者病情决定治疗的频率和次数,一般治疗间隔时间为1~3 d,每例患者次数为3~5次。
1.4 观察指标 (1) 人口学资料:年龄、性别;(2) 并发症:肝性脑病、肝肾综合征等;(3) 实验室指标: TBil、总胆汁酸(TBA)、ALT、AST、Alb、尿素氮(BUN)、血肌酐(Cr)、凝血酶原时间(PT)、INR、血清钠(Na)、血清钾(K)、WBC、中性粒细胞(NEU)、PLT;(4) 影像学检查:肝胆胰腺彩色多普勒检查;(5) 肝脏疾病严重程度评分:终末期肝病模型(MELD)评分[11]和COSSH-ACLF Ⅱ 评分[12],公式如下,MELD评分=3.78×ln[TBil (mg/dL)]+11.2×ln(INR)+9.57×ln[Cr(mg/dL)]+6.43;COSSH-ACLF Ⅱ评分=1.649×ln(INR)+0.457×肝性脑病评分+0.425×ln(NEU)+0.396×ln(TBil)+0.576×ln(BUN)+0.033×年龄。

2 结果
2.1 临床基本资料分析 本研究共纳入152例接受人工肝治疗的HBV-ACLF患者,以中年男性为主,ACLF-1级患者占比较高(61.8%), 合并肝性脑病占比较低(9.2%), 46.1%的患者合并肝硬化。其中102例(67.1%)患者行PE治疗, 50例(32.1%)患者行DPMAS联合LPE治疗,共进行509次人工肝治疗,有114例患者接受3次人工肝治疗,占比约75.0%。基线PLT>50×109/L患者占比为88.8%;MELD评分和COSSH-ACLF Ⅱ 评分分别为25.0±4.7、7.0±0.8 (表1)。
2.2 人工肝治疗前后PLT计数变化趋势 总体HBV-ACLF患者在人工肝治疗后PLT计数较基线显著下降(79.5±47.7 vs 112.5±64.1,t=4.965,P<0.001), 治疗结束后1周PLT计数升高至基线水平(97.2±50.7 vs 112.5±64.1,t=1.787,P=0.075)。进一步对患者是否合并肝硬化、人工肝术式和治疗次数进行亚组分析,发现肝硬化组和非肝硬化组患者治疗后PLT计数均较基线显著下降(86.1±44.3 vs 61.2±44.5,t=2.716,P=0.007; 126.5±77.0 vs 89.3±49.7,t=3.676,P<0.001), 治疗后1周两组患者PLT基本升高至基线水平(图1)。患者接受PE或DPMAS联合LPE治疗后PLT计数变化较基线显著下降(106.8±69.4 vs 75.3±45.2,t=3.704,P<0.001; 122.1±52.2 vs 87.5±51.8,t=3.423,P=0.001), 治疗后1周两组患者PLT基本升高至基线水平(图2)。最后,对不同人工肝治疗次数进行比较,发现治疗次数为3、4、5时,三组患者治疗后PLT计数较基线均显著下降(115.7±69.1 vs 78.5±46.1,t=4.691,P<0.001;103.4±40.6 vs 74.0±34.6,t=2.648,P=0.011;101.0± 50.3 vs 62.8±33.2,t=2.195,P<0.001),治疗后1周PLT可升至基线水平(图3)。

图1 肝硬化和非硬化患者接受人工肝治疗PLT变化趋势

图2 PE或DPMAS+LPE治疗后PLT变化趋势
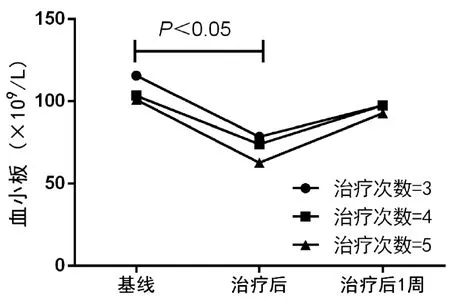
图3 不同人工肝治疗次数PLT变化趋势
2.3 人工肝治疗后PLT计数较基线下降幅度比较 肝硬化组和非肝硬化组患者人工肝治疗后PLT较基线的下降幅度(ΔPLT)基本相当, 治疗后1周肝硬化组较基线下降幅度[ΔPLT(1周)]显著高于非肝硬化组(U=1986.5,P=0.026)。PE组的ΔPLT、ΔPLT(1周)与DPMAS+LPE组比较差异均无统计学意义(P值均>0.05)。ΔPLT在不同人工肝治疗次数之间无明显差异(P>0.05);ΔPLT(1周)随治疗次数增加逐渐升高,差异无统计学意义(P>0.05) (表2)。

表2 人工肝治疗后PLT较基线变化量的比较
2.4 不同PLT水平的短期死亡或肝移植率比较 根据PLT计数分为PLT>50×109/L组和PLT≤50×109/L组。基线PLT≤50×109/L组患者28、90 d死亡或肝移植率显著高于基线 PLT>50×109/L组患者的(χ2值分别为12.112、13.076,P值分别为0.001、P<0.001); 治疗后 PLT≤50×109/L组患者的28、90 d死亡或肝移植率显著高于治疗后 PLT>50×109/L组患者的(χ2值分别为7.848、9.054,P值分别为0.005、0.003);治疗后1周PLT≤50×109/L和PLT>50×109/L两组患者的28、90 d死亡或肝移植率无显著差异(P值均>0.05)(表3)。
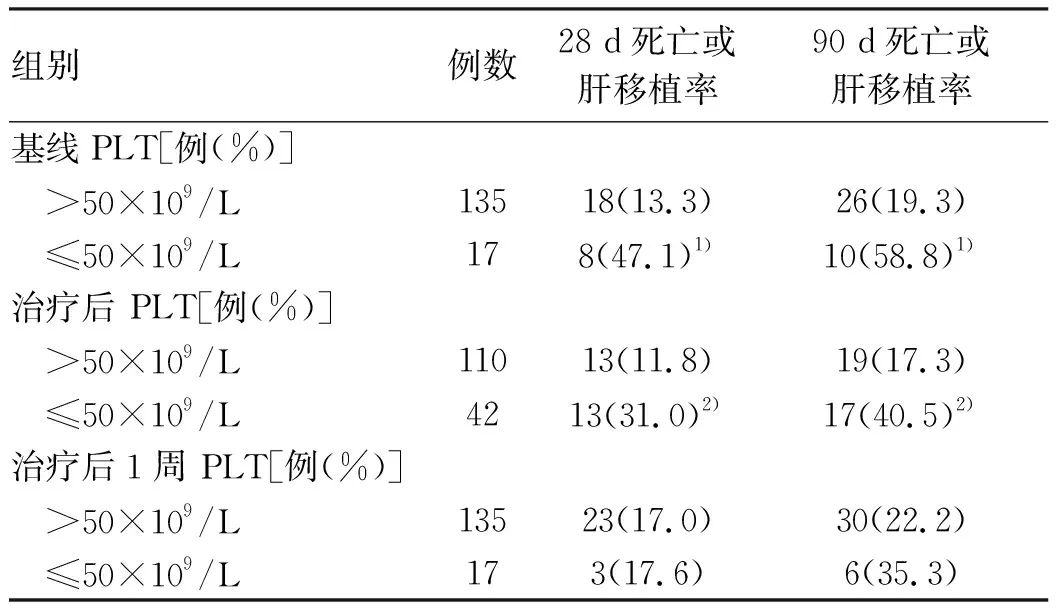
表3 不同PLT水平的短期死亡率或肝移植率比较
2.5 影响人工肝治疗后PLT>50×109/L的危险因素
对所有观察指标进行logistic单因素回归分析,结果显示年龄、ACLF分级、肝硬化、INR、WBC和基线 PLT>50×109/L是影响人工肝治疗后PLT>50×109/L的危险因素(P值均<0.05);采用step-wise对危险因素进行logistic多因素回归分析,结果显示肝硬化和基线PLT>50×109/L是影响治疗后PLT>50×109/L的独立危险因素(P值均<0.05)(表4)。

表4 影响人工肝治疗后PLT>50×109/L的危险因素分析
2.6 基线PLT计数对人工肝治疗后PLT>50×109/L的预测价值分析 对基线PLT计数进行ROC曲线分析,发现基线PLT>80.5×109/L是影响治疗后PLT>50×109/L的最佳截断值,其曲线下面积为0.818(95%CI: 0.738~0.898),敏感度为81.9%, 特异度为71.1%, 约登指数为0.53(图4)。

图4 基线PLT计数评估人工肝治疗后PLT>50×109/L的ROC曲线分析
3 讨论
ALSS作为治疗肝衰竭的有效方法,在临床得到广泛开展。但研究发现人工肝治疗对肝衰竭患者的血细胞有一定影响,尤其是对PLT的破坏。本研究发现HBV-ACLF患者在接受人工肝治疗后,PLT计数较基线发生显著下降,与既往研究结果一致[6,13]。血浆分离器的组织相容性差和肝素是引起人工肝治疗后PLT减少的主要原因[14]。肝素对PLT的影响分为非免疫性肝素相关性PLT减少症和肝素诱导的PLT减少症;目前临床常见的是非免疫性肝素相关性PLT减少症,是肝素与PLT直接作用后引起PLT形态和数量的改变[15]。Yuan等[16]证实肝衰竭患者接受普通肝素抗凝的人工肝治疗后PLT下降幅度显著高于无肝素抗凝的人工肝治疗。但除血浆分离器和肝素以外的其他因素对PLT影响的相关报道尚缺乏。因此,本研究一步探究了是否合并肝硬化、不同人工肝术式和治疗次数(3~5次)对PLT的影响,结果显示上述3个因素对治疗后PLT的下降幅度无显著影响。
本研究发现HBV-ACLF患者的PLT计数在人工肝治疗后1周可以升高至基线水平,说明人工肝治疗对PLT数量的影响是暂时性的,并未抑制患者的骨髓造血功能。PLT的生成和破坏的机制是目前慢性肝病患者PLT减少的主流学说[17]。PLT由骨髓造血组织中的巨核细胞产生,其生成受血液中的PLT生成素(thrombopoietin,TPO)调节[18]。TPO主要由肝实质细胞以恒定的速率产生,是巨核细胞增殖、分化、成熟和PLT生成的主要调控因子[19]。当肝细胞受到损害时,外周血TPO浓度随之降低[20]。因此,肝硬化患者的PLT生成的能力明显弱于非肝硬化患者。本文结果显示在人工肝治疗结束后1周,有肝硬化基础的患者的PLT计数下降幅度显著高于非肝硬化患者,与既往研究结果相符。临床医生应重视肝硬化患者接受人工肝治疗后PLT的变化情况,必要时予以对症治疗提高PLT计数,以降低患者出血风险。
肝衰竭患者体内凝血因子合成减少,当PLT数量严重降低时会急剧增加患者出血的风险。2020年美国胃肠病学院指南[21]推荐,与PLT<50 000/μL的肝硬化患者相比,PLT>50 000/μL可以降低患者的出血风险。研究[22]显示,PLT>50×109/L是肝衰竭患者进行有创操作治疗和降低患者发生出血风险的安全界值。其次,有文献[23]报道,PLT的下降幅度是肝衰竭患者临床结局的独立预测指标之一,而提高PLT数量可以促进肝细胞再生,为肝功能恢复创造条件[24]。本研究发现基线和治疗后PLT>50×109/L组患者的临床预后明显优于基线和治疗后PLT≤50×109/L的患者。因此,为降低肝衰竭患者人工肝治疗后的出血风险及改善临床预后,应充分保证患者治疗后PLT>50×109/L。通过ROC曲线分析,基线PLT>80.5×109/L是治疗后PLT>50×109/L的最佳截断值。因此,笔者认为,与基线PLT>50×109/L相比,基线PLT>80.5×109/L是启动人工肝治疗更加安全的界值,同时有助于提高治疗的有效性。
综上,本研究证实人工肝治疗对HBV-ACLF患者PLT的影响是暂时性的,人工肝治疗结束后1周PLT可升高至基线水平。人工肝治疗后PLT计数下降幅度与是否合并肝硬化、人工肝治疗术式和治疗次数无关,但肝硬化患者的PLT生长能力弱于非肝硬化患者。基线PLT>80.5×109/L是降低人工肝治疗后出血风险的最佳界值。本研究是回顾性研究,存在自身局限性,未来需要开展多中心、大样本的前瞻性研究进一步证实人工肝治疗对于PLT计数的影响,以期为临床医生提供更优化的治疗策略。
伦理学声明:本研究方案于2020年9月29日经由中山大学附属第三医院伦理委员会审批,批号:[2020]-02-173-01。所有患者均知情同意。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王璐、许文雄负责课题设计,资料分析,撰写论文;朱姝、李学俊、陈苑莉、谢婵参与收集数据,修改论文;彭亮负责拟定写作思路,指导撰写文章并最后定稿。
