缺氧诱导人卵巢癌OVCAR3细胞亲环素A表达水平变化及其临床意义
2022-05-14严京哲梁衍涛
严京哲,梁衍涛,袁 勇,周 莉
吉林省肿瘤医院1.腹部肿瘤二科;2.骨及软组织肿瘤外科;3.妇瘤二科,吉林 长春 130021
卵巢癌是常见的妇科恶性肿瘤,早期多无明显症状,大部分患者发现时已处于晚期。卵巢上皮性癌5年生存率低,预后不理想[1]。实质性肿瘤存在缺氧微环境,缺氧状态会促进肿瘤进展[2-3]。缺氧能够通过上调缺氧诱导因子-1α表达,激活其下游蛋白转录[4-5],抑制缺氧诱导的下游蛋白转录可能会成为治疗肿瘤的热点。亲环素是高度保守的多蛋白家族,亲环素A(Cyclophilin A,CypA)具有肽基脯氨酰基顺反异构酶活性[6-7]。有研究报道,缺氧环境可诱导肿瘤细胞CypA表达升高[8],而CypA与肿瘤发生、发展、转移及耐药等均具有一定相关性[9-13]。本研究旨在探讨缺氧诱导人卵巢癌OVCAR3细胞CypA表达水平的变化及其临床意义。现报道如下。
1 材料与方法
1.1 细胞来源及培养 人卵巢浆液腺癌OVCAR3细胞购于上海普林斯顿生物科技发展有限公司。在OVCAR3细胞中加入DMEM培养液(高糖型,含10%无菌小牛血清)中,将其置于5%CO2、37℃孵箱内培养。缺氧环境条件设置:将对数生长期的人卵巢癌OVCAR3细胞置于Bactron厌氧室,37℃、1%O2、5%CO2环境下培养0、3、6、12、24 h。
1.2 CypA mRNA测定 采用RT-PCR法测定CypA mRNA,提取细胞总RNA,转录为cDNA,以PCR扩增。CypA引物序列:上游5′-GCAAGCTTACCATGGTCAACCCCACC-3′,下游5′-GCGGATCCGAGTTGTCCACAGTCGGA-3′。内参照选择GAPDH。以1%琼脂糖凝胶电泳观察PCR产物,采用凝胶图像分析系统(Bio-Rad 4.6.2版)分析结果。采用2-△△Ct法计算CypA相对表达量。
1.3 小干扰RNA应用 以CypA基因为靶点的CypA-siRNA(CypA-siRNA组)和control-siRNA(control-siRNA组)均由Eurogene Tech公司合成[CypA-siRNA(sense,5′-UGACUUCACACGCCAUAAUdTdT-3′;antisense,5′-AUUAUGGCGUGUGAAGUCAdTdT-3′);control-siRNA(universal negative control)]。
1.4 转染 胰酶消化对数生长期的人卵巢癌OVCAR3细胞,接种于DMEM培养基的12孔板中,每孔2×104个细胞,置于37℃、5%CO2孵箱中。培养24 h,待汇合率达70%后,以GenePORTER Transfection Reagent将CypA-siRNA和control-siRNA转染,转染后置于缺氧环境(37℃、1%O2、5%CO2)培养48 h。同时,设置对照组,细胞缺氧环境培养48 h,不转染。采用Western Blot法观察RNA干扰情况。
1.5 Western Blot法检测OVCAR3细胞CypA蛋白表达 收集细胞后,用预冷PBS溶液进行洗涤,加入细胞裂解液,提取总蛋白。蛋白样品用10% SDS-PAGE分离等量后,将其转移至PVDF膜上,1.5%牛血清蛋白(BSA)封闭后4℃过夜,加一抗(1∶800)后室温孵育2 h,再将二抗(1∶2 000)室温孵育1 h。ECL显色,系统定量采用Bio-Rad凝胶分析对蛋白表达灰度值进行计算。
1.6 MTT比色法测定细胞增殖 在转染后置于缺氧环境培养48 h的OVCAR3细胞12孔板的每孔中加入MTT培养液1 ml,培养1 h。再在每孔中加入150 μl DMSO,振荡sd10 min,595 nm波长下采用Bio-Rad酶联免疫检测仪测定吸光度,取3孔平均值。

2 结果
2.1 缺氧环境下培养OVCAR3细胞各时间点CypA mRNA表达水平比较 缺氧环境下培养OVCAR3细胞3 h后CypA mRNA表达开始上调,24 h表达水平最高,培养3、6、12、24 h时的CypA mRNA表达水平均高于培养0 h时(P<0.05)。见图1。
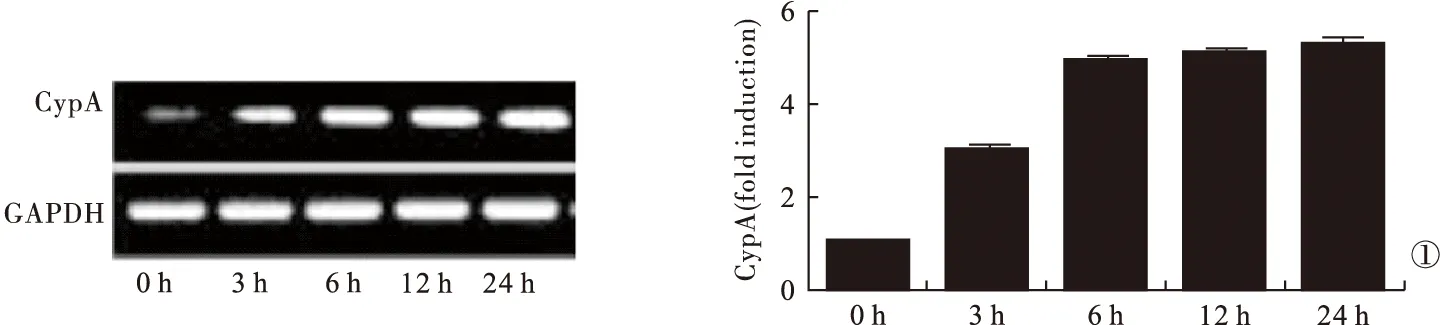
图1 缺氧环境下培养OVCAR3细胞各时间点CypA mRNA表达水平比较
2.2 缺氧环境下培养OVCAR3细胞各时间点CypA蛋白表达水平比较 缺氧环境下培养OVCAR3细胞3 h后CypA蛋白表达开始上调,24 h表达水平最高,培养3、6、12、24 h时的CypA蛋白表达水平均高于培养0 h时(P<0.05)。见图2。
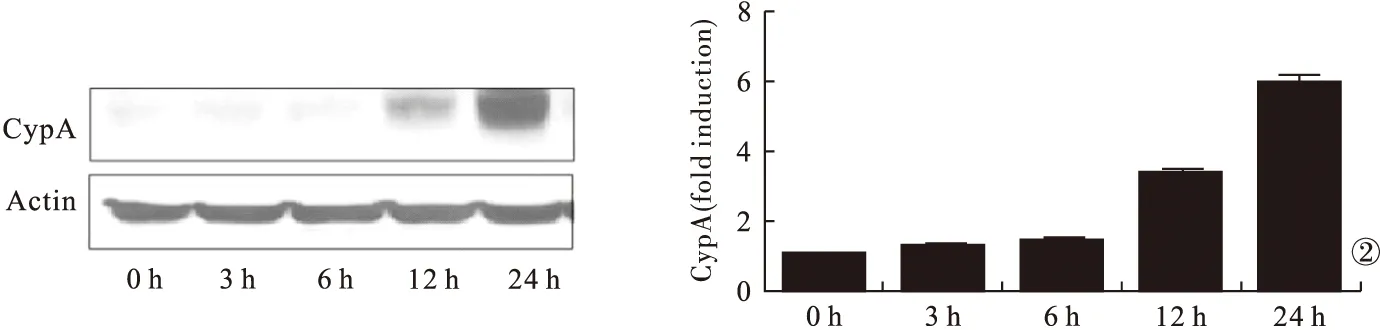
图2 缺氧环境下培养OVCAR3细胞各时间点CypA蛋白表达水平比较
2.3 CypA-siRNA和control-siRNA对OVCAR3细胞增殖和CypA蛋白表达影响 与对照组比较:control-siRNA组CypA蛋白表达无明显变化(P>0.05),CypA-siRNA组CypA蛋白未表达(P<0.05);control-siRNA组OVCAR3细胞增殖无明显变化(P>0.05),CypA-siRNA组OVCAR3细胞增殖明显降低(P<0.05)。见图3~4。
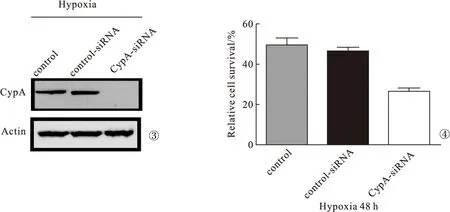
图3 CypA-siRNA和control-siRNA对OVCAR3细胞CypA蛋白表达影响 图4 CypA-siRNA和control-siRNA对OVCAR3细胞增殖影响
3 讨论
缺氧是中晚期实体肿瘤的普遍特征,缺氧状态有利于肿瘤进展。缺氧诱导因子-1α是一种低氧诱导因子,能够促进糖降解和血管生成等,且可被低氧诱导[14]。缺氧反应元件是主要位于DNA序列目的基因的一种核苷酸序列,缺氧诱导因子-1α能够与其特异性结合,在缺氧状态下促进目的基因转录。多项研究显示,人类癌细胞在缺氧环境下能够上调缺氧诱导因子-1α表达[4-5],缺氧诱导因子-1α表达上调能够在转录水平提高CypA mRNA表达,进而提高CypA蛋白表达,CypA蛋白表达越高,活性氧生成能力越低,活性氧对肿瘤的杀伤作用越弱。CypA在胰腺癌细胞[9]、肺癌[10-11]、大肠癌[13]等多种肿瘤细胞中均高表达,CypA蛋白与上述肿瘤细胞的发生、发展密切相关。本课题组既往研究发现,胰腺癌组织中CypA蛋白的表达在胰腺癌的生长、侵润、转移中发挥重要作用[15-16]。
本研究结果显示:缺氧环境下培养3、6、12、24 h时的CypA mRNA和CypA蛋白表达水平均高于培养0 h时(P<0.05);与对照组比较,control-siRNA组OVCAR3细胞增殖和CypA蛋白表达无明显变化(P>0.05),CypA-siRNA组OVCAR3细胞增殖明显降低(P<0.05)且CypA蛋白未表达(P<0.05)。即缺氧环境能够快速上调OVCAR3细胞的CypA mRNA和CypA蛋白表达水平,抑制CypA mRNA表达可降低OVCAR3细胞对抗缺氧等不利环境的应急能力。
综上所述,CypA在人卵巢癌组织中的高表达与卵巢癌的发生、发展存在一定关联,其对于揭示卵巢癌发病机制、开发药物靶标等具有重要意义。
