诱导性低温复苏对失血性休克大鼠肺PGC-1表达影响
2022-05-14高广荣王鑫宇吕晨光石三保段福孝
高广荣,王鑫宇,吕晨光,石三保,段福孝,张 成
北部战区总医院 普通外科,辽宁 沈阳 110016
创伤是中青年人群死亡的主要原因之一,全球每年约580多万人死于创伤。其中,创伤失血性休克占创伤早期死亡的30%~40%。目前,虽然医学救治水平不断进步,但是创伤失血性休克致死率仍保持在相对较高的水平[1-2]。动物实验研究发现,诱导性低温复苏可明显改善失血性休克的预后[3]。进一步研究证实,诱导性低温复苏可通过降低机体代谢率、增加能量储备等方式减少能量耗损,进而提高复苏效率[4]。PGC-1是参与能量代谢调控的重要基因[5]。目前,失血性休克诱导性低温复苏对PGC-1有何影响尚不明确。本研究旨在探讨诱导性低温复苏对失血性休克大鼠肺PGC-1表达的影响。现报道如下。
1 材料与方法
1.1 实验材料 清洁级成年雄性Wistar大鼠18只(体质量280~310 g),由北部战区总医院动物实验室提供。Datex-Ohmeda S/5多功能监护仪(芬兰德恩公司),压力传感器(新加坡 Biosensors International PET.Ltd),PCR扩增仪(德国Biometra),高速离心机(美国Sigma公司),微量输液泵(浙大医学器械有限公司WZ-50cz)。RNA固定液(北京天恩泽基因科技有限公司);实时荧光定量聚合酶链式反应试剂盒(大连宝生物工程大连有限公司)。PGC-1引物合成(大连宝生物工程大连有限公司)。PGC-1(sc-13067)抗体(SANTA CRUZ公司)。
1.2 动物分组及模型制备 将大鼠随机分为A组(对照)、B组(37℃~38℃常温复苏)及C组(33℃~34℃低温复苏)3组,每组各6只。A组仅行外科插管操作。B组、C组建立失血性休克模型后分别在预定温度下进行复苏。按照标准建立压力控制失血性休克模型。戊巴比妥钠(60 mg/kg)腹腔内注射麻醉,麻醉成功后进行气管内插管和小动物呼吸机辅助呼吸,潮气量设定为7~8 ml/kg,呼吸频率设定为80次/min,吸入氧浓度为40%。进行双侧股动脉及右侧股静脉插管(PE-50)。右侧股动脉用于监测血压,左侧股动脉用于放血,右侧股静脉用于复苏。所有外科操作均在无菌条件下进行。外科操作结束后经过15 min稳定期,记录基础平均动脉压(mean arterial pressure,MAP)。建立模型时,通过左侧股动脉插管在10 min内抽血使MAP降至40 mmHg(1 mmHg=0.133 kPa)。抽出的血液储存在肝素化(7.5 U/ml)的无菌注射器内,置于4℃冰箱中,待复苏时回输至大鼠体内。在休克观察的90 min内通过继续抽血或少量回输抽出的血液维持大鼠MAP在40~45 mmHg。休克90 min结束后,将抽出的血液及等体积生理盐水在10 min内通过右侧股静脉用微量输液泵回输至大鼠体内,连续观察180 min。各组大鼠在外科操作结束后持续测量直肠温度,若直肠温度<37℃即开始用红外线灯照射大鼠腹部,A组和B组在实验观察期间通过间断照射红外线灯维持大鼠直肠温度在37℃~38℃,直至实验结束。C组在复苏期间通过在大鼠腹部涂抹乙醇及吹冷风的方法在5 min内将大鼠直肠温度降至33℃~34℃,在复苏观察的180 min内持续监测直肠温度,若直肠温度>34℃将继续涂抹乙醇及吹冷风以维持直肠温度在33℃~34℃,直至实验结束。
1.3 标本留取 在失血性休克复苏180 min后处死大鼠,留取大鼠双肺下叶组织标本各4块,重1 g,置于-80℃低温冰箱待测。
1.4 实时荧光定量聚合酶链式反应 RNA提取:TRIzol一步法提取RNA。反转录:采用大连宝生物工程大连有限公司试剂盒合成cDNA,反应条件:37℃、15.0 min;85℃、5 sed。PCR扩增,PGC-1引物序列:上游5′-CAGCCCTCTTCATCTCCAAG-3′,下游5′-TCGTGCAGGTCATCAAGAAG-3′;actin引物序列:上游5′-TCATCACCATTGGCAATGAG-3′,下游5′-CACTGTGTTGGCGTACAGGT-3′。PCR反应按下列条件循环:95℃、0.5 min,预变性,然后95℃、30 s,60℃、34 s,进行40个循环后,60℃、1 min延伸。根据标准曲线,荧光定量PCR仪自动分析并计算结果,按2-△△CT法计算mRNA的相对表达水平。
1.5 蛋白免疫印迹法 采用蛋白免疫印迹法检测PGC-1蛋白表达。肺组织加入5倍体积预冷的细胞裂解液,冰浴下匀浆,再用冰水浴超声粉碎。4℃、12 000 r/min离心1 h取上清液,考马斯亮蓝法进行蛋白定量。SDS-PAGE分离样品(40 μg)后电转移至硝酸纤维膜上,封闭后,加入一抗(PGC-1,1∶500)室温下免疫沉淀1 h,摇洗后加入标记二抗(1∶2 000),室温下作用2 h。ECL浸膜,显影。照片在图像分析仪上进行分析定量,记录相应蛋白条带的平均光强度值,计算PGC-1和actin吸光度值的比值。
1.6 活性氧检测 1 g肺组织匀浆后应用清洁液漂洗,再以300 r/min离心5 min。将组织沉淀依据试剂盒说明书处理后,用荧光分光光度计检测活性氧水平。
1.7 肺三磷酸腺苷检测 将20 mg肺组织用组织裂解液裂解后,以12 000 r/min离心10 min,收集上清液。上清液依据试剂盒说明书处理后,用荧光分光光度计检测三磷酸腺苷(adenosine triphosphate,ATP)水平。

2 结果
2.1 各组肺组织活性氧水平比较 失血性休克复苏180 min,A组肺组织活性氧水平为(101.67±6.50),B组为(320.00±11.87),C组为(208.83±8.84)。B组、C组肺组织活性氧水平高于A组,且B组高于C组,差异有统计学意义(P<0.05)。
2.2 各组肺组织ATP水平比较 失血性休克复苏180 min,A组ATP水平为(20.65±2.02),B组为(4.92±0.32),C组为(15.4±1.0)。B组、C组ATP水平低于A组,且B组低于C组,差异有统计学意义(P<0.05)。
2.3 各组肺组织PGC-1 mRNA表达量比较 A组大鼠肺组织PGC-1 mRNA表达量为(1.47±1.22),B组为(0.07±0.05),C组为(0.28±0.07)。B组、C组PGC-1 mRNA表达量低于A组,且B组低于C组,差异有统计学意义(P<0.05)。
2.4 各组肺组织PGC-1蛋白比较 B组、C组PGC-1蛋白低于A组,且B组低于C组,差异有统计学意义(P<0.05)。见图1。
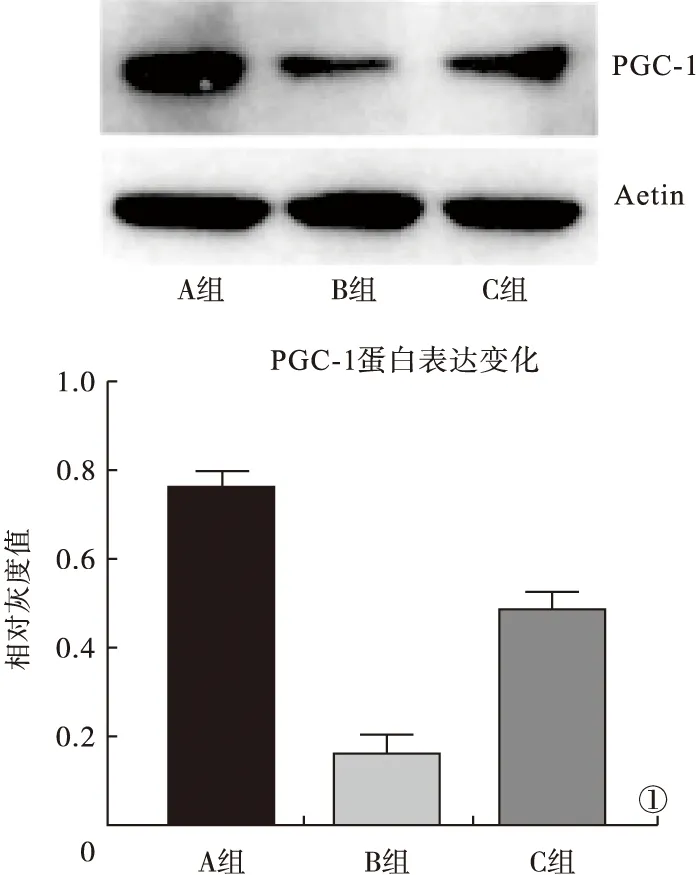
图1 各组大鼠肺组织PGC-1蛋白变化
3 讨论
失血性休克患者易出现自发性低体温,对机体重要脏器功能及内环境平衡产生不利影响,是预后不良的标志[6]。有研究报道,诱导性低温可保护重要脏器功能,提高复苏效率,降低病死率[7]。因此,有计划的治疗性低温或诱导性低温复苏可以对失血性休克的治疗发挥积极作用。
活性氧主要是线粒体有氧呼吸过程中的呼吸链副产物[8]。有研究认为,失血性休克时,机体在多种强烈因素作用下,体内活性氧生成增加,活性氧水平变化可以作为预测失血性休克早期肺损伤的标志物[9]。本研究结果显示,失血性休克常温复苏后大鼠肺组织活性氧水平显著升高,与常温复苏组比较,低温复苏后大鼠肺组织活性氧水平明显下降。短时间内大量积聚的活性氧会对线粒体的能量代谢呼吸链具有显著损伤、破坏及毒性作用,进而导致线粒体肿胀,ATP迅速减少,最终导致细胞死亡[10]。B组大鼠肺组织内ATP水平明显下降,而C组ATP水平明显高于B组(P<0.05),提示失血性休克后采取诱导性低温复苏降低了大鼠肺组织活性氧水平,进而改善了线粒体的功能,提高了大鼠肺组织ATP水平,促进了能量代谢平衡。
PGC-1作为重要的核转录调控因子,可结合多种转录因子,增强靶基因转录效率,广泛参与多种代谢通路的调节活动[11],在适应性产热、线粒体生成、脂肪酸氧化等过程中有着重要作用[12-13]。本研究发现,正常大鼠肺组织内有PGC-1的表达,失血性休克复苏后大鼠肺组织PGC-1 mRNA表达明显降低,PGC-1蛋白水平也相应降低,而C组大鼠肺组织PGC-1 mRNA的表达被明显上调,PGC-1蛋白水平也有所升高,提示失血性休克后的诱导性低温复苏能够上调大鼠肺组织PGC-1基因和蛋白的表达。PGC-1是线粒体生理代谢的重要调控因子,PGC-1的活性增加,能够刺激线粒体的生物合成,进而加速了ATP的生成[14]。也有研究证实,PGC-1可以调节抗氧化酶的活性,减少活性氧的含量,发挥抗氧化作用[15]。
综上所述,诱导性低温复苏失血性休克能够调控PGC-1表达水平,进而调节ATP和活性氧的水平,减轻肺损伤程度,利于休克的救治。但目前尚不清楚诱导性低温调控PGC-1表达的具体机制,仍需进一步的深入研究。
