产前诊断中额外小标记染色体的临床及遗传学分析*
2022-05-13李燕青傅婉玉王元白江矞颖苏景明庄建龙
李燕青,傅婉玉,王元白,江矞颖,苏景明,庄建龙
福建省泉州市妇幼保健院/儿童医院产前诊断中心,福建泉州 362000
额外小标记染色体(sSMC)是指不能通过细胞遗传学常规显带方法辨认的染色体结构畸变,其大小通常等于或小于同一个中期染色体核型中的20号染色体[1]。sSMC的表型效应取决于它的来源、片段大小和常染色质所占比例。由于sSMC本身形态结构异常,无法用传统G显带技术判断其来源,而分子遗传学检测能协助判断sSMC的来源,为临床咨询提供更精准有益的信息。本研究对泉州市妇幼保健院/儿童医院产前诊断中心经产前羊水细胞培养及染色体核型分析检出sSMC的病例进行分析,并对部分病例采用单核苷酸多态性微阵列(SNP-array)检测sSMC的来源,以进一步明确其致病性。
1 资料与方法
1.1一般资料 选取2017年1月至2020年3月于泉州市妇幼保健院/儿童医院产前诊断中心就诊的高危孕妇5 766例。产前诊断纳入指征包括高龄孕妇(≥35周岁)、胎儿超声检查结果异常、有不良孕产史、孕中期血清学产前筛查高风险等。所有孕妇均有详细的病历资料和体格检查资料,并完善术前检查排除穿刺手术禁忌证,同时签署知情同意书。本研究经泉州市妇幼保健院/儿童医院医学伦理委员会批准(伦理审批号:2020No.31)。
1.2细胞培养及染色体核型分析 在超声引导下行羊膜腔穿刺术,抽取20 mL羊水用于羊水细胞培养,培养7~10 d后用胰酶消化法进行细胞收获,通过自动染色体收获系统Sinochrome Chromprep Ⅱ(上海乐晨生物科技有限公司)进行染色体制备,经吉姆萨染液染色后进行核型分析。采集夫妻双方外周血标本于无菌条件下接种至Chromed P细胞培养基中,分两瓶培养68~72 h后分别收获、制片、染色、染色体核型分析。羊水细胞计数30个核型,并分析5个核型。外周血细胞计数20个核型,并分析5个核型。染色体的命名依据人类细胞基因组学国际命名体系(ISCN 2016)标准。
1.3SNP-array检测 采集孕妇10 mL羊水标本及夫妻双方外周血标本各3 mL送至第三方检测公司(北京贝康医学检验所)进行检测,离心收集沉淀,采用DNA提取试剂盒提取羊水/外周血细胞基因组DNA,经稀释消化、扩增、纯化后,形成25 bp的片段。将芯片上的探针与生物素标记后的相应碱基片段进行杂交、洗涤、结合染色后放入Affymetrix公司GeneChip Scanner 3000Dx v.2 with AutoLoaderDx扫描仪进行扫描,采用Chromosome Analysis Suite(ChAS)v4.0软件对荧光信号进行分析。通过数据库查询判读拷贝数变异(CNVs)的致病性。
1.4统计学处理 采用Excel 2010进行数据收集和分析。
2 结 果
2.1羊水染色体核型分析结果 检出sSMC的胎儿共7例,其中嵌合型3例,1例伴有18-三体综合征,见表1。
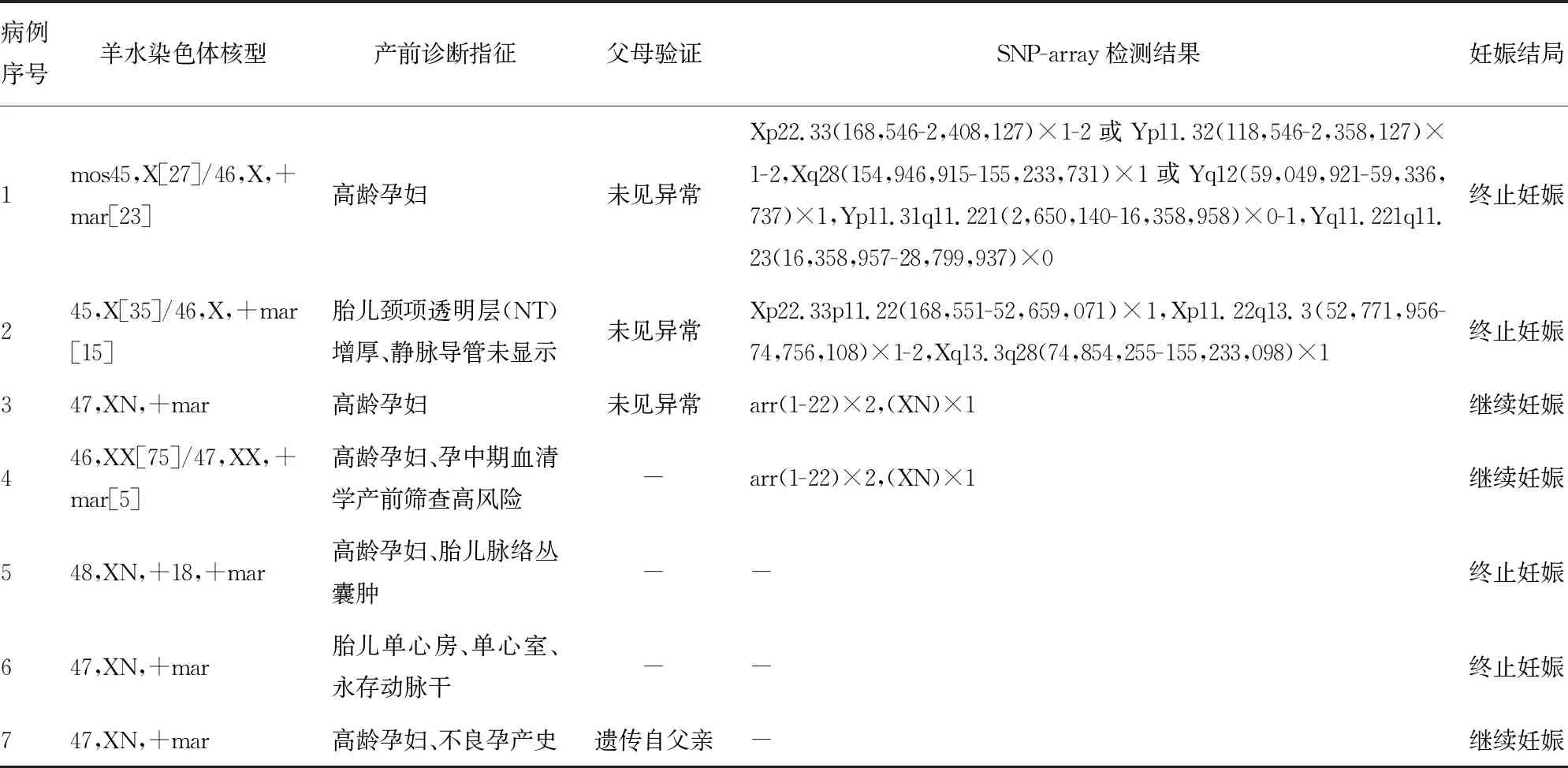
表1 检出sSMC胎儿的羊水染色体核型、SNP-array检测结果、父母验证及妊娠结局
2.2SNP-array检测结果 7例检出sSMC的胎儿中有4例进行了SNP-array检测,其中2例sSMC分别来源于X和Y染色体,2例未检出CNVs。病例1中羊水染色体核型提示mos45,X[27]/46,X,+mar[23],SNP-array检测结果显示为男性胎儿,该胎儿在性染色体Y上的拟常染色体区域存在2处缺失,因此羊水染色体核型更正为mos45,X[27]/46,X,del(Y)(q11.221)[23]。病例2 SNP-array检测结果显示为女性胎儿,X染色体存在3处缺失,羊水染色体核型更正为45,X[35]/46,X,del(X),(Xp11.22q13.3)。病例3和病例4 SNP-array检测结果未见异常,见表1。
2.3妊娠结局及父母验证 病例1及病例2经SNP-array检测提示胎儿性染色体嵌合异常,均为致病性变异,父母验证无异常,显示胎儿携带的sSMC为新发突变。病例1于妊娠26周引产一男性无生机儿,外观未见明显异常;病例2引产一女,外观未见明显异常。病例3及病例4因SNP-array检测未发现异常CNVs,均选择继续妊娠,后期随访胎儿体健。此外,3例未行SNP-array检测的病例中有1例因合并胎儿18-三体综合征选择终止妊娠;1例因合并胎儿复杂型先天性心脏病选择终止妊娠;1例因父母验证提示胎儿sSMC遗传自其表型正常的父亲,孕妇及其家属选择继续妊娠,后期随访显示胎儿出生后未见异常。见表1。
3 讨 论
据报道,约1 000例行染色体核型分析的羊水穿刺标本中就可检出1例存在sSMC的病例[2]。sSMC的遗传效应差异很大,大多数对个体无影响,但也有10%~15%可导致严重智力低下和其他异常表型,明确sSMC来源对临床产前咨询尤其重要[3]。
SNP-array检测有助于明确sSMC来源[4-5]。本研究中2例通过SNP-array检测明确sSMC为性染色体来源的致病性变异,病例1羊水染色体核型为mos45,X[27]/46,X,+mar[23],SNP-array检测结果提示sSMC来源于部分缺失的Y染色体,最终病例1羊水染色体核型更正为mos45,X[27]/46,X,del(Y)(q11.221)[23]。胎儿Y染色体存在涉及无精症因子(AZF)区段及Y染色体性别决定区(SRY)等OMIM基因相关区域的2处缺失,同时胎儿在Xq28或者Yq12区段存在291.8 Kb的缺失,在Xp22.33或Yp11.32区段存在包含SHOX等基因的2.2 Mb的嵌合缺失。SHOX基因的单倍剂量不足会导致身材矮小[6]。位于Y染色体短臂远端的SRY基因在胚胎早期原始性腺组织分化过程中起着关键作用,SRY基因的缺失可能导致性器官发育异常[6]。徐丹萍等[7]总结相关文献报道发现,嵌合型Y染色体长臂大片段缺失的存活个体中,34.8%(8/23)存在身材矮小的情况(原因尚不明确),大部分男性患者存在阴茎结构正常但伴有尿道下裂。病例1存在涉及Y染色体的多处缺失,不仅影响胎儿的性别及生长发育,还会影响其成年后的生育问题,因此孕妇及家属选择终止妊娠。
胎儿NT增厚与染色体异常和部分结构畸形密切相关[8]。病例2因胎儿NT增厚要求进行产前诊断,羊水染色体核型为45,X[35]/46,X,+mar[15],SNP-array检测明确该sSMC为部分缺失的X染色体,羊水染色体核型更正为45,X[35]/46,X,del(X),(Xp11.22q13.3)。在45,X基础上发生的sSMC并不影响Turner综合征表型[9]。研究表明,约32.6%的嵌合型Turner综合征患者中有一些自发的青春期发育表现,但最终继发闭经,其可能与Xq13-q26区域缺失导致卵巢功能相关基因的单倍剂量不足有关,临床表型为卵巢功能障碍、性腺发育障碍、原发闭经等,需要长期激素替代治疗[10-11]。
产前诊断中发现的sSMC是否有表型效应,与sSMC的染色体来源、基因组含量、家族再发性,是否为嵌合型和嵌合度,是否存在单亲二倍体效应等因素有关[12-15]。本研究中病例7因胎儿sSMC遗传自其表型正常的父亲,推测胎儿出现异常表型的风险低,建议孕妇继续妊娠,后期随访显示胎儿出生后健康状况良好。约30%的sSMC遗传自父母,由表型正常的父亲或母亲传递而来的sSMC通常不增加子代异常表型的风险[16],因此首先建议对胎儿的父母进行染色体核型分析,帮助判断胎儿的sSMC来源[9]。
sSMC大部分来源于近端着丝粒染色体[17-18]。本研究中病例3及病例4的SNP-arry检测结果均未发现异常,提示sSMC来源于探针未覆盖的异染色质区,来源于异染色质区的sSMC通常是不致病的[17]。
sSMC形态学的多样性,如何评价其对胎儿的影响,以及是否需要终止妊娠等,是产前遗传咨询面临的重要问题,尽快明确sSMC的来源尤为重要,因此将分子遗传学与细胞遗传学方法相结合对明确sSMC的来源及致病性有重要意义,可为产前遗传咨询及妊娠结局评估提供参考。
