siRNA干扰下调DJ-1的表达对人支气管上皮细胞生物学行为的影响*
2022-05-13魏旺丽崔亚娟刘国栋
魏旺丽,谭 潭,崔亚娟,刘国栋
1.湖南省郴州市第一人民医院检验医学中心,湖南郴州 423000;2.中南大学湘雅二医院血液内科,湖南长沙 410011;3.湖南省郴州市第一人民医院南院急诊科,湖南郴州 423000
DJ-1又称帕金森病相关蛋白7(PARK7),是已知的帕金森病相关蛋白[1],位于染色体1p36.23,相对分子质量为20×103,长度为24 kb,属于肽酶C56蛋白家族成员。DJ-1在很多组织中广泛表达,如肝脏、骨骼肌、肾脏等, DJ-1作为众所知周的致癌因子,在肿瘤的发生和发展中也起着至关重要的作用[2-3]。DJ-1在很多肿瘤中都有过表达现象,如乳腺导管癌、非小细胞肺癌等[4]。DJ-1的功能很多,包括转录调节、抗氧化应激等[5]。DJ-1的抗氧化应激功能可有效保护神经细胞免受氧化应激的损伤,促进神经细胞生长及增殖。DJ-1是已知的肺癌转移相关蛋白[6],为研究DJ-1对细胞生物学行为的影响,本研究选择人支气管上皮细胞(HBE细胞)作为研究对象,探讨低表达DJ-1对HBE细胞增殖、凋亡的影响。
1 材料与方法
1.1材料来源 实验室保存的HBE细胞;DJ-1 siRNA慢病毒载体、Control siRNA慢病毒载体购自上海吉凯基因化学技术有限公司;四甲基偶氮唑盐(MTT)、胎牛血清(FBS)、1640培养基等购自美国赛默飞世尔公司。
1.2方法
1.2.1分组 构建DJ-1基因siRNA慢病毒载体,感染HBE细胞(DJ-1 siRNA组),并设置Control siRNA慢病毒载体对照(Control siRNA组)及空白对照(BC组)。
1.2.2流式细胞术检测各周期细胞 消化收集的细胞,洗涤离心后用70%乙醇重悬细胞,制成1×106/mL的细胞悬液;于4 ℃冰箱中过夜固定后用磷酸盐缓冲液(PBS)洗涤,加入100 μL核糖核酸酶A(RNase A),37 ℃水浴30 min;加入碘化丙啶(PI)染液400 μL,4 ℃避光放置30 min后采用流式细胞仪检测各周期细胞。
1.2.3MTT比色法检测细胞增殖情况 消化收集的细胞,梯度稀释成1×104/mL的细胞悬液,以每孔200 μL接种于96孔培养板,共接种4块板,每组每板接种20孔。此外,A1孔中加入200 μL完全培养基作为空白对照,再在其他15个空白孔中加入200 μL无菌PBS以保证试验结果的稳定性和可靠性。于接种后24、48、72、96 h各选1块培养板进行检测,各实验孔及空白对照孔中加入MTT(5 mg/mL)20 μL,37 ℃培养4 h后去除孔内液体,每孔加入二甲基亚砜(DMSO)各150 μL,于酶标仪上快速振荡60 s充分溶解孔内沉淀后,在570 nm波长处检测各孔吸光度(A)值。
1.2.4克隆形成试验检测细胞克隆情况 消化收集的对数生长期细胞,吹打制成单个细胞悬液,每组分别以每孔200个细胞接种于6孔培养板中。2周后肉眼可见的克隆出现后终止培养,弃上清液后用PBS洗涤2次,加入4%多聚甲醛2 mL放置15 min固定细胞。去固定液,吉姆萨染液染色10~30 min后流水缓慢冲洗,自然干燥。随机选取6个视野,分别计数每个视野下单个细胞形成克隆(细胞数>5个)的数量。
1.2.5Transwell小室试验检测细胞迁移情况 消化收集的对数生长期细胞,调整细胞水平至(0.5~1.0)×106/mL。将500 μL含10%FBS的培养基加入24孔板下室中;侵袭小室内加入细胞悬液300 μL。孵育48 h后去除侵袭小室内未穿过基底层膜的细胞;4%多聚甲醛固定,结晶紫染色20 min;冲洗掉多余的染色液后自然干燥;随机选取不同视野(×100)并计数细胞个数。

2 结 果
2.1DJ-1下调对HBE细胞周期的影响 流式细胞术检测结果显示,DJ-1 siRNA组、Control siRNA组、BC组细胞周期为G1期的细胞分别占65.80%、20.57%和22.44%;S期细胞分别占 16.39%、31.56%和30.35%;G2期细胞分别占17.81%、47.87%和47.21%。与Control siRNA组相比,DJ-1 siRNA组的G1期细胞比例增高45.23%,而S期和G2期细胞比例分别减少15.17%、30.06%。DJ-1 siRNA组G1期细胞比例高于BC组、Control siRNA组,S期、G2期细胞比例低于BC组、Control siRNA组,差异有统计学意义(P<0.05),BC组、Control siRNA组各周期细胞比例比较,差异无统计学意义(P>0.05)。
2.2DJ-1下调对HBE细胞增殖的影响 采用MTT比色法检测3组细胞增殖情况,结果显示,与Control siRNA组和BC组比较,DJ-1 siRNA组在接种后24、48、72、96 h的A值明显降低,差异有统计学意义(P<0.05),见表1。DJ-1 siRNA组在接种后48、72、96 h的增殖抑制率分别是36.9%、60.8%和37.6%。

表1 3组细胞接种后不同时间点A值比较
2.3克隆形成试验结果 采用克隆形成试验检测3组单个细胞的克隆形成情况,结果显示,DJ-1 siRNA组、Control siRNA组和BC组的克隆数分别为(8.00±1.67)、(12.50±2.17)个和(11.50±1.52)个,DJ-1 siRNA组的克隆数明显少于Control siRNA组与BC组,差异有统计学意义(P<0.05),见图1。
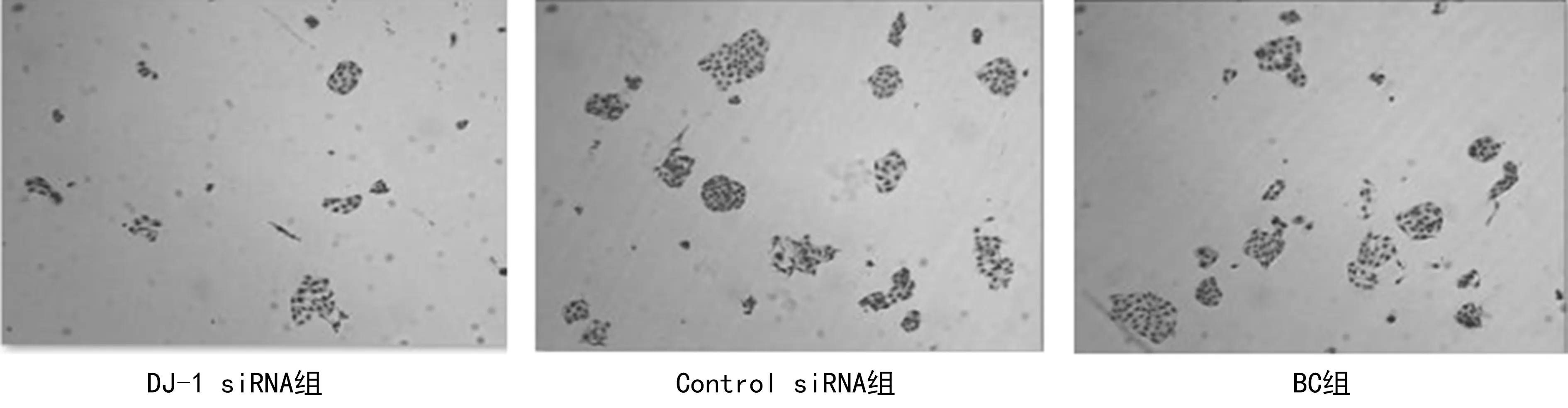
图1 3组单个细胞培养2周后的镜下图(×100)
2.4DJ-1下调对细胞迁移能力的影响 Transwell小室试验结果显示,DJ-1 siRNA组、Control siRNA组及BC组迁移细胞数分别为(44.7±2.1)、(50.3±1.5)、(51.3±1.2)个,与Control siRNA组、BC组比较,DJ-1 siRNA组的迁移细胞数明显减少,差异有统计学意义(P<0.05),而BC组和Control siRNA组迁移细胞数比较,差异无统计学意义(P>0.05),见图2。
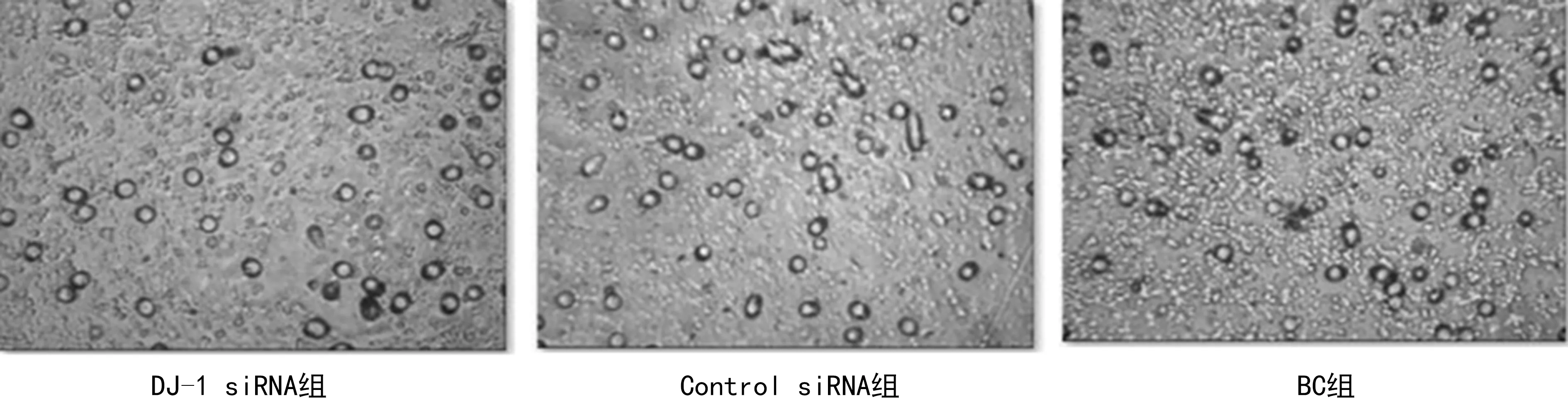
图2 3组迁移细胞镜下图(×100)
3 讨 论
DJ-1广泛存在于人胰腺、肾、肌肉、肝脏等多种器官及组织的细胞中。DJ-1含有189个氨基酸残基及3个半胱氨酸(Cys)残基,其中Cys-106为活性位点。研究发现,DJ-1不仅与帕金森病密切相关,而且在很多肿瘤中都存在过表达现象,因此其可能在肿瘤的发生和发展过程中起着重要作用[1-3]。DJ-1与肺鳞癌的发生、发展密切相关,DJ-1是一种高度保守的蛋白,在肺鳞癌中高表达,促进癌细胞分裂、增殖、迁移、侵袭。DJ-1的作用机制复杂,涉及细胞转录调控、氧化应激等多种病理、生理过程。
本研究通过下调DJ-1的表达抑制了HBE细胞的分裂、增殖、迁移、侵袭,可能涉及的DJ-1作用机制有以下几点:(1)调节人第10号染色体缺失的磷酸酶(PTEN)/磷脂酰肌醇3-激酶(PI3K)/丝氨酸苏氨酸激酶(Akt)信号通路。DJ-1可以通过抑制PTEN的活性来拮抗细胞凋亡,从而促进细胞增殖,使得PTEN/PI3K/Akt信号通路的活性增强[7-8]。(2)参与抗氧化应激。DJ-1含有3个可被氧化的Cys位点,分别是Cys-46、Cys-53、Cys-106,其中Cys-106为活性位点,可被氧化突变为丙氨酸后丧失抗凋亡能力,调节核因子E2相关因子(Nrf2)信号通路的转录过程,参与抗氧化应激[9-10]。
正常的细胞周期进程是细胞增殖的前提。本研究采用流式细胞术检测下调DJ-1表达后的HBE细胞周期变化,结果表明,下调DJ-1表达后HBE细胞的细胞周期发生明显变化,细胞阻滞于G1期(与Control siRNA组相比,DJ-1 siRNA组的G1期细胞比例增高45.23%),S期与G2期细胞数量显著减少,细胞有丝分裂受阻。MTT比色法检测细胞增殖情况,结果显示,DJ-1 siRNA组在接种后48、72、96 h的增殖抑制率分别是36.9%、60.8%和37.6%,表明下调DJ-1的表达会抑制HBE细胞的增殖。克隆形成试验结果显示,DJ-1 siRNA组的克隆数明显少于Control siRNA组与BC组(P<0.05),表明下调DJ-1的表达能够抑制HBE单个细胞的克隆,进一步证实抑制DJ-1 的表达会抑制HBE细胞增殖。结合细胞周期检测结果,表明细胞有丝分裂受阻导致了细胞增殖能力减弱。Transwell小室试验检测结果显示,与Control siRNA组、BC组比较,DJ-1 siRNA组的迁移细胞数明显减少,表明下调DJ-1的表达后HBE细胞的体外迁移和侵袭能力减弱。
DJ-1参与调节细胞的生长周期,在细胞的分裂、增殖、迁移、侵袭中起到了重要作用。笔者前期的研究表明,DJ-1作为促癌因子加速了细胞周期进程,促进了肺鳞癌细胞系(SK-MES-1细胞)的侵袭与迁移[11]。结合本研究结果,表明DJ-1作为促癌因子,不仅在肺鳞癌细胞的生长、增殖过程中起作用,而且可能在HBE细胞的生长、增殖过程中也起到重要作用。目前,DJ-1的作用机制尚未完全明确,因此对DJ-1的不断深入研究可加深人们对帕金森病以及肿瘤发生、发展、转移等的认知,为临床治疗提供新的研究方向。
