基于微流控技术的呼吸道病毒可视化免疫检测研究
2022-05-13吴力强钱纯亘聂立波
潘 婷 吴力强 钱纯亘 聂立波
1.湖南工业大学 生命科学与化学学院 湖南 株洲 412007
2.深圳市亚辉龙生物科技股份有限公司 平台预研部 广东 深圳 518100
1 研究背景
呼吸道病毒是指一大类以呼吸道为侵入门户,引起呼吸道或呼吸道以外器官病变的病毒。急性呼吸道感染(acute respiratory infection,ARI)是世界范围内,引发急性病和致死性疾病的主要病因之一[1]。全球每年大约有400万人因感染呼吸道病毒而死亡[2]。5岁以下儿童中,全球每年仅流感和呼吸道合胞病毒感染,导致的总死亡人数达30万人以上[3]。
2019年末至2020年初,一种新型冠状病毒2019-nCoV(即SARS-CoV-2)的人际传播,导致了疫情爆发。世界卫生组织(WHO)统计数据显示,截至2021年9月,全球累计确诊病例超过2.3亿,累计死亡人数达470多万。
急性呼吸道感染中,90%以上由病毒引起[4]。常见的引发急性呼吸道感染的病原体有:冠状病毒、流感病毒、呼吸道合胞病毒、人腺病毒和鼻病毒等[5]。大多数呼吸道病毒具有感染力强、传播快、潜伏期短、发病急等特点[6]。呼吸道病毒种类繁多,且感染后症状较为相似,因此诊断区分十分困难[7-9]。快速准确的检测对阻断疾病传播起着至关重要作用[10-15]。
呼吸道病毒临床检测方法主要包括快速抗原检测和核酸扩增检测[16]。目前,新型冠状病毒肺炎的检测通常要用聚合酶链式反应(polymerase chain reaction,PCR)分析仪,在专业实验室中进行,同时需要专业人员操作,这限制了医疗条件简陋的偏远地区及护理点检测的可行性[17-21]。微流控技术的快速发展,为开发成本低、用户友好的呼吸道病毒监测平台提供了新的策略。微流控芯片在微小尺度上实现流体的操控,构建出芯片实验室模型,从而将多种化学和生物学的过程集成到微全分析系统中[22-24]。微流控芯片能实现操作过程的自动化、检测目标的高通量和试剂的低消耗,还能与其他技术设备集成和兼容[25]。微流控芯片因具有试剂用量少、反应过程短、灵敏度高、成本低等优点,可广泛应用于化学、生物、物理、医学等自然科学领域[26-30]。
金纳米颗粒(gold nanoparticles,AuNPs)因其独特的物理和光学性质,已广泛用于病毒以及其他病原体和疾病的检测[31]。金纳米粒子具有可视化显色特性,在基于微流控技术的诊断设备开发中具有广泛的应用前景[32]。侧向流动法是最常用的基于AuNPs的体外诊断护理点检测方式,其操作简便且无需昂贵设备[33]。
Xia Y. Q. 等[34]开发了一种用于禽流感病毒检测的微流控传感器,该传感器以人字形聚二甲基硅氧烷(polydimethylsiloxane,PDMS)芯片为载体,在氧化锌纳米棒三维结构上包覆HA特异性抗体。捕获的病毒进一步用抗体包被的Au-Ag核壳纳米粒子标记。肉眼目测的检出限为2.7×104EID50/mL,比常规基于荧光的酶联免疫吸附测定 (enzyme-liked immuno sorbent assay,ELISA)法低一个数量级。用智能手机成像系统进行比色检测,其检出限可低至8×103EID50/mL,病毒捕获和检测过程可在1.5 h内完成。
基于上述背景,本研究开发了一种压力驱动的微流控芯片,以实现快速、直观地检测甲型流感病毒(influenza A virus,FluA)、乙型流感病毒(influenza B virus,FluB)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。
2 实验
2.1 主要实验材料与仪器设备
1)实验材料
H1N1流感抗原(病毒培养物总蛋白质量浓度1.88 mg/mL)、B流感抗原(病毒培养物总蛋白质量浓度3.56 mg/mL)、FluA抗体、FluB抗体、RSV抗体、GAM-IgG、SARS-CoV-2抗体,广东菲鹏生物股份有限公司;SARS-CoV-2抗原,深圳市亚辉龙生物科技股份有限公司;RSV 抗体,Hytest公司;氯化金(III)水合物、trizma®base,美国Sigma-Aldrich公司;牛血清白蛋白,新西兰Proliant公司;氯化钠、柠檬酸三钠、氢氧化钠、碳酸钾、磷酸氢二钠、磷酸二氢钾、氯化钾,上海国药集团化学试剂有限公司;硝酸纤维素膜,德国Merck公司;聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)板材,成都世化亚克力科技有限公司;医疗双面胶,美国3M公司。
2)仪器设备
激光雕刻机,VLS3.50型,美国Universal Laser Systems公司;真空热压机,TBS-200型,浙江扬清芯片技术有限公司;电热鼓风干燥箱,DHG-9140(A)型,上海一恒科学仪器有限公司;多功能酶标仪,Synergy LX型,美国BioTek公司;微量注射泵,Pump 11 Elite型,美国Harvard Apparatus公司;场发射透射电子显微镜,JEM-F200型,日本电子株式会社;激光共聚焦显微镜,DCM8型,德国Leica公司;涡旋混合仪,VX-200型,美国Labnet公司;数控定时超声波清洗机,040S型,深圳市洁盟清洗设备有限公司;高速冷冻离心机,5804R型,德国Eppendorf公司;磁力搅拌器,PC-620D型,美国Corning公司。
2.2 实验方法
2.2.1 检测原理
基于微流控技术的可视化呼吸道病毒免疫检测原理如图1所示。

图1 基于微流控技术的可视化呼吸道病毒免疫检测原理图Fig. 1 Schematic diagram of visual immunoassay of respiratory virus based on microfluidic technology
待检测抗原经加样口注入芯片,首先与包被溶解区的胶体金标记抗体反应,在混合区进一步充分混合形成抗原抗体复合物后,流经检测区,捕获抗体与抗原进行特异性识别,形成抗体-抗原-抗体夹心结构,并在检测区聚集。胶体金为颜色型标记材料,聚集后产生明显的显色反应,通过微流控芯片检测区检测线颜色的有无,进行样本中检测目标物的判定。
2.2.2 胶体金的制备
胶体金的制备采用柠檬酸三钠还原法。具体制备过程如下:将250 mL去离子水放入洁净的玻璃器皿中,并置于可加热磁力搅拌器上加热至沸腾,然后加入质量分数为2%的柠檬酸三钠溶液2.25 mL;当溶液再次沸腾后,迅速加入质量分数为1%的氯金酸溶液2.5 mL,溶液颜色变为酒红色,继续加热煮沸5 min;冷却至室温后用去离子水补足至原体积;将制备好的胶体金溶液室温避光保存。
2.2.3 胶体金标记抗体最佳pH条件优化
向盛有1 mL胶体金的各试管中分别加入0, 3,6, 9, 12, 15, 18, 21, 24, 27, 30 μL浓度为0.2 mol/L的K2CO3溶液,混匀,得到一系列不同pH梯度的胶体金溶液。待pH值稳定后,向每管中分别加入质量浓度为1 mg/mL的相应抗体10 μL,并颠倒混匀。4 ℃下静置过夜观察胶体金状态,并进行紫外可见光谱(UV-Vis)检测,不稳定的胶体金呈现出由红变蓝的聚沉现象。将使胶体金稳定的0.2 mol/L K2CO3溶液最低用量作为对应的胶体金标记抗体最佳条件,测出该条件下溶液的pH值,即为最佳标记pH值。
2.2.4 标记最佳抗体用量优化
在胶体金与抗体偶联过程中,适当的抗体用量是保证检测灵敏度及控制抗体用量成本的关键。因此对胶体金标记抗体的最佳用量进行优化。
取10 mL制备好的粒径均一的胶体金,滴加0.2 mol/L K2CO3溶液调节胶体金溶液的pH值至最佳标记pH值。然后将此胶体金溶液分装入1.5 mL的离心管中,每管1 mL,各管中分别加入FluA、FluB、RSV抗体的量均依次为0, 1, 2, 4, 6, 8, 10, 12 μg,SARS-CoV-2抗体加入量依次为0, 3, 6, 9, 12, 15, 18,21 μg,振荡混匀后,室温孵育l0 min。最后,每管取出200 μL并加入质量分数为10%的NaCl溶液20 μL,混合均匀后室温孵育2 h,观察离心管中胶体金溶液的颜色变化情况,并进行UV-Vis检测,从而确定最佳抗体用量。
2.2.5 胶体金标记抗体表征
根据实验得出的胶体金标记抗体最佳条件,分别对本研究中呼吸道病毒检测项目的抗体进行标记。为了评估标记效果,用紫外可见光谱和透射电子显微镜,对经标记及纯化后的胶体金标记抗体进行检测和表征。
2.2.6 芯片的设计与制作
采用AutoCAD软件进行芯片设计。单通道微流控芯片由底板、废液腔层、通道层和盖片组成,如图2所示。通道层由进样口、包被溶解区、混合区、检测区构成。盖片为一矩形光板,其上开有两个孔,分别为注液孔和排气孔。底板、废液腔层、通道层和盖片键合形成了密闭微通道,构成芯片的功能区域。
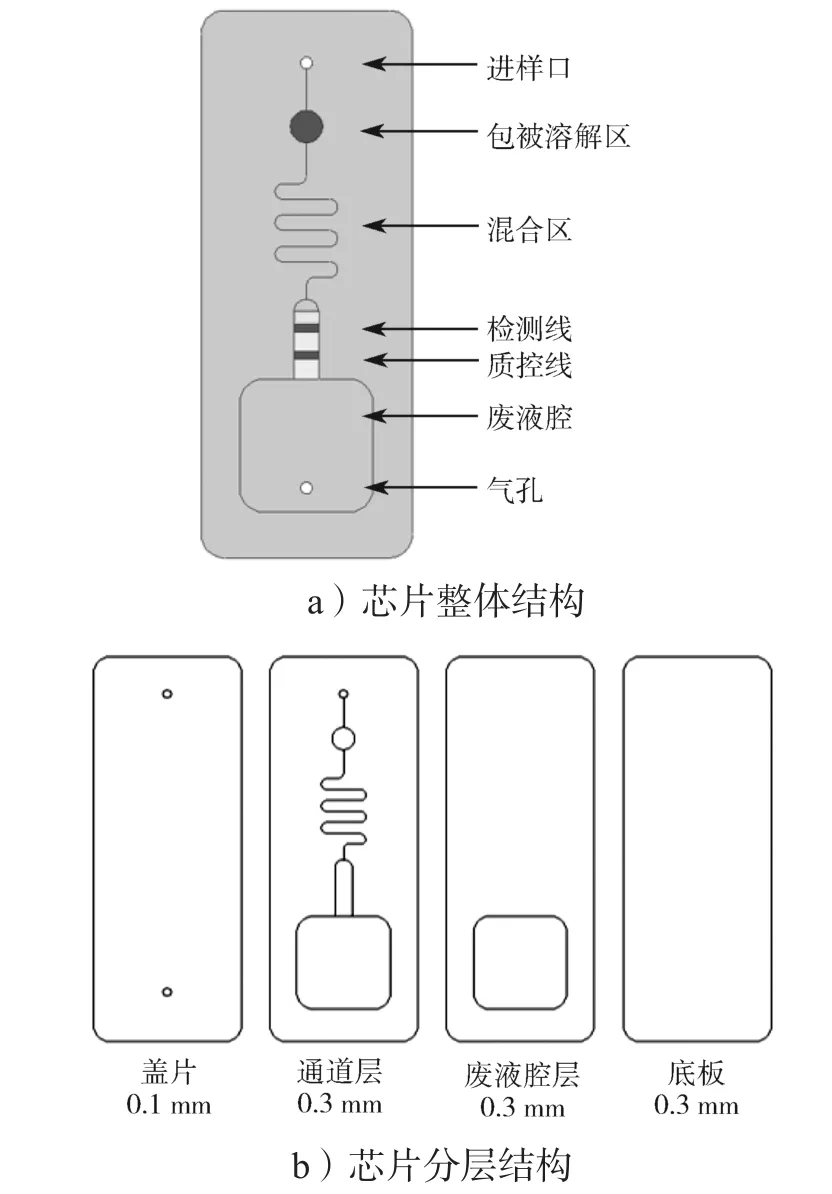
图2 微流控芯片的设计结构Fig. 2 Design structure of the microfluidic chip
选用聚甲基丙烯酸甲酯(PMMA)为基材,根据设计图(见图2b),用激光雕刻机加工。其中通道层、废液腔层、底板厚度均为0.3 mm,盖片厚度为0.1 mm。芯片组装工序如下:先将通道层上下底面贴双面胶,废液腔层下底面贴双面胶,接着将芯片的底板与废液腔层贴合,用真空热压机进行热压键合,并对其上表面进行亲水处理。在处理好的芯片上表面粘贴通道层,将玻纤切割后嵌入包被溶解区,以其作为载体,滴加胶体金标记抗体。在检测区嵌入经激光切割好的硝酸纤维素膜(nitrocellulose membrane,NC膜),膜上包被有两条捕获抗体线,质控线为GAMIgG(C线),检测线为对应呼吸道病毒的包被抗体(T线)。胶体金标记抗体进行干化处理后,再将盖片贴至上层,真空热压键合,制得完整的测试芯片。
2.2.7 呼吸道病毒检测
采用自制微流控芯片,分别对甲型流感H1N1灭活病毒、乙型流感灭活病毒、呼吸道合胞病毒标准抗原、新型冠状病毒标准抗原进行检测。将配置好的80 μL抗原检测样本用注射泵通过加样口注入芯片,流速为8 μL/min,反应10 min,直至结果稳定,进行结果读取。
2.2.8 信号采集与处理
信号可通过肉眼可视化检测。但是,为了科学评估微流控免疫芯片的检测性能,本研究先利用智能手机对检测结果进行拍照,再用Image J软件提取图像光密度值,最后用Origin 2019b软件处理数据,得到拟合曲线。
3 结果与讨论
3.1 胶体金的表征
用多功能酶标仪对所制备的胶体金进行UV-Vis检测,并用透射电子显微镜对其形貌及分散性进行表征,结果如图3 所示。由图3可知,胶体金的最大吸收峰位于520 nm处,其粒径大小为(19.73±1.20)nm,且分散均一性良好。

图3 胶体金的表征Fig. 3 Characterization of AuNPs
3.2 胶体金标记抗体最佳pH条件
采用柠檬酸三钠还原法制备的胶体金表面带有大量负电荷,胶体金对蛋白质的吸附主要取决于pH值。当胶体金悬浊液PH值接近蛋白质等电点或稍偏碱性时,二者容易形成牢固的结合物。本研究对胶体金标记抗体的最适pH值进行了条件优化,实验结果如图4所示。
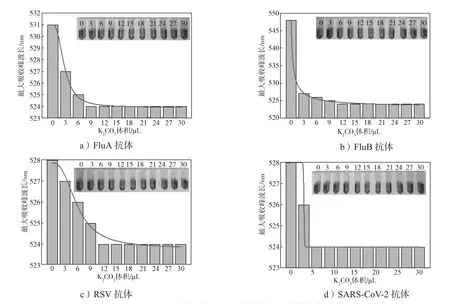
图4 胶体金标记不同抗体的pH条件优化Fig. 4 Optimization of pH values of different antibodies labeled with AuNPs
由图4可知,随着K2CO3溶液加入量的增加,即pH的升高,胶体金颜色由紫变红并趋于稳定。将使1 mL胶体金稳定的最低K2CO3溶液加入量作为最佳标记条件,结果是FluA、FluB、RSV和SARSCoV-2抗体标记的最佳K2CO3溶液加入量分别为9,12, 12, 6 μL,对应的pH值分别为7.7, 8.1, 8.2, 7.2。
3.3 标记抗体最佳用量
蛋白质用量影响胶体金与蛋白质结合的稳定性。为达到理想标记效果,本研究对胶体金标记抗体的最适用量进行了条件优化,实验结果如图5所示。由图5可知,随着抗体用量的增加,胶体金由蓝变红并趋于稳定。选取能使胶体金稳定的最低抗体用量为标记最佳抗体用量,结果是每1 mL胶体金中FluA、FluB、RSV和SARS-CoV-2抗体的最佳用量分别为4,4, 4, 15 μg。实际应用中为达到更好的结合效率,在此基础上增加5%~10%的抗体用量。

图5 不同病毒标记抗体的用量优化Fig. 5 Optimization of antibody amounts of different viruses

彩图
3.4 胶体金标记抗体结果表征
根据最佳标记pH及标记抗体最佳用量,进行了抗体小样标记,并对标记后的胶体金与抗体偶合物进行了UV-Vis检测,结果如图6所示。
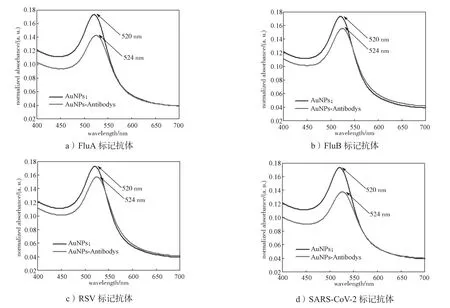
图6 胶体金标记抗体的UV-Vis光谱图Fig. 6 UV-Vis spectra of AuNPs -labeled antibodies
由图6可知,胶体金的最大吸收峰波长为520 nm,胶体金标记抗体的最大吸收峰波长为524 nm,表明抗体与胶体金成功偶联。
对标记后的偶合物进行透射电镜表征,结果如图7所示。由图7可知,标记后粒径为(21.31±1.50)nm,比裸胶体金的粒径略有增加,粒径均一,且分散性好。
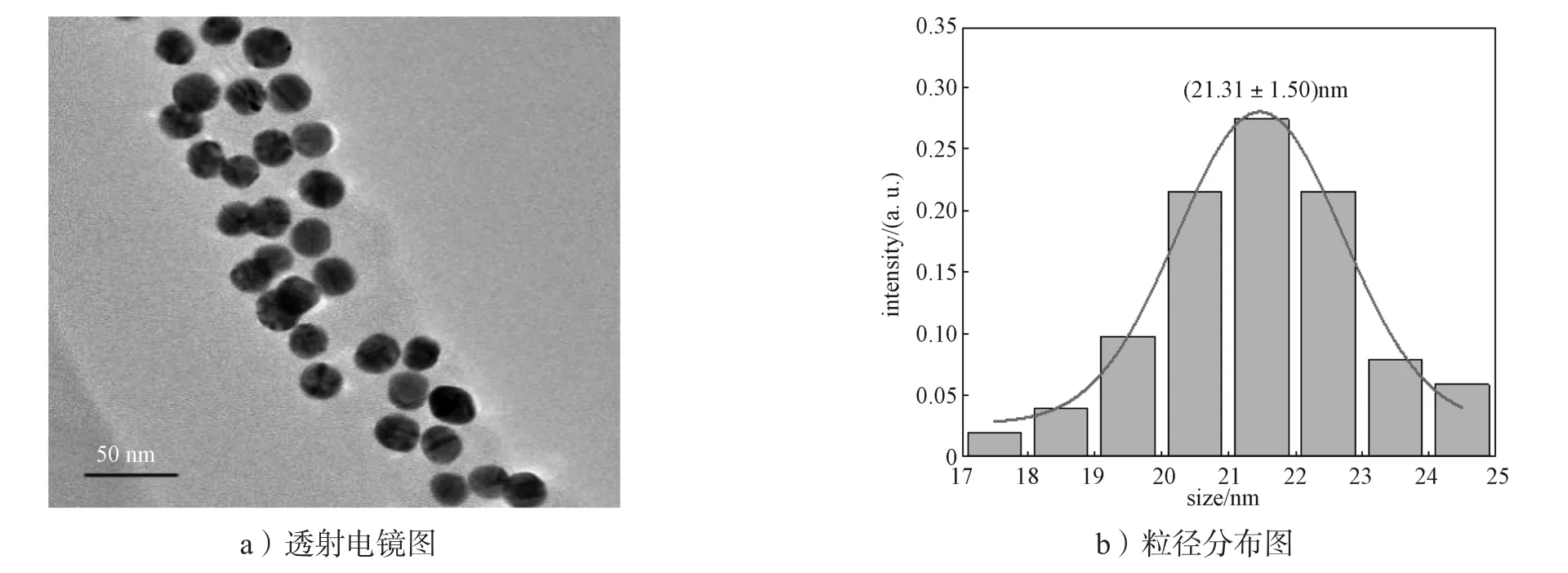
图7 胶体金标记抗体的表征Fig. 7 Characterization of AuNPs-labeled antibody
3.5 检测灵敏度
采用本研究制作的芯片分别对FluA、FluB、RSV、SARS-CoV-2 4种呼吸道病毒进行抗原浓度梯度检测,每个浓度进行3次重复测试,采用Image J软件对检测结果进行光密度值提取,并计算出平均光密度值,结果如图8所示。
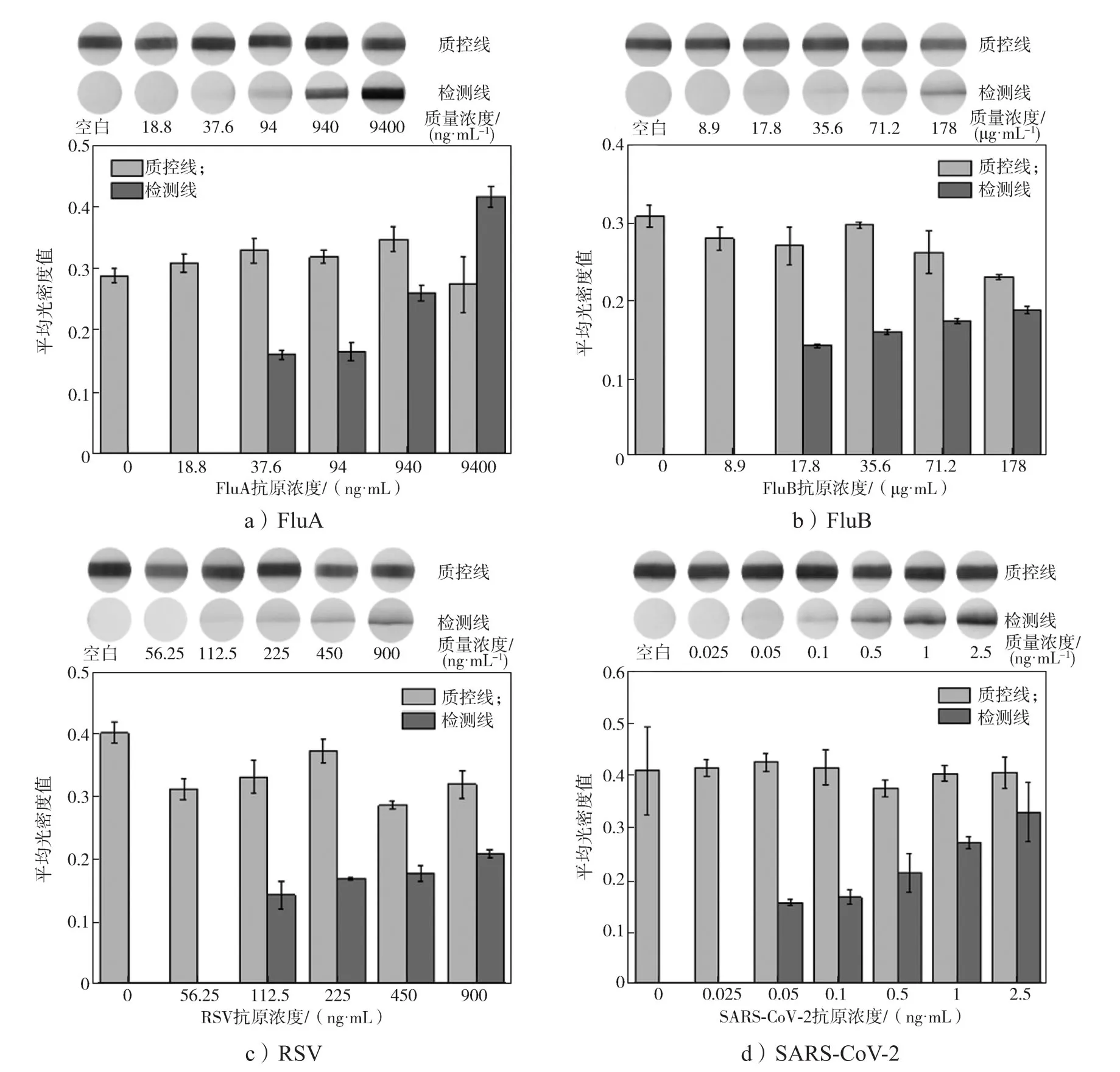
图8 不同病毒抗原浓度的检测结果Fig. 8 Detection results of different antigen concentrations of viruses

彩图
由图8可知,肉眼可见胶体金的颜色随着抗原质量浓度的降低而变浅, 阴性则无反应现象。实验组的平均光密度明显高于阴性对照组的,说明芯片可实现对4种病毒的检出。当FluA抗原质量浓度为37.6 ng/mL时,可检出信号,而当质量浓度为18.8 ng/mL时,无检测信号,即检出限为37.6 ng/mL。同样可得,芯片对FluB检出限为17.8 μg/mL,对RSV标准抗原和SARS-CoV-2标准抗原检出限分别112.5 ng/mL和0.05 ng/mL。此外,本检测从进样到显色,直至显色结果稳定,总检出时间为10 min。
3.6 检测特异性
为了验证微流控芯片的检测特异性,配制不同浓度抗原,每个浓度进行3次重复测试,结果如图9所示。FluA灭活病毒、FluB灭活病毒、RSV标准抗原、SARS-CoV-2标准抗原的质量浓度分别为9.4 μg/mL, 178.0 μg/mL, 900.0 ng/mL, 2.5 ng/mL。
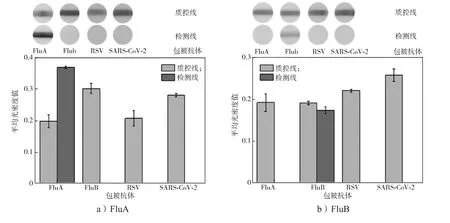

图9 不同病毒的检测特异性Fig. 9 Detection specificity of different respiratory viruses

彩图
由图9可知,病毒特异性检测以其他3种病毒作为干扰物,每种病毒的检测线只有相应病毒出现信号,其他3种干扰病毒无信号,说明不同检测项目之间无相互干扰,特异性良好。
4 结语
本研究以微流控芯片为载体,实现了呼吸道病毒可视化免疫检测。通过芯片设计将进样区、包被溶解区、混合区、检测区集成在微流控芯片上。芯片结构的设计中引入蛇形混合区,通过对流体流速的控制使目标物与包被抗体能更加充分地反应,提高检测的灵敏度。以注射泵作为流体驱动力,通过精准的流体控制实现了甲型流感H1N1、乙型流感灭活病毒、呼吸道合胞病毒、新型冠状病毒标准抗原的可视化检出,总检出时间为10 min,单次所消耗样本量为80 µL。所研制的免疫微流控芯片具有特异性高、样品量少、操作简便、检测快速、无交叉反应等特点。
相较于传统的免疫学检测试纸,本研究中微流控芯片的制备步骤相对较多,但这仅限于实验室制备,工业生产时可采用注塑成型法替代,以便于快速大批量制备,降低成本。对于传染性病原体的检测,集成式的芯片提供相对封闭的检测环境,可有效防止疾病的扩散。在后续研究中,可通过微流控芯片结构的设计实现多项目的联合检测,提高筛查效率;还可开发简易的自动化集成设备,用于医疗资源相对缺乏地区疾病筛查及床旁快速检测。
