利用制革废弃牛毛制备角蛋白基水凝胶研究
2022-05-13孙莉肖远航王春华穆畅道林炜
孙莉 ,肖远航 ,王春华 ,穆畅道 ,林炜 *
(1. 四川大学制革清洁技术国家工程实验室,四川 成都 610065;2. 四川大学化学工程学院,四川 成都 610065)
前言
在制革工业中,每产出 3000 张牛皮会产生5~10 t 废弃牛毛[1]。然而,目前绝大部分废弃牛毛并未得到充分利用,多被焚烧或填埋处理[2],不仅造成了资源浪费,还会带来环境污染[3-4]。这些废弃牛毛属于天然的角蛋白资源,来源丰富且价格低廉,具有良好的生物相容性和可生物降解性 ,应用价值高[2,5]。角蛋白中含 15.0%~18.0%的氮,1.5%~2.0%的磷,2%~5%的硫及多种微量元素,能为植物的生长提供必需的养分[6],将废弃牛 毛角蛋白用作肥料是一种经济合理的资源化利用方式。近年来出现了一种新型肥料,即将所需养分负载于水凝胶上,又称 缓 释 肥 水 凝 胶,可使养分更加有效的吸收和释放,明显提高肥料的利用效率。因此,将制革废弃牛毛角蛋白用于制备水凝胶,不仅其自身就是很好的肥 料 , 而 且角蛋白水凝胶还可作为其它肥料的载体 ,从而实现肥料的高效利用 ,减少养分流失及由此造成的环境污染问题[7]。
角蛋白中所含的氨基酸种类约 20 种[8],分子链上的反应活性位点较多,可发生多种化学反应以 制备所需水凝胶。其中可用于接枝的位点主要有以下几种:被还原的胱氨酸侧链上的巯基[7-10]赖氨酸侧链上 的 伯氨 基[11-13]和酪氨酸侧链上的苯酚式结构等 。Ali Khademhosseini 团队[14]报道了通过可见光引发巯基 - 降冰片烯反应 得到的角蛋白 - 聚 乙 二醇(PEG)水凝胶,即将四臂聚乙烯醇接枝降冰片烯作为交联剂,在可见光照射下一分钟内形成水凝胶。 但 是该报道 所 得的水凝胶制备方法复杂 ,成本高 ,不适用于农业领域中,因为作为肥料载体的水凝胶 材 料,低成本是研 究 开发的关键因素[15]。Yussef Esparza[16]等人从人发、羊毛和羽毛中提取的还原角蛋白(这里简写为 K-SH) 可通过 H2O2催化形成二硫键得到水凝胶。但我们通过预实验发现,相比该文献中所使用的 K-SH,从制革废弃牛毛中所提取的 K-SH 相对分子质量较低,仅通过二硫键的交联不能形 成水凝胶。因此,本文选择甲基丙烯酸酐(MA)作为改性剂 , 以期 在 K-SH 分子链结构中引入 C=C 活 性 基团,进一步通过交联反应制备角蛋白水凝胶。
目前,MA 作为改性剂被广泛用于蛋白质的改性,可在蛋白质中引入参与自由基聚合反 应 的 C=C键。Van Den Bulcke 等人[17]用 MA 对明胶上的伯氨基团进行酰化改 性 ,从而引入C=C双键 得 到改性 明胶。这种改性明胶在排除氧气的条件下,通过光引发 剂及紫外辐照可 引 发 C=C 双键自 由 基聚 合 形 成水凝胶。然而,我们前期的探索实验发现,K-SH 与MA在有氧且不加引发剂的条件下即可形成水凝胶,显然这两种水凝胶的形成机理不同。推测后 者是因为 MA 不仅可与 K-SH 结构中的侧链氨基发生酰化反应使之引入 C=C 双键,同时 K-SH 高反应活性的游离巯 基 与该 C=C 双键可 直 接发生 巯 基 - 烯反应;并且 MA 在酰化改性 K-SH 过程中产生的甲基丙烯酸也可能与巯基发生巯基 - 烯反应;因此才会在 MA 酰化改性 K-SH 时直接生成了水凝胶。这些都需要通过实验研究验证,以明确两者之间的化学交联机理,为角蛋白基水凝胶的制备与应用提供理论依据。
本文利用制革废弃牛毛制备得到的 K-SH,采用 MA 改性交联后得到 甲 基丙烯酰化角蛋 白 水 凝胶(KMA-Gel),其制备方法简单,反应条件温 和 ,将其作为肥料缓释的水凝胶载体,符合循环经济理念 。 通 过 测 定 K-SH 结 构 中 氨 基 及 巯 基 转 化 度 、FT-IR、1H-NMR 和 XPS 对改性角蛋白 (KMA) 的分子结构进行表征,可推断出 K-SH 与 MA 的化学交联机理,以期为角蛋白基材料的合成研发提供新思路和参考。
1 实验部分
1.1 主要原料及仪器
制革废弃牛毛,兴业皮革科技股份有限公司 ;甲基丙烯酸酐,AR,上海阿拉丁有限公司;甲基丙烯酸,AR,上海阿拉丁有限公司;2,4,6- 三硝基苯磺酸(TNBS),AR,上海阿拉丁有限公司;磷酸二氢钠·二水 ,AR,成 都 市科龙化工试剂厂 ;磷 酸 氢二钠·十二水,AR,成 都 市科龙化工试剂厂 ; 乙 二 胺四 乙 酸,AR;5,5’- 二 硫 代 双 - ( 二 硝 基 苯 甲 酸),AR;Tris-base,AR;过 氧 化 氢(30%),AR,成 都 市 科 龙 化工试剂厂。
渗析袋,截留相 对 分子质量为 8000~14 000,上海 源 叶 生 物 科 技 有 限 公 司 ; 冷冻干燥机 ,ALPHA 1-2 LD,德 国 CHRIST 公 司 ;pH 酸 度 计 FE28,梅 特勒-托利多有限公司 ; 傅 里 叶 变 换 红 外 光 谱 仪 ,Nicolet IS 10,美国赛默飞公司;核磁共振氢谱仪,Avance Ⅲ-400 MHz,瑞士 Bruker 公司;紫外可见分光光 度 ,U-3900, 日 立 有 限 公 司 ;X 射 线 光 电 子 能 谱仪 ,250XI,美国赛默飞公司 ;场 发 射 扫 描 电 子 显 微镜,Helios G4 UC 型,美国赛默飞公司。
1.2 巯基乙醇还原法提取角蛋白
首先,将 100 g 制革废弃牛毛浸入 1 L 含 1% 十二 烷 基 硫酸 钠(SDS)的烧 杯 中,以 去除 牛 毛 中 所 含的油脂和有机物。然后,将洗净后的牛毛浸入 1 L 含丙酮 / 乙 醇(体积比为 1∶1)的烧杯中,于 37 ℃条 件下水浴震荡 48 h,牛毛捞出后,将其在 37 ℃的烘箱中干燥,直至恒重。
称取干燥后的牛 毛10 g 于 250 mL 三 口 烧 瓶中,然后加入 10 mL 巯基乙醇、48 g 尿素、5 g SDS 及200 mL 去离子水于上述三颈烧瓶中。将其置于 10 0℃油浴条件下搅拌反应 12 h 后,对牛毛水解液进行抽滤、透析处理,之后将透析液冷冻干燥 2 d 得到牛毛还原角蛋白(K-SH)以备用。
1.3 甲基丙烯酰化角蛋白水凝胶的制备
称取 0.300 g K-SH 溶于 1 mL 磷酸缓冲液(pH 7.5)中,得到质量浓度为 0.3 g/mL 的 K-SH 溶液。向其中加入 0.2 mL MA 溶液,将混合液在室温下搅拌反应 1 h,然后置于 50 ℃的水浴锅中孵育 3 h,即可得到 KMA-Gel。将水凝胶样品冷冻干燥后,对其表面进行喷金处理,用扫描电子显微镜在 20 kV 条件下观察其形貌特征。
1.4 甲基丙烯酰化角蛋白水凝胶的化学交联机理研究
理论上分析,在 K-SH 和 MA 的反应体系中,K-SH 分子链中的 -NH2可发生酰化反应,从而引入C=C 双键;进一步地可与 K-SH 结构上的 -SH 发生巯基 - 烯反应。实验首先氧化 K-SH 结构上的巯基为磺酸基团,得到氧化角蛋白,简称为 K-SO3,并制备了甲基丙烯酰化氧化角蛋白(MA-K-SO3),以封闭-SH 来探究水凝胶的成胶过程是否发生了酰化反应。然后,通过改变 MA 的用量,将不同比例的K-SH 与 MA 反应制备了一系列甲基丙烯酰化角蛋白(KMAx,x 表示反应时 MA 与 K-SH 的质量比)以探究 K-SH 和 MA 的化学交联机理。最后,实验将K-SH 与甲基丙烯酸 (MAA) 在相同条件下反应,制备得到甲基丙烯酸化角蛋白(MAA-Keratin),以探究K-SH 与 MA 发生酰化反应生成的副产物 - 甲基丙烯酸(MAA)是否能与 K-SH 上的巯基发生巯基 - 烯反应。
1.4.1 甲基丙烯酰化氧化角蛋白的制备
首先,制备 3%K-SH 的水溶液,向其中加入 1 mL 30% 的 H2O2在 50 ℃ 下 反 应 10 h, 以 氧 化K-SH 结构上的巯基为磺酸基团,得到 K-SO3,冷冻干燥以备用;然后,称取 0.300 g K-SO3于 10 mL磷酸缓冲液 (pH 7.5) 中,并加入 0.2 mL MA,将混合液在室温下搅拌反应 5 h 后,加入 20 mL 磷酸缓冲液稀释以终止反应 , 最后,冷冻干燥得到MA-K-SO3以备用。
1.4.2 甲基丙烯酰化角蛋白的制备
首先,称取 0.300 g K-SH 溶于 10 mL 磷酸缓冲液(pH 7.5)中,得到质量浓度为 0.03 g/mL 的 K-SH溶液。然后,分别向其中加入 0.1~0.3 mL MA 溶液,并将混合液在室温下搅拌反应 5 h 后,加入 20 mL磷酸缓冲液稀释以终止反应。最后,将所得溶液用去离子水在室温下透析以移除未反应的物质,冷冻干燥后即得 KMAx。对样品 K-SH 和 KMA2/3(mMA∶mK-SH= 2∶3)进行红外谱图测试,分别将 1 mg 样品与 150 mg KBr 研磨并压片,再通过红外光谱仪进行测试。
1.4.3 甲基丙烯酸化角蛋白的制备
首先称取 0.300 g K-SH 溶于10 mL 磷酸缓冲液(pH 7.5)中,得到质量浓度为 0.03 g/mL 的 K-SH溶液。向其中加入 0.2 mL MAA 溶液,并将混合液在室温下搅拌反应 5 h 后,加入 20 mL 磷酸缓冲液稀释以终止反应,透析并冷冻干燥后,即得甲基丙烯酸化角蛋白 (MAA-Keratin)。
1.4.4 氨基及巯基转化度测定
氨基含量测试的方法采用三硝基苯磺酸法(2,4,6-trinitrobenzenesulfonic acid sol, TNBS)[18],量取1 mL 质量浓度为 1.5 mg/mL(以 pH 7.4 的磷酸缓冲液作为溶剂) 的 K-SH 溶液以及不同反应度的KMAx溶液于 25 mL 比色管中,依次加入 1 mL 4%的NaHCO3溶液和 1 mL 0.1%的 TNBS 溶液。然后将混合液置于 40 ℃水浴条件下避光反应 2 h,并在波长415 nm 处测定溶液的吸光度。
巯基含量的测定方法采用 Ellman 标准曲线法测定[19]。配置反应缓冲液 A(8 M 尿素,3 mM EDTA,1%SDS 和 0.2 M Tris-HCl,pH 8.0)。1 mL 反应缓冲液 A 溶解 4 mg 5,5’- 二硫代双 -(二硝基苯甲酸)配置成 Ellman 试剂溶液。将 15 mg K-SH 以及不同反应度的 KMAx分别置于 1 mL 缓冲液 A 中,随后将样品在室温下摇动 2 h 使蛋白质溶解。取若干试管,每管含 50 μL Ellman 试剂和 2.5 mL 的反应缓冲液A。在各试管中加入 250 μL 的待测物溶液,在室温混合再次摇动 1 h,并在 412 nm 处测量待测液的吸光度值。
最后根据公式计算 KMAx的取代度,研究了MA 与 K-SH 的质量比对 K-SH 结构中 -NH2和-SH 的转化度影响规律:

其中 DS 代表转化度,ODg为角蛋白的吸光度,ODm为 KMAx的吸光度。
1.4.5 核磁氢谱1H NMR
对 K-SO3、MA-K-SO3;K-SH 和 KMA2/3以 及MAA-Keratin 进行核磁谱图测试,分别称取 10 mg样品溶于 0.55 mL 氘代 DMSO 中,在 25 ℃下通过核磁共振氢谱仪测试。
1.4.6 X- 光电子能谱仪 (XPS)
对 K-SH 及 KMA2/3中的元素种类采用 XPS 进行分析,分析室真空度为 8×10-10Pa,激发源采用Al Kα 射线(hv=1486.6 eV)。
2 结果与讨论
2.1 KMA-Gel的制备
甲基丙烯酰化角蛋白水凝胶(KMA-Gel)的制备方法简单,通过向 K-SH 中加入 MA 后孵育 3 h即可生成水凝胶,MA 可作为交联剂将角蛋白分子链连接起来,如图 1 为冷冻干燥后的 KMA-Gel 的SEM 图,从中可以看出该水凝胶是一种多孔性的材料,具有三维网状结构。
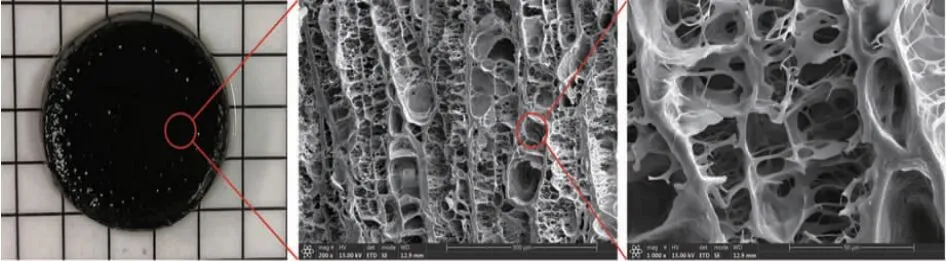
图1 甲基丙烯酰化角蛋白水凝胶的 SEM 图Fig.1 SEM image of KMA-Gel
2.2 KMA-Gel的化学交联机理表征
2.2.1 角蛋白中氨基及巯基的转化率测定
为了探究 KMA-Gel 的合成机理,实验通过改变 MA 的用量,制备了系列不同的 KMAx,并用TNBS 和 Ellman 法测定 KMAx中氨基和巯基的转化率(DC)。结果如图 2 所示,K-SH 结构中氨基和巯基转化度的变化初步表明了其氨基和巯基均与 MA发生了反应。随着 MA 用量的增加,KMAx 中氨基的转化率(DC)基本不变,保持在 60%左右;巯基的转化率从 37%提高到 67%。并且从图 2 中可看出,在不添加 MA 的情况下,K-SH 结构中巯基的转化率约为 19%,这是由于巯基可能部分氧化形成二硫键。因此推测在 K-SH 与 MA 的反应体系中,主要发生的反应为 K-SH 结构中的氨基发生的酰化反应和巯基发生的巯基 - 烯反应。
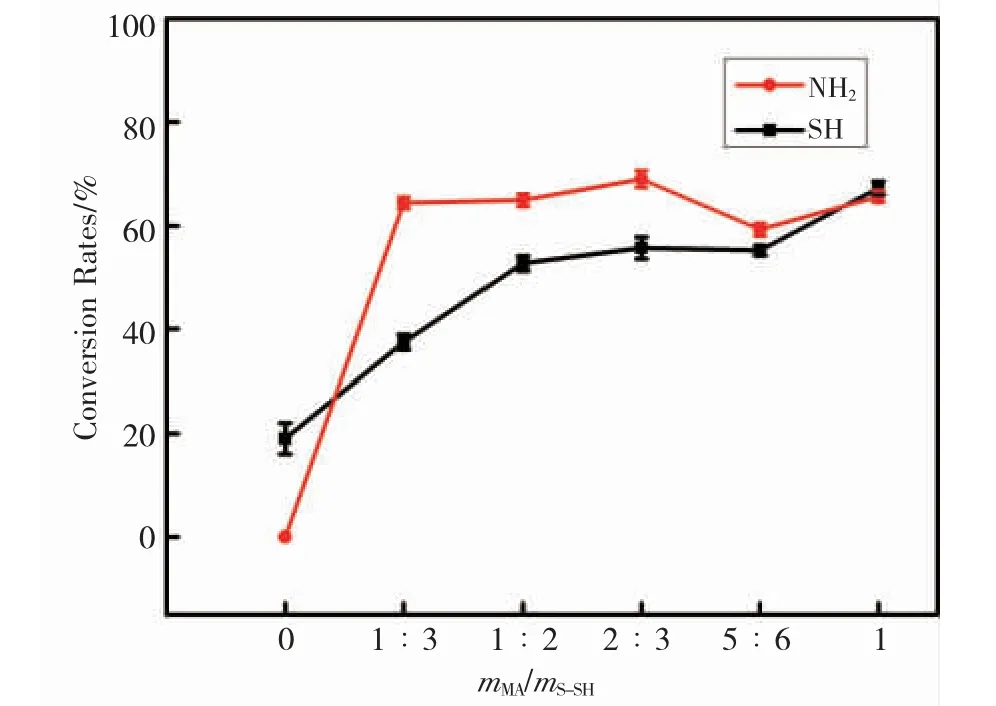
图2 MA 用量对 KMAx 中 -NH2 和 -SH 转化率的影响Fig.2 The influence of the dosage of methacrylic anhydride on the conversion rates of -NH2 和-SH in KMAx
2.2.2 红外光谱图分析
图3为 K-SH 和 KMA2/3的红外图谱,可进一步确认 K-SH 和 MA 之间发生的化学交联反应。结果如图3所示,K-SH 的红外谱图中 3300 cm-1处的宽吸收峰为 N-H 键的伸缩振动引起的,可归属于酰胺A 的特征吸收峰。1645 cm-1为 C=O 伸缩振动、1540 cm-1为 N-H 弯曲和 C-H 伸缩振动,1200 cm-1主要是 C-N 伸缩振动,分别对应角蛋白的酰胺 I、酰胺 II和酰胺 III[20]。K-SH 与 KMA2/3的吸收峰几乎一致,都表现出角蛋白的特征吸收带,此外,KMA2/3光谱中3300 cm-1、1645 cm-1、1540 cm-1、1225 cm-1处的峰强增加,这可能是由于 K-SH 与 MA 之间通过酰化反应生成更多酰胺键引起的。

图3 K-SH 和 KMA2/3 的 FT-IR 谱图Fig.3 FT-IR spectras of K-SH and KMA2/3
2.2.31H NMR 分析
当 K-SH 上成功引入碳碳双键(C=C)后,C=C 双键可能会与其自身结构中的巯基发生巯基 - 烯反应进一步自交联。因此,为了验证是否引入了 C=C双键,实验中通过使用氧化剂 H2O2将 K-SH 上的巯基氧化为磺酸基团,从而封闭巯基,得到了氧化角蛋白 (K-SO3),将其与 MA 反应得到 MA-K-SO3。图4 为 K-SO3和 MA-K-SO3的1H NMR 图谱。结果如图所示,δ =5.2~5.6 处(即 A)为甲基丙烯酸的碳碳双键上氢的化学位移,δ =1.7(即 B)处为甲基丙烯酸的甲基 结 构 上氢 的 化学 位 移[21]。 与 K-SO3相 比 ,MA-K-SO3的图谱中 5.2<δ<5.6 和 δ =1.7 处出现相应的吸收峰,从而证实了 MA 与 K-SO3上的氨基发生了酰化反应,角蛋白分子结构中成功引入了碳碳双键(C=C)。
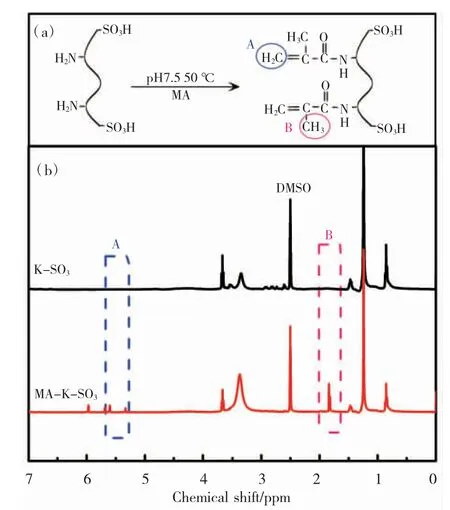
图4 氧化角蛋白和改性氧化角蛋白的 1H NMR 谱图Fig.4 1HNMR spectras of K-SO3 and MA-K-SO3
图5 为 K-SH 和 KMA2/3的1H NMR 图谱。据文献报道[22],MA 结构中碳碳双键(C=C)的氢化学位移在 5.7<δ<6.2 的位置。从图 5 中可看出,在 d =2.8处 (即 C) 为 K-SH 结构中游离氨基上氢的化学位移。d =1.9 处(即 D)为巯基氢的化学位移。结果显示,与 K-SH 相比,在 KMA2/3的氢谱中游离氨基上氢(C)的特征吸收峰消失,推测 K-SH 结构中的氨基与 MA 发生了酰化反应。然而在 KMA2/3的氢谱中并未观察到 C=C 双键的特征吸收峰,与此同时,从插图中可看出 K-SH 在与 MA 反应后,其结构中巯基氢的特征吸收峰消失,因此推测这是因为 K-SH 上成功接枝的 C=C 双键与 K-SH 结构中的巯基发生了巯基 - 烯反应。

图5 K-SH 和 KMA2/3 的 1H-NMR 谱图Fig.5 1H-NMR images of K-SH and KMA2/3
K-SH 与 MA 通过酰化反应会生成副产物 -甲基丙烯酸(MAA)[23],并且从理论上分析 MAA 结构中存在的 C=C 双键也可与 K-SH 上的巯基发生巯基 - 烯反应。因此实验制备了甲基丙烯酸化角蛋白(MAA-Keratin) 以验证该推论。图 6 为 K-SH、MAA-Keratin 和 MAA 的1H NMR 图谱。从图中可知,MAA 结构中碳碳双键(C=C)上氢的化学位移在5.7<d<6.2 的位置,甲基上氢的化学位移为 d =1.7。在 d =1.8 处(即 E)为 K-SH 中巯基氢的化学位移。结果显示,与 MAA 相比,MAA-Keratin 核磁氢谱图中未出现 C=C 双键上氢的特征吸收峰,并且从插图中可以看出 K-SH 与 MAA 反应后结构中巯基氢的特征吸收峰消失。推测在该反应条件下,K-SH 结构中的巯基可与 MAA 发生巯基 - 烯反应。
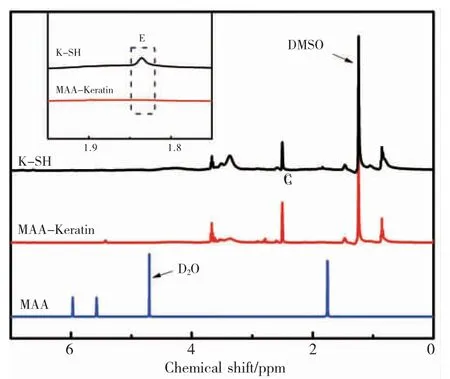
图6 K-SH、MAA-Keratin 和 MAA 的 1H-NMR 谱图Fig.6 1H-NMR images of K-SH、MAA-Keratin and MAA
2.2.4 XPS 分析
通过 XPS 测试进一步研究了角蛋白改性后的元素和键能变化,如图 7 所示。在角蛋白改性前后,N 1s 的特征峰 (~400 eV) 和 S 2p 的特征峰(~164 eV)[24]均发生了变化。通过对氮硫元素进行分峰拟合,从 N 的分峰拟合图 7(b)中可以看出,在 400 eV结合能处对应官能团为 N-C=O,经过改性后 KMA2/3中该处的峰面积显著增大,进一步证明了角蛋白改性过程中确实发生了酰化反应生成更多的酰胺键。图 7(c)为 K-SH 与 KMA2/3中 S 的分峰拟合图,从中可 以 看出 在 164 eV 结合能 处对 应 K-SH 中 的R-SH,而 KMA2/3图谱并没有此峰,表明 K-SH 中R-SH 与 MA 中的 C=C 双键之间发生了巯基 - 烯反应[25]。
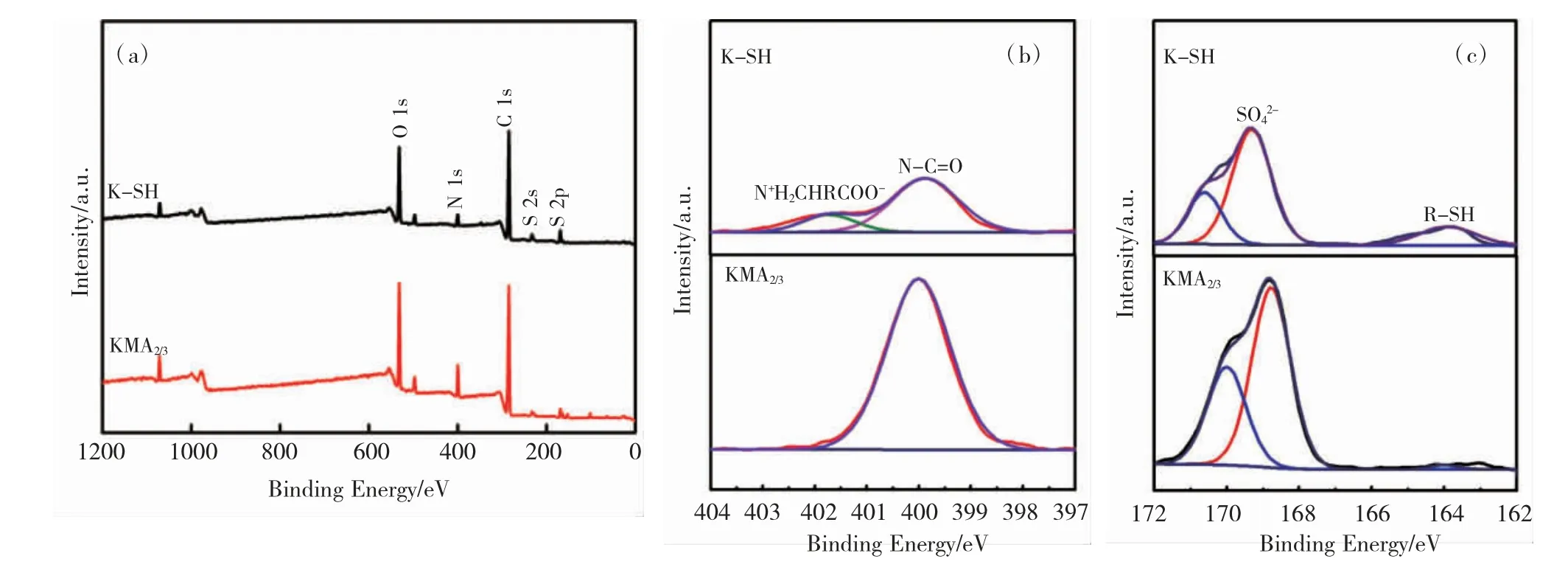
图7 K-SH 与 KMA2/3 的 XPS 全谱图(a);N 的分峰拟合图 (b);S 的分峰拟合图 (c)Fig.7 XPS spectrum of K-SH and KMA2/3 (a);Peak fitting of N (b) and S (c)
2.3 KMA-Gel的反应交联机理分析
通过上述实验分析,K-SH 与 MA 反应形成的化学交联结构如图 8 所示,K-SH 分子链上的氨基可与 MA 发生酰化反应以引入乙烯基,形成改性角蛋白中间体 (KIN)。KIN 结构中的乙烯基与巯基之间产生巯基 - 烯反应形成自交联结构。与此同时,在形成 KIN 的过程中会生成甲基丙烯酸,也可以与KIN 结构中的巯基发生巯基 - 烯反应,从而得到三维网状结构。

图8 K-SH 与 MA 反应交联机理图Fig.8 Diagram of reaction mechanism between K-SH and MA
并且从理论分析的角度上讲,在 K-SH 和 MA的反应体系中,产生的 KIN 和甲基丙烯酸结构中均含有 C=C 双键,也可能会发生自由基聚合反应,但是由于自由基聚合反应需要引发剂引发且会受到氧的抑制作用[26],因此在该成胶条件下可排除 C=C双键的自由基聚合反应。此外,在凝胶化过程中,除了化学交联外,也可能发生物理相互作用,如氢键、疏水键和静电相互作用[16]。
3 结论
基于制革废弃牛毛角蛋白与甲基丙烯酸酐(MA) 开发了一种 KMA-Gel 的制备方法。相比 MA用于改性明胶以引入 C=C 双键,并通过引发剂引发C=C 双 键 的 自 由 基 聚 合 反 应 制 备 的 水 凝 胶 ,KMA-Gel 的制备方法简单,所需的反应条件低,不需引发剂的引发即可生成水凝胶,这取决于两种制备方法的化学交联机理的不同。本文通过测定K-SH 结构中氨基及巯基转化度、FT-IR、1H-NMR和 XPS 对改性角蛋白的分子结构进行表征,推测出甲基丙烯酰化角蛋白水凝胶的 化 学 反应机理为:K-SH 结构中的伯氨基可与 MA 发生酰化反应引入C=C 键,其与角蛋白分子自身结构中的巯基可发生巯基 - 乙烯基反应;同时 MA 改性角蛋白的酰化反应过程中产生的甲基丙烯酸副产物,也可与角蛋白中的巯基发生巯基 - 烯反应,结合角蛋白分子链之间的氢键等其它相互作用,从而得到多重交联的三维网状结构,即生成交联型甲基丙烯酰化角蛋白水凝胶 KMA-Gel。
