木薯2C型蛋白磷酸酶基因MePP2C55的克隆及表达分析
2022-05-13曾坚谢雅倩陈丽萍颜彦胡伟
曾坚 谢雅倩 陈丽萍 颜彦 胡伟






摘要:2C型蛋白磷酸酶(protein phosphatase 2C,PP2C) 基因是ABA信号途径中主要组成部分,为分析其在木薯非生物胁迫和块根采后生理性变质 (post-harvest physiological deterioration,PPD)中的作用,采用RT-PCR技术从木薯叶片(SC124)中克隆得到MePP2C55基因。对MePP2C55基因的理化性质、保守结构域、遗传进化关系、蛋白质结构预测及基因的启动子元件进行了预测和分析,并对MePP2C55基因在不同处理和PPD过程中的表达进行了分析。结果显示:(1)MePP2C55基因全长1 100 bp,编码369个氨基酸残基,蛋白相对分子量40.7 ku,理论等电点为7.57,含有PP2C的家族结构域。蛋白质序列分析显示,MePP2C55与橡胶树和麻风树的PP2C最相似,分别为88.80%和80.60%。MePP2C55和其他PP2C一样,在C-端保守。这些结果均表明,MePP2C55基因属于PP2C家族。(2)MePP2C55基因在不同木薯组织中的表达均较高,在侧芽和叶柄中最高。(3)MePP2C55基因属于ABA核心通路,所以启动子序列分析显示含有10个ABRE (abscisic acid responsiveness) 元件。MePP2C55基因能被PEG和ABA处理显著诱导,且在PPD过程中也能被显著诱导。从上述结果可推测,MePP2C55基因具有提高植物应对非生物胁迫的潜力,同时也参与了PPD过程,为下一步研究该基因在木薯采后和抗逆中的功能提供了线索。
关键词:ABA;MePP2C;非生物胁迫;采后生理性变质;表达分析
中图分类号: S533 文献标志码: A
文章编号:1002-1302(2022)08-0073-06
脱落酸 (abscisic acid,ABA) 是一种非常重要的植物激素,它能够调控植物的生长发育,也是植物应对不同逆境的重要信号因子[1]。ABA信号可以提高植物在高渗、干旱和高盐等逆境中的生存能力。2C类蛋白磷酸酶 (protein phosphatase 2C,PP2C) 是ABA信号通路中重要的组成成分之一。在ABA信号转导过程中,PYR/PYL/RCAR为ABA受体,通过接收上游的信号进行信息传递;SnRK2属于信号通路正调控因子;PP2C属于信号通路负调控因子。从而ABA受体、SnRK2和PP2C共同组成了ABA介导的信号通路[2-4]。PP2C属于蛋白磷酸酶中的PPM类,是一类活性依赖于Mg2+或Mn2+等离子且进化保守的丝氨酸/苏氨酸蛋白磷酸酶[5]。
PP2C是高等植物体内广泛存在的蛋白磷酸酶,在植物中也是一个数量庞大的蛋白家族。它没有调节亚基,是一种单体酶。PP2C蛋白的C-端是保守的催化区域,N-端保守性很弱,能够结合不同的序列,所以PP2C 的功能比较多样化。在植物中,目前总共发现了6 种PP2C磷酸酶,如ABI1、ABI2、ABI3、HAB2、AHG1 和PP2CA/AHG3[6]。到目前为止,水稻中找到90个PP2C基因[7],拟南芥中找到80个,二穗短柄草中找到86个[8]。PP2C 在植物中参与了不同信号途径的转导,在ABA信号转导途径中[9],ABA受体蛋白、SnRK2与PP2C三者结合共同调控相关转录因子、干旱/低温胁迫和植物创伤/种子休眠/萌发等信号转导途径[6]。在小麦中过表达Wcs120(PP2C基因)提高了植株的耐冷性[10]。在拟南芥中,A亚族的PP2C蛋白对ABA 信号转导均具有负调控功能[11-13]。玉米中ZmPP2C基因是干旱和盐胁迫反应中的负调控因子[14]。在水稻中,A亚族的PP2C蛋白成员能够不同程度地响应ABA、低温、高盐等逆境胁迫[15]。
木薯(Manihot esculenta Crantz) 是热带及亚热带地区广泛种植的作物,约有8亿人将木薯作为主粮[16]。木薯主要在我国华南地区种植,种植面积约50万hm2,总产量不低于 100亿kg/年,总产值不低于140亿元/年,是华南地区一种重要的经济作物[17]。木薯的淀粉含量高,具有很好的抗旱和耐贫瘠特性,可作为重要的绿色能源作物[17-19]。但木薯采收后的块根容易出现“采后生理性变质(post-harvest physiological deterioration,PPD)”,因而存储期短,大大限制了木薯塊根的大规模利用[20-22]。目前,关于木薯中PP2C基因家族的研究还很少[23]。因此,对木薯PP2C相关基因进行克隆和相关的表达分析,有利于分析PP2C基因在木薯抗逆过程和PPD过程中的表达调控,为研究其功能有重要意义。本试验通过克隆MePP2C55基因,对其编码蛋白序列进行生物信息学分析,同时对MePP2C55在干旱胁迫、ABA处理和PPD过程中的表达模式进行了分析,为研究MePP2C55基因功能提供参考。
1 材料与方法
1.1 材料
木薯材料为中国热带农业科学院热带生物技术研究所保存的木薯品种SC124 (Manihot esculenta cv. SC124)。样品取自中国热带农业科学院热带生物技术研究所温室大棚,2020年4—10月在中国热带农业科学院热带生物技术研究所完成试验。RNA提取试剂和反转录试剂分别购自天根生化科技(北京)有限公司和Fermentas公司。生工生物工程(上海)股份有限公司合成PCR引物。
1.2 材料处理
木薯种茎切成合适长度 (15 cm左右) 的茎秆小节,每个小节有3~4个芽点,分别种入盆中生长,盆中的土壤为蛭石 ∶营养土=1 ∶1(体积比)。取生长约60 d后生长状况一致的幼苗进行后续的试验处理。使用200 mg/mL PEG-6000模拟干旱,对照植株浇水,分别在0、3、5、7 d后收集相应处理时间植株的叶片(取植株的老叶、第1张完全展开叶和未展开叶混合为1个样品,共5个),叶片样品在液氮速冻后保存于-80 ℃冰箱中;ABA处理浓度为100 μmol/L,分别在0、3、5、7 d收集处理后植株的叶片,叶片样品液氮速冻后置于-80 ℃冰箱中;木薯块根的生长期约为10个月,置于培养箱内进行暗培养 (25 ℃、70%相对湿度),在 0、6、12、48 h收集相应处理时间后的块根,块根液氮速冻后置于 -80 ℃ 冰箱内保存(样品取3个重复)。
1.3 基因克隆
叶片cDNA模板通过反转录叶片RNA获得。根据Phytozome数据库中的木薯同源序列 (Manes.06G158800) 设计引物(P1,5′-ATGAATCAACTCACCGTCATCA-3′;P2,5′-TTAAGAAATGCTGCCAAGTTTA-3′),以叶片cDNA为基因克隆模板进行MePP2C55克隆,扩增产物由生工生物工程(上海)股份有限公司测序进行验证。
1.4 生物信息学分析
BLASTp搜索NCBI中和MePYL12同源的蛋白质序列;理化性质使用ExPASy ProtParam进行计算和预测;蛋白的结构预测使用SWISS-MODEL和SOPMA等在线网站[23];在线网站Plantcare进行基因的启动子元件分析 (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/);保守结构域使用NCBI-CDD在线数据库预测;序列比对采用DNAMAN6;进化树采用NJ法构建;引物设计使用软件Primer 5.0。
1.5 基因的表达分析
上海美吉生物医药科技有限公司完成处理样品的RNA提取和建库,然后通过Illumina GAⅡ (美国Illumina公司) 测序平台进行测序,测序数据处理方法见参考文献[24]。本研究的基因表达水平为FPKM (fragments per kilobase per million mapped reads) 值。
2 结果与分析
2.1 MePP2C55基因的克隆
采用序列比对的方法,在Phytozome数据库中搜索得到1个木薯序列Manes.06G158800,属于PP2C家族。以Manes.06G158800序列进行引物设计并扩增,测序得到1个全长为1 110 bp的片段 (图1),氨基酸总数为369个,将其命名为MePP2C55基因。MePP2C55蛋白预测的分子式为C1 752H2 891N527O552S17,理论等电点为7.57,蛋白相对分子量40.7 ku,不稳定系数为47.0,预测为不稳定蛋白。MePP2C55蛋白的二级预测显示,α-螺旋占38.59%,β-转角占7.07%,延伸链占20.65%,无规则卷曲占33.70%。MePP2C55蛋白的三级结构预测显示与其二级结构预测结果一致(图2)。保守结构的预测分析(图3)显示,MePP2C55蛋白含有PP2C的家族结构域,这些预测结果表明克隆得到的基因属于PP2C家族基因。
2.2 MePP2C55氨基酸序列同源性比对和系统发育分析
以MePP2C55基因的氨基酸序列为探针,在相应数据库 (NCBI) 中进行序列比对,将其中同源性较高的蛋白序列下载下来,其中橡胶树(XP_021656134.1)的序列一致性最高,达到88.80%,其次是达到80.60%的麻风树(XP_012090097.1)。在多重序列比对中发现,PP2C基因的氨基酸序列和其他报道相一致,在C-端保守。保守结构域分析也显示,PP2C蛋白氨基酸序列在进化上高度保守、高度相似,和橡胶树及麻风树的保守元件完全相同(图4)。MePP2C55和HbPP2C、RcPP2C都属于大戟科,这些结果表明,MePP2C55基因属于PP2C家族。
2.3 MePP2C55基因的组织表达分析
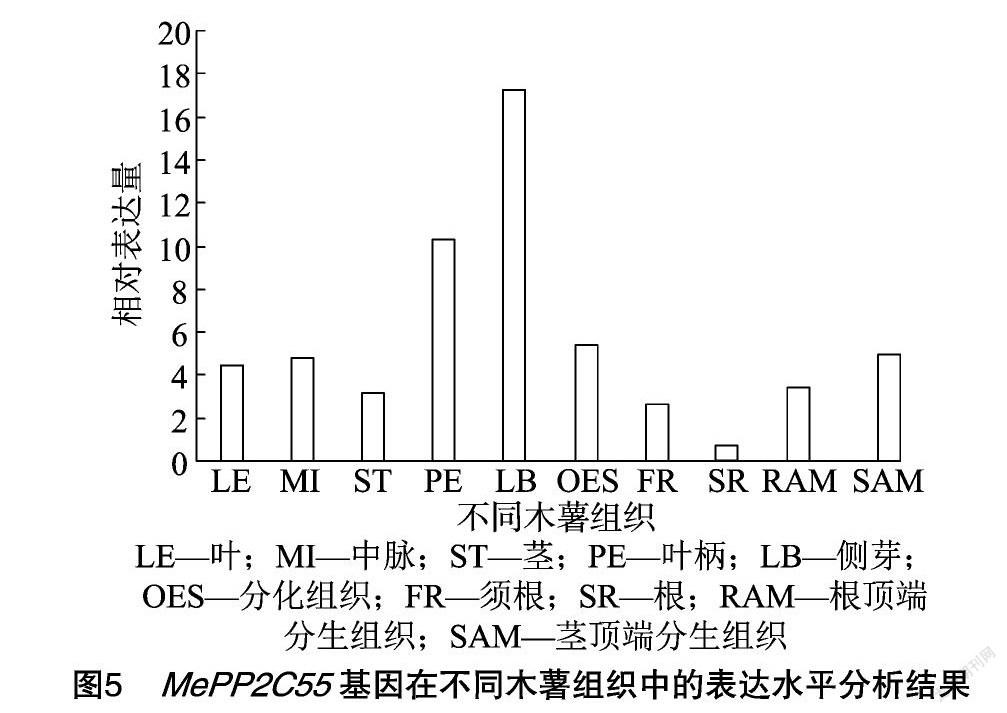
以数据库 (shiny.danforthcenter.org/cassava_atlas/)中的木薯组织表达数据来分析MePP2C55基因的组织表达差异。结果显示,MePP2C55基因在不同组织中的表达都较高,在侧芽和叶柄中的表达最高 (图5)。
2.4 MePP2C55基因在不同处理条件下的表达分析
MePP2C55基因属于ABA信号通路的核心组分,所以启动子序列分析显示含有10个ABRE (abscisic acid responsiveness) 元件。MePP2C55基因都能被PEG和ABA处理显著诱导。MePP2C55基因的相对表达量在ABA处理3 d后达到最高,为不处理时的2.6倍,随后慢慢下降到1.8倍;而在PEG处理中,MePP2C55基因的相对表达量随着处理时间延长而不断增加,在7 d时达到最高,为不处理时的3.5倍 (图6)。
MePP2C55基因的相对表达量也和木薯块根的采后生理性变质过程密切相关。MePP2C55基因的相对表达量随着采后时间增加不断提高,在采后 48 h 达到最大值,总共提高了12.2倍,表明MePP2C55基因的表达在该过程中明显受到诱导 (图7)。
3 讨论与结论
PP2C基因家族的数量在不同的植物物种中并不相同,而PP2C属于ABA信号途径的核心组成,因此研究PP2C的功能有助于阐述ABA信号通路。本研究克隆得到木薯MePP2C55基因, 氨基酸残基总数为369个,具有PP2C的家族结构域(图4),序列比对分析显示,包含和其他PP2C基因类似的保守C末端催化结构域,它属于A类PP2C[25]。在亲缘关系上MePP2C55与橡胶树HbPP2C和及麻风树JcPP2C较近。这些结果都证明MePP2C55基因属于PP2C家族基因。
木薯是一种在热带被广泛种植的粮食和经济作物,具有粗生易长等特点[26]。在木薯的生产实践中由于木薯块根在收获后极易出现PPD现象,从而导致其在工业生产中受到大大的限制[20-22]。在果实的成熟和采后存储过程中,ABA信号具有非常重要的作用,有研究表明ABA信号的传递对果实最终的存储品质和相应的采后相关生理指标具有显著影响[27]。ABA信号途径也是植物响应非生物逆境的重要信号通路,PP2C是核心的组成成分[28]。模式植物拟南芥中鉴定得到的A类PP2C基因都能对ABA信号进行负调控,其中多个基因和氧化胁迫相关,此外AHG3还参与抗冷胁迫[11-13]。在小麦中分离得到的PP2C基因Wcs120也能够提高小麦的抗寒能力[10]。苜蓿中的PP2C受到逆境胁迫的诱导[29]。冰叶日中花克隆得到的10个PP2C 类基因都响应非生物逆境的胁迫[30]。玉米PP2C 基因在高盐和干旱胁迫中属于负调控因子[14],而山毛榉(Fagus longipetiolata Seem.)中的PP2C2则属于正调控因子[31]。A类PP2C基因在重要作物水稻中都可以在对非生物逆境如高盐、干旱和低温等逆境有不同的响应程度[15]。木薯经过干旱和ABA处理后,MePP2C55基因的表达明显受到诱导,在拟南芥中A类PP2C家族基因通常屬于非生物逆境胁迫和ABA信号途径的负调控因子,但FsPP2C2基因的超表达能够提高植株耐受逆境胁迫的能力和对ABA信号的敏感性[31],同时AtPP2CG1基因的超表达也能够提高植株对高盐的耐受及对ABA信号的敏感性[32]。因此,MePP2C55基因可能是木薯响应非生物胁迫和ABA信号的正调控因子。在PPD过程中MePP2C55基因的表达也显著受到诱导。例如,在拟南芥中超表达PdPP2C基因能够提高植株的对氧化胁迫的能力[33]。在烟草中超表达ZmPP2C2基因能够提高植株中抗氧化酶的活性[34]。OsBiPP2C1也和细胞中的抗氧化酶活性密切相关[35]。由此推测,MePP2C55基因参与了木薯PPD的抗氧化过程。以上结果为下一步研究MePP2C55基因在延缓木薯PPD过程和提高非生物胁迫中的适应能力提供了参考。
參考文献:
[1]Raghavendra A S,Gonugunta V K,Christmann A,et al. ABA perception and signalling[J]. Trends in Plant Science,2010,15(7):395-401.
[2]Krasensky J,Jonak C.Drought,salt,and temperature stress-induced metabolic rearrangements and regulatory networks[J]. Journal of Experimental Botany,2012,63(4):1593-1608.
[3]Park S Y,Fung P,Nishimura N,et al. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J]. Science,2009,324(5930):1068-1071.
[4]Ma Y E,Szostkiewicz I,Korte A,et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J]. Science,2009,324(5930):1064-1068.
[5]Fuchs S,Grill E,Meskiene I,et al. Type 2C protein phosphatases in plants[J]. The FEBS Journal,2013,280(2):681-693.
[6]张继红,陶能国. 植物PP2C蛋白磷酸酶ABA信号转导及逆境胁迫调控机制研究进展[J]. 广西植物,2015,35(6):935-941.
[7]Xue T T,Wang D,Zhang S Z,et al. Genome-wide and expression analysis of protein phosphatase 2C in rice and Arabidopsis[J]. BMC Genomics,2008,9:550.
[8]Cao J M,Jiang M,Li P,et al. Genome-wide identification and evolutionary analyses of the PP2C gene family with their expression profiling in response to multiple stresses in Brachypodium distachyon[J]. BMC Genomics,2016,17:175.
[9]Komatsu K,Nishikawa Y,Ohtsuka T,et al. Functional analyses of the ABI1-related protein phosphatase type 2C reveal evolutionarily conserved regulation of abscisic acid signaling between Arabidopsis and the moss Physcomitrella patens[J]. Plant Molecular Biology,2009,70(3):327-340.
[10]Mishra G,Zhang W H,Deng F,et al. A bifurcating pathway directs abscisic acid effects on stomatal closure and opening in Arabidopsis[J]. Science,2006,312(5771):264-266.
[11]Meyer K,Leube M P,Grill E.A protein phosphatase 2C involved in ABA signal transduction in Arabidopsis thaliana[J]. Science,1994,264(5164):1452-1455.
[12]Saez A,Apostolova N,Gonzalez-Guzman M,et al. Gain-of-function and loss-of-function phenotypes of the protein phosphatase 2C HAB1 reveal its role as a negative regulator of abscisic acid signalling[J]. The Plant Journal,2004,37(3):354-369.
[13]Nishimura N,Yoshida T,Kitahata N,et al. ABA-hypersensitive germination1 encodes a protein phosphatase 2C,an essential component of abscisic acid signaling in Arabidopsis seed[J]. The Plant Journal,2007,50(6):935-949.
[14]Liu L X,Hu X L,Song J A,et al. Over-expression of a Zea mays L. protein phosphatase 2C gene (ZmPP2C) in Arabidopsis thaliana decreases tolerance to salt and drought[J]. Journal of Plant Physiology,2009,166(5):531-542.
[15]Singh A,Giri J,Kapoor S,et al. Protein phosphatase complement in rice:genome-wide identification and transcriptional analysis under abiotic stress conditions and reproductive development[J]. BMC Genomics,2010,11:435.
[16]Liu S,Zainuddin I M,Vanderschuren H,et al. RNAi inhibition of feruloyl CoA 6′-hydroxylase reduces scopoletin biosynthesis and post-harvest physiological deterioration in cassava (Manihot esculenta Crantz) storage roots[J]. Plant Molecular Biology,2017,94(1/2):185-195.
[17]张 鹏,杨 俊,周文智,等. 能源木薯高淀粉抗逆分子育种研究进展与展望[J]. 生命科学,2014,26(5):465-473.
[18]Hu W,Kong H,Guo Y L,et al. Comparative physiological and transcriptomic analyses reveal the actions of melatonin in the delay of postharvest physiological deterioration of cassava[J]. Frontiers in Plant Science,2016,7:736.
[19]颜 彦,铁韦韦,丁泽红,等. 木薯MePYL8基因克隆及表达分析[J]. 分子植物育種,2018,16(14):4498-4504.
[20]Xu J,Duan X G,Yang J,et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiology,2013,161(3):1517-1528.
[21]Zidenga T,Leyva-Guerrero E,Moon H,et al. Extending cassava root shelf life via reduction of reactive oxygen species production[J]. Plant Physiology,2012,159(4):1396-1407.
[22]张振文,李开绵. 木薯块根采后腐烂及贮藏方法研究进展[J]. 热带作物学报,2012,33(7):1326-1331.
[23]Zhao H,Wu C L,Yan Y,et al. Genomic analysis of the core components of ABA signaling reveals their possible role in abiotic stress response in cassava[J]. Environmental and Experimental Botany,2019,167:103855.
[24]曾 坚,廖凤凤,吴春来,等. 木薯MeHSF7基因克隆及表达分析[J]. 南方农业学报,2020,51(6):1256-1264.
[25]Li W Q,Wang L,Sheng X L,et al. Molecular basis for the selective and ABA-independent inhibition of PP2CA by PYL13[J]. Cell Research,2013,23(12):1369-1379.
[26]罗兴录,吴美艳,陶 林. 木薯不同时期施钾对淀粉合成关键酶活性和淀粉积累的影响[J]. 江苏农业科学,2020,48(16):115-119.
[27]杨方威,段懿菲,冯叙桥.脱落酸的生物合成及对水果成熟的调控研究进展[J]. 食品科学,2016,37(3):266-272.
[28]Schweighofer A,Hirt H,Meskiene I. Plant PP2C phosphatases:emerging functions in stress signaling[J]. Trends in Plant Science,2004,9(5):236-243.
[29]Millward T A,Zolnierowicz S,Hemmings B A.Regulation of protein kinase cascades by protein phosphatase 2A[J]. Trends in Biochemical Sciences,1999,24(5):186-191.
[30]Miyazaki S,Koga R,Bohnert H J,et al. Tissue-and environmental response-specific expression of 10 PP2C transcripts in Mesembryanthemum crystallinum[J]. Molecular & General Genetics,1999,261(2):307-316.
[31]Reyes D,Rodríguez D,González-García M P,et al. Overexpression of a protein phosphatase 2C from beech seeds in Arabidopsis shows phenotypes related to abscisic acid responses and gibberellin biosynthesis[J]. Plant Physiology,2006,141(4):1414-1424.
[32]叶兴国. 新模式植物短柄草模式特性研究进展[J]. 作物学报,2008,34(6):919-925.
[33]郭 鹏,张士刚,邢 鑫,等. 欧美杨PdPP2C基因的克隆与功能分析[J]. 北京林业大学学报,2015,37(2):100-106.
[34]萧蓓蕾,李冬梅,刘丽霞. 水分胁迫对转ZmPP2C2基因烟草膜脂过氧化及抗氧化酶活性的影响[J]. 河南农业科学,2010,39(11):36-39.
[35]倪 岚. OsBiPP2C1和OsDMI3调节ABA诱导的抗氧化防护的机制研究. [D]. 南京:南京农业大学,2014.
