纳米材料对水环境中微藻毒性的效应及机理研究进展
2022-05-12杨黎彬周雪飞
陈 灿,杨黎彬,周雪飞
(同济大学环境科学与工程学院,上海 200092)
纳米材料是粒径在1~100 nm的材料,主要包括金属及金属氧化物纳米材料、碳纳米材料以及量子点(quantum dots,QDs)[1]。目前,常见的纳米材料包括Ag NPs(纳米粒子)、碳纳米管、TiO2NPs、ZnO NPs等[2-3]。纳米材料具有大的比表面积、较好的导热导电特性、良好的光学特性等优点[4-5],在材料、信息、医药、能源等众多领域得到广泛应用[6-7]。纳米材料在生产和使用过程中,不可避免会进入到水环境中,已经在众多国家水环境中检测到了纳米材料,如表1所示。纳米材料会吸附到微藻表面,被水生生物(如斑马鱼和水蚤)食入后会引起纳米材料在生物链的富集,对不同类型的水生生物产生危害,最终可能进入人体,危害到肺、肝脏、肾脏、心脏、大脑、骨骼和软组织[3,8-9],对生态系统以及人体健康造成巨大威胁。因此,在纳米材料大规模使用前,应考虑纳米材料对水生生物的毒性并及时评估纳米材料对水环境生态风险的潜在毒性[10-11]。
微藻是水环境生态系统中的初级生产者,是水生生态系统不可缺少的组成部分。先前采用海胆、鱼类、螃蟹等水生生物检测微塑料的毒性,但这些水生生物存在摄食微塑料的过程,不能很好观察微塑料的作用,因此,微藻成为重点研究对象,微藻易培养、生长周期短、对环境变化敏感,常作为研究污染物影响的模型生物[12]。相关研究将微藻作为指示性生物,评估奥利克林、二甲基二十八烷基铵等个人护理产品对长三角地区地表水的环境风险,结果表明目标污染物的危险商数均大于1,将对长三角地区的鱼类构成高风险危害[13]。Yang等[14]评估聚苯乙烯纳米塑料对小球藻毒性的影响,研究发现在纳米塑料的作用下抑制了小球藻生长和光合作用,其对生长作用抑制率达到27.73%,对光合作用的抑制率达到35.04%,为纳米塑料对水生生物毒性的评估提供了依据。由于这一特性,微藻也常作为评价纳米材料生态毒性的生物模型。近年来,国内外学者进行纳米材料对微藻影响的研究[15],微藻是水环境食物链中的初级生产者,纳米材料对微藻产生的任何不利影响都会对整个水生食物网产生严重影响,因此,确定纳米材料在微藻中的毒性作用以及毒性机制至关重要。本文在已有研究的基础上,针对微藻生长、胞内组分、胞外多聚物、细胞结构综述了纳米材料对微藻的毒性效应,并在此基础上归纳了纳米材料对微藻的毒性机理,为今后开展纳米材料对微藻毒害机制的深入研究提供依据。

表1 纳米材料分布情况Tab.1 Distribution of Nanomaterials
1 纳米材料对微藻的毒性效应
常用作毒性影响模型生物的微藻有小球藻、栅藻、鱼腥腥藻、杜氏盐藻、羊角月牙藻(Raphidocelissubcapitata)等。已有研究通常以微藻生物量定量描述纳米材料对微藻的生长抑制,此外还表现在微藻胞内胞外组分的变化等方面。
1.1 微藻生长
大量研究表明,纳米材料对微藻生长有抑制作用,会降低微藻的生长速率和生物量。纳米材料毒性的大小取决于其尺寸、形状、化学成分、电荷和氧化状态、表面结构以及聚集状态等[24]。Zhang等[25]研究在48 h后纳米金刚石对小球藻生长的影响,发现在设定的质量浓度(5~50 mg/L),纳米金刚石显著抑制了小球藻的生长,且随着浓度的增大,抑制作用越大,5 mg/L时对小球藻的生长抑制率是33.1%;50 mg/L时抑制率高达75.4%。Chen等[26]研究Co NPs对肋骨条藻的毒性,发现Co NPs对微藻毒性随着时间积累,在24 h时50 mg/L的Co NPs对肋骨条藻的生长抑制仅为23.9%,而在作用96 h后,抑制率达到73.6%。此外,研究中也常用半最大效应浓度(EC50)定量评价纳米材料对微藻生长的毒性效应。Sendra等[27]在TiO2NPs对微藻的急性毒性效应试验中得出,TiO2NPs对三角褐指藻、莱茵衣藻的EC50分别为552、132 mg/L。而Natalí等[28]的研究则表明Ag NPs对小球藻的EC50达到0.1 mg/L。纳米材料对微藻的抑制作用的大小变化较大,取决于纳米材料的种类。Kyung等[29]研究5种金属氧化物纳米材料对小球藻的生长抑制作用,发现其中ZnO NPs对微藻的生长抑制作用最大,Fe2O3NPs的抑制程度最小,EC50分别为2.0、76 mg/L,对微藻生长抑制毒性顺序为ZnO NPs>NiO NPs>CuO NPs>TiO2NPs >Fe2O3NPs。表2总结不同类型的纳米材料对常见微藻的生长抑制作用。不同种类的纳米材料对同种微藻的抑制作用不同,同一种类的纳米材料对不同种类的微藻也有较大区别,并且毒性作用随着接触时间的增强而加大。
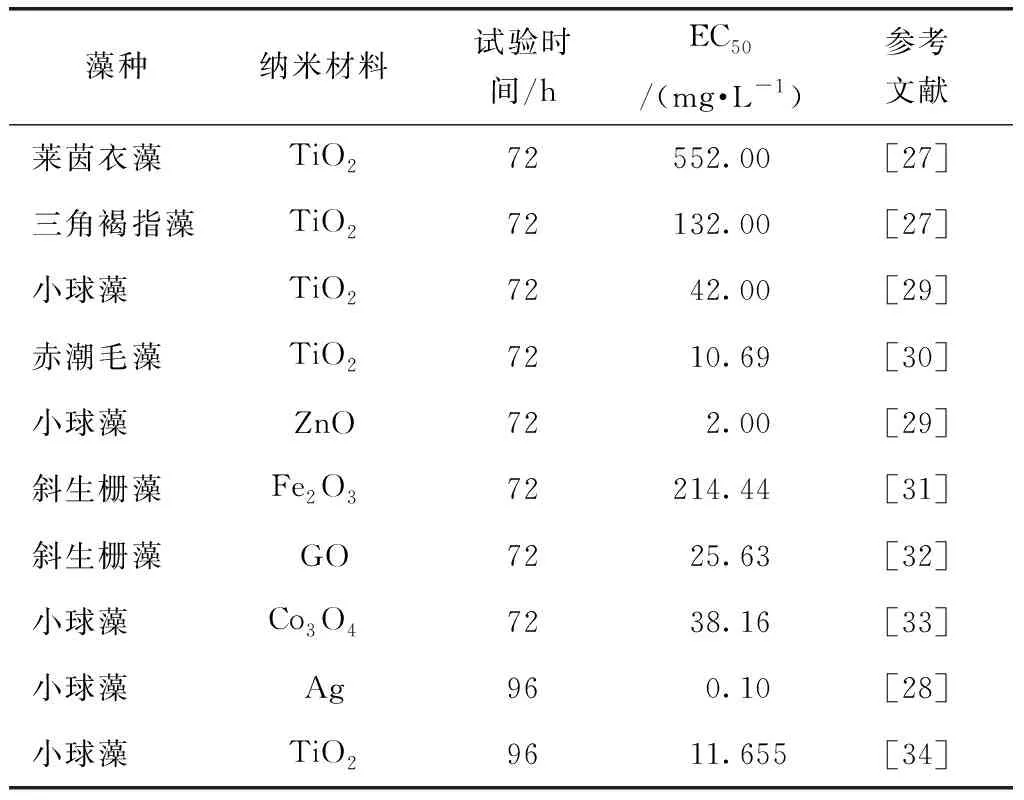
表2 纳米材料对微藻生长抑制作用Tab.2 Inhibition Effect of Nanomaterials on Microalgae Growth
1.2 微藻生化组分
微藻的生化组分为碳水化合物、蛋白质和油脂,试验研究表明,在外界环境如pH、温度、营养元素等作用压力条件下,微藻生化组分会发生改变[28,35]。纳米材料会促进微藻吸收营养物质,使得微藻在营养缺乏状态下积累油脂。Zhang等[36]研究发现与对照组相比,存在QDs条件下(含量为10 mg/L),脂质含量提高了20%。Kim等[37]研究MgAC NPs对小球藻脂质产率的影响,发现暴露于0.05 mg/L的MgAC NPs下,小球藻脂质生产率较对照组提高了25%。此外,Sarma等[38]发现在1 g/L的MgSO4NPs作用下,小球藻脂质显著提升,较对照组提高了118.23%±5.67%。Ren等[39]研究不同纳米材料对栅藻脂质积累的影响,试验表明SiC NPs和g-C3N4NPs促使脂质分别提高了32.07%和28.83%,TiO2NPs和TiC NPs对脂质积累无显著影响。因此,研究表明微藻细胞内脂质的积累与纳米材料的种类和浓度有关。细胞内油脂累积时,饱和脂肪酸和单不饱和脂肪酸的含量会增加,与极性膜脂质相关的长链多不饱和脂肪酸含量降低,从而阻碍微藻细胞生长[40]。碳水化合物是藻类资源化利用产物之一,同时可为藻类生长提供能量。碳水化合物含量增加是一种细胞应激反应现象,提高呼吸速率从而更好地供能[41-42]。Natalí等[28]研究Ag NPs对小球藻的影响,发现Ag NPs含量在360、720、1 440 μg/L下,小球藻碳水化合物含量分别提高了22%、29%、80%。Marchello等[41]发现小球藻胞内碳水化合物含量随着TiO2NPs含量增加而升高,当TiO2NPs含量为7.9 mg/L时,碳水化合物含量提高了1.4倍。蛋白质是微藻重要的营养物质和渗透调节物质,对微藻生命活动起到了保护作用,也是在不利环境中重要的评价指标。Natalí等[28]研究了低浓度Ag NPs(含量<1.5 mg/L)对小球藻蛋白含量的影响,Ag NPs在含量为90~720 μg/L下,相较于对照组,蛋白质含量提升110%~293%;当Ag NPs含量为1 440 μg/L时,蛋白含量增加最多,达到了583%。而过高浓度的纳米材料会导致活性氧(ROS)过量产生使微藻抗氧化酶系统受损,使得蛋白质含量降低。Pallavi等[43]研究发现在高质量浓度纳米氧化铁(50 mg/L)作用下,Coelastrellaterrestris的蛋白含量显著下降。在纳米材料作用下,微藻的蛋白质产量降低,并通过积累油脂、碳水化合物抵御纳米材料的胁迫。由于纳米材料具有体积小、比表面积大的特性,可以进入微藻细胞,影响微藻细胞分裂和转录机制,或者通过诱发氧化应激对DNA产生损伤。Kang等[44]通过代谢组学和转录组学研究氧化石墨烯量子点(GOQDs)对小球藻接触和恢复的2个阶段影响,在接触GOQDs溶液后,用培养基继续培养小球藻,检测到在恢复阶段氨酰-tRNA下调,表明对微藻造成的遗传毒性是不可逆的。Schiavo等[45]发现SiO2NPs和TiO2NPs对杜氏盐藻的遗传毒性存在不同机制,前者是通过氧化应激产生ROS,继而诱发DNA损伤,而后者直接与DNA作用,同时发生细胞分裂。也有相关研究表明氧化石墨烯抑制微藻细胞分裂,可能与其二氧化硅表面涂层有关[46]。
1.3 微藻胞外多聚物
微藻胞外聚合物(extracellular polymeric substances,EPS)是微藻分泌到胞外的复杂多样的高分子聚合物,结构紧密多孔,主要由多糖、蛋白质、腐植酸等构成[47]。EPS不仅可以起到附着作用,而且可以协助微藻抵抗外界环境压力,例如盐胁迫、温度异常、重金属污染等,微藻分泌EPS是对恶劣环境的响应[48-49]。在纳米材料作用下,微藻EPS分泌量会发生变化。Zhao等[50]研究纳米CuO对小球藻EPS的影响,通过透射电镜观察到其EPS层增厚了近4倍。也有研究定量描述纳米材料对微藻EPS产量的影响。据Sendra等[27]报道,暴露在TiO2NPs含量为10 mg/L下,莱茵衣藻的EPS产量为(23.0±1.2)×10-5mg/mL,相较于对照组,试验组的EPS分泌量增加了2.15倍。EPS组成变化也常作为纳米材料对微藻毒性效应研究。EPS中的高分子有机物会促进纳米材料的絮凝,研究报道纳米材料会促使微藻EPS中高分子量有机物转化为低分子量有机物,从而减少微藻与纳米材料相互接触[51]。在纳米材料作用下,EPS主要组分也会发生变化。Gao等[52]试验结果表明:96 h暴露试验后,TiO2NPs(含量为20 mg/L)小球藻EPS分泌量提高了26.3%,其中,多糖含量和蛋白质含量分别增加了12%和40.7%,而且多糖与蛋白质的比值显著低于空白组,表明TiO2NPs会诱导微藻分泌更多的胞外蛋白。通过FTIR光谱发现微藻EPS含有丰富的官能团,如酰基、羟基等,富含这些络合基团的胞外蛋白可以形成蛋白质电晕效应,从而更好地与纳米材料结合[49,53]。就此推测EPS一方面通过静电斥力维持纳米材料在水环境中的稳定,另一方面通过化学键与纳米材料结合,从而抑制纳米材料细胞内化。因此,微藻会通过提高EPS分泌量特别是胞外蛋白含量,以减轻纳米材料的毒性[54]。
2 纳米材料对微藻的毒性机理
纳米材料种类多样,对微藻的毒性机理较为复杂。如图1所示,目前提出的毒性机理可概括为遮蔽效应、机械损伤、氧化应激[53]。

图1 纳米材料对微藻的毒性机理[3,50,53]Fig.1 Toxicity Mechanism of Nanomaterials on Microalgae[3,50,53]
2.1 遮蔽效应
由于pH、天然有机质以及溶解盐的作用,纳米材料在水环境中难以稳定存在,容易团聚引起遮蔽效应。遮蔽效应是通过降低微藻的光捕获率,影响其光合作用,对微藻生长产生影响[15]。纳米材料会在微藻细胞表面发生团聚,引起遮蔽效应。Cheloni等[55]测量CuO NPs与莱茵衣藻混合液吸光度的变化,在纳米氧化铜含量较低(8 μg/L、0.8 mg/L)时,OD750(750 nm 处吸光度)无明显变化(空白组与2个试验组分别为0.115、0.118、0.117);当含量达到4 mg/L时,OD750升至0.148,表明微藻生长抑制与遮蔽效应之间存在相关性。Chen等[26]通过SEM发现Co NPs会在中肋骨条藻(Skeletonemacostatum)表面聚集,试验96 h后叶绿素含量降低了47.3%,表明纳米材料通过影响微藻的光合作用抑制其生长。Nogueira等[56]研究也出现类似的现象,发现氧化石墨烯也会在培养基中聚集引起遮蔽效应,当氧化石墨烯含量达到100 μg/mL,Raphidocelissubcapitata的叶绿素荧光强度百分比下降,降至82%。然而也有研究认为纳米材料的遮蔽效应不会显著影响微藻的生长。如Melegari等[57]研究发现,在72 h的CuO NPs接触试验中,CuO NPs的遮蔽效应并不是抑制莱茵衣藻生长的重要致毒机理。遮蔽效应主要是纳米材料由于自身表面化学性质发生团聚引起的,若增强纳米材料在水中的稳定性,则可以一定程度上减轻遮蔽效应的毒性。Pasquini等[58]发现表面功能化的高纯度碳纳米管(SWCNT)在水中的分散度更高,与普通SWCNT相比,降低了对Escherichiacoli的生态毒性,证明了这一猜想。
2.2 机械损伤
纳米材料尺寸微小,可以吸附于微藻细胞表面,甚至穿过细胞壁和细胞膜进入细胞内,对微藻细胞造成机械损伤。具体表现形式有细胞壁损伤、细胞膜损伤、改变细胞膜通透性、破坏细胞超微结构。纳米材料内化是一个复杂的过程,会涉及与微藻细胞膜和细胞壁之间的作用。首先,纳米材料接触微藻的细胞壁,其锋利的边缘会对微藻的细胞壁造成物理损伤。Du等[59]研究发现氧化石墨烯会刺穿栅藻的细胞壁。随后,纳米材料可以通过内吞作用、载体蛋白或者离子通道通过细胞膜,破坏了细胞膜的双层结构甚至引起膜穿孔[40,53]。Rai等[60]研究发现Ag NPs会吸附在微藻细胞表面改变细胞膜的通透性,增大细胞孔隙率,破坏细胞膜磷脂结构,挤压质子泵。Sendra等[27]研究了TiO2NPs[(38±12)nm]和TiO2[(423±154)nm]对莱茵衣藻和三角褐指藻的影响,发现TiO2NPs对2种微藻造成的毒性更大,这是因为TiO2NPs可以与微藻细胞表面相互作用,对细胞膜产生损伤。通过细胞壁、细胞膜后,纳米材料会进入微藻细胞内,破坏细胞内部结构,造成了细胞损伤[46,61]。Du等[59]研究了TiO2NPs对小球藻的毒性,发现TiO2NPs含量超过1 mg/L时,小球藻细胞出现了质壁分离的现象,且质壁分离程度随着TiO2NPs含量的增加而增加,当含量增至10 mg/L时,观察到小球藻细胞出现膜损伤;当含量达到20 mg/L时,出现细胞壁损伤以及内化现象,叶绿体结构被破坏,类囊体膜模糊。由此可见,纳米材料由于其较为尖锐的边缘,与微藻细胞相互作用后,不仅会造成细胞表面机械损伤,甚至会破坏细胞内部结构,上述过程为主要的毒性机制。
2.3 氧化应激
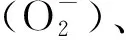

注:ASA为抗坏血酸;APX为抗坏血酸过氧化酶;DHA为脱氢抗坏血酸;GSH为谷胱甘肽;GR为谷胱甘肽还原酶;GSSG为氧化型谷胱甘肽;MDHA为单脱氢抗坏血酸;NADP+为烟酰胺腺嘌呤二核苷磷酸;NADPH为还原型烟酰胺腺嘌呤二核苷酸磷酸;DHAR为脱氢抗坏血酸还原酶图2 纳米材料对微藻的氧化应激机理[62-65]Fig.2 Mechanism of Nanomaterials on Oxidative Stress of Microalgae[62-65]
3 纳米材料与其他物质的复合毒性
自然环境中,微生物会受到多种污染物的影响。2种或多种污染物可能会产生协同作用或者拮抗作用,这主要取决于污染物的类型、浓度等因素。在生态系统中,NPs和其他可溶性物质之间可能存在复杂的相互作用,致使其毒性作用发生变化。纳米材料具有抗菌作用,会与抗生素的作用机制产生交叉作用,这一特性可能会对抗生素的耐药性产生影响。研究表明,在加入Ag NPs后,四环素的毒性增加了3.46倍[66],与之相似,用斑马鱼研究聚山梨酯20与Au NPs的协同毒性,与单独纳米材料相比,斑马鱼对复合材料的摄取率及毒性增加[67]。
虽然人们广泛研究游离金属离子对各种生物的生理效应,但关于溶解离子和NPs对藻类生理过程的联合效应的研究却很少。纳米材料的存在可能会改变金属离子对微藻的毒性。研究表明在TiO2NPs存在下,Zn2+对鱼腥藻的毒性增强[68],氧化石墨烯会增加Cd2+的毒性[69]。然而TiO2NPs的存在会降低Cd2+的毒性[70]。同时,对多种纳米材料共同作用的风险评估也必不可少。然而,在多种纳米材料暴露中,每个NPs对微藻毒性贡献较难区分。比如,与两两混合相比,TiO2NPs、SiO2NPs和ZrO2NPs三者的共同作用会对栅藻产生更强烈的氧化损伤,协同破坏线粒体膜功能,刺激脂质过氧化和抗氧化酶(SOD、CAT)的活性,而在相同浓度下,单个纳米材料不会抑制栅藻的光合作用[71]。纳米复合材料的主要毒性机制主要是纳米复合材料通过增加纳米空间位阻、稳定性,进一步加大与微藻的接触,从而加强纳米材料的毒性。这些研究现象表明纳米材料会对复合毒性产生影响,许多学者研究报道纳米材料的影响,但是对于复合污染物的相关研究还较少,因此,相关的机制需要进一步深入研究。
4 结语
纳米材料作为一种新兴污染物,已经受到广泛的关注。虽然纳米材料对微藻的毒性作用研究有一定的进展,但是纳米材料对微藻的作用效果及生态风险尚未准确判定。本文结合现有的研究,探讨纳米材料对微藻的毒性作用并总结毒性机理,为今后深入探究纳米材料对微藻的影响提供依据,这对于维持微藻生长以及水环境中的食物链稳定有着重要的作用。此外,基于目前的研究,在此对今后的工作进行展望。
(1)目前,纳米材料与污染物对微藻的复合毒性研究较少,多数是单一毒性试验,而实际情况中多是污染物协同对微藻产生毒性效应,因此,需要研究纳米材料与其他污染物联合对微藻的毒性效应,从而能更准确地评价在实际环境中纳米材料对微藻的毒性效应。
(2)纳米材料的剂量、尺寸、种类对不同种类的微藻影响相差较大。不少研究集中关注在纳米材料对微藻的毒性抑制方面,目前不少研究表明低浓度的纳米材料对微藻生长有促进作用,比如可以促进微藻生物质能源的积累,提高光合固碳效率,在微藻培养过程中投加纳米材料促进微藻生长以及生化组分的积累是一种可行的方法。接下来的研究可围绕纳米材料对微藻的促进作用机制展开,更加全面了解纳米材料对微藻的影响,利用纳米材料促进有益微藻生长或抑制有害微藻生长,为今后研究拓展新的途径。
(3)大多数研究关注的是纳米材料对微藻的作用,而没有关注微藻以及水环境因素对纳米材料的影响。在水环境中,微藻与纳米材料是相互作用的,今后可以研究微藻和环境因素对纳米材料的影响,使微藻与纳米材料相互作用机制更系统、全面。
