基于网络药理学探究补骨脂诱导的肝细胞线粒体损伤机制
2022-05-12肖星雨于英莉
王 姗,肖 莹,张 弋,肖星雨,于英莉,3,4
(1.天津市第一中心医院药学部南开大学医学院,天津 300192;2.天津中医药大学中医药研究院,天津 301617;3.组分中药国家重点实验室,天津 301617;4.天津中医药大学方剂学教育部重点实验室,天津 301617)
补骨脂来源于豆科类植物补骨脂(PsoraleacorylifoliaL.)的干燥成熟果实,其性味辛苦温,归肾、脾经,具温肾助阳、纳气平喘、温脾止泻之功效。补骨脂是临床常用中药,中成药复方二神丸、四神丸、加味青娥丸等均以补骨脂入药。临床数据表明长期大量服用补骨脂会产生肝毒性。据报道,有患者在服用含有补骨脂的白蚀丸后出现全身色素脱失斑,血清ALT(alanine transaminase,谷丙转氨酶)、AST(aspartate aminotransferase,谷草转氨酶)水平升高。ALT、AST水平是肝损伤的重要生化指标,表明白蚀丸可以导致肝毒性[1-2]。吴豪等[3]利用斑马鱼动物模型研究补骨脂水提物和醇提物所致肝毒性,结果发现两种补骨脂提取物处理斑马鱼成鱼后,动物肝脏均发生了脂变,斑马成鱼肝脏中固醇调节元件结合蛋白-1c(SREBP-1c)、脂肪酸合成酶(FAS)和乙酰辅酶A羧化酶(ACC1)的mRNA表达水平显著升高,而微粒体三酰甘油转移蛋白(MTP)mRNA表达水平显著降低。SREBP-1c是激活肝脏脂肪合成酶的重要转录因子,ACC1和FAS是肝脏脂质合成的重要酶,补骨脂诱导上述蛋白上调可以促进肝脏脂变。另外,使用尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1)的特异性荧光探针N-(3-羧基丙基)-4-羟基-1,8萘酰亚胺(NCHN)研究补骨脂提取物及其成分对UGT1A1活性的影响,发现补骨脂的醇提取物对UGT1A1活性具有较强的抑制作用,并且呈现剂量依赖性。UGT1A1是消除胆红素的关键酶,补骨脂通过抑制UGT1A1的活性使胆红素的浓度升高,进一步导致高胆红素血症和急性肝损伤[4]。这些临床数据和实验数据表明,补骨脂可以导致人或动物发生肝损伤,但补骨脂诱导肝细胞损伤的机制还有待进一步研究,本实验通过网络药理学研究补骨脂导致肝损伤的机制,为补骨脂临床用药安全提供参考。
1 材料与方法
1.1 数据的获取
补骨脂的活性成分从中医药系统药理学数据库分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)获取。活性成分的化学物质登录号(CAS号)从化源网(https://www.chemsrc.com/)获取。药物动力学(absorption,distribution,me-tabolism and elimination,ADME)筛选标准为:口服生物学吸收性(oral bioavailability,OB)≥30%,类药性(drug-like,DL)≥0.14。利 用Drug Bank数 据 库(http://www.drugbank.ca/)查找线粒体损伤疾病(MD)的相关靶点和活性化学成分的靶点,利用DAVID数据库(https://david.ncifcrf.gov/)进行靶点的KEGG通路和GO功能分析。
1.2 分析补骨脂预测靶点与线粒体损伤疾病靶点相互作用
利用String网站建立补骨脂活性成分预测靶点的相互作用网络(PPI),利用DAVID数据库对节点进行GO富集及KEGG通路分析。采用韦恩分析补骨脂活性成分,预测靶点、线粒体疾病靶点的相关性。
2 结果
2.1 补骨脂有效物质及作用靶点的网络构建
利用ADME筛选条件从TCMSP数据库进行筛选,发现补骨脂所含有的117个化合物中没有符合条件的物质。但是,通过文献检索发现其中的9种物质具有药理作用,因OB值与DL值小于筛选条件而被系统删除,考虑其潜在意义,故将这9个化合物纳入研究范围。结果见表1。
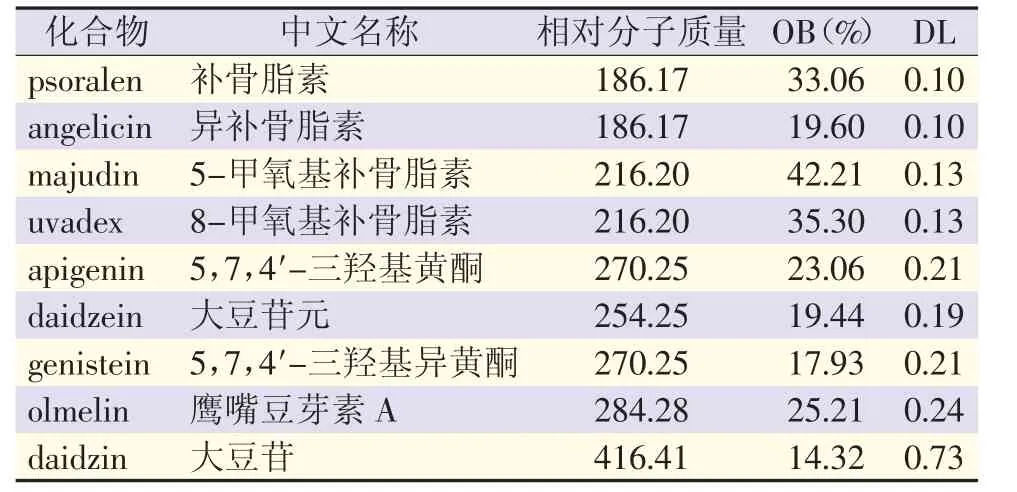
表1 补骨脂中9个有效活性化合物
同时,利用TCMSP数据库获取9个活性成分可能的药理活性靶点共58个,包括细胞色素P4501A1(CYP1A1)、雄激素受体(AR)、钙调蛋白(CALM1)、细胞色素P450 19A1(CYP19A1)、一氧化氮合酶(NOS)、葡萄糖激酶(GCK)、醛脱氢酶(ALDH2)、胺氧化酶(MAOA)等。结果见表2。

表2 TCMSP数据库预测的分子靶点
将所获得的有效活性化合物的58个预测蛋白靶点利用String网站建立补骨脂活性成分基因靶点的相互作用网络(PPI)。可以看到位于图中央的FOXO3、AKT1、TP53、HMOX1、STAT3、MAPK3、JUN、BCL2L、MAPK9、AR等基因是补骨脂有效成分的关键靶点。
2.2 补骨脂预测靶点的生物学分析与信号通路分析

图1 补骨脂活性成分基因靶点的相互作用网络
利用DAVID数据库对节点进行GO富集分析,结果见表3~6,包括生物过程(biological process,BP)、细胞组分(cellu-larcomponent,CC)、分子功能(molecular function,MF)以及KEGG通路分析。如表3所示,这些靶点主要涉及细胞对缺氧的反应(cellular response to hypoxia)、氧化还原过程(oxidation-reduction process)、对细胞因子的反应(response to cytokine)、线粒体膜通透性的调控(regulationofmitochondrialmembranepermeability)、脂多糖介导的信号通路(lipopolysaccharidemediated signaling pathway)、RNA聚合酶II启动子对转录的正调节作用(positiveregulation of transcription from RNApolymerase IIpromoter)和线粒体细胞色素C的释放(releaseof cytochromec frommitochondria)等生物过程。

表3 补骨脂预测靶点GO生物过程富集分析
如表4所示,这些靶点组成胞浆(cytosol)、线粒体(mitochondrion)、线粒体基质(mitochondrial matrix)、核染色质(nuclear chromatin)、线粒体外膜(mitochondrial outer membrane)等细胞成分。

表4 补骨脂预测靶点GO细胞组分富集分析
如表5所示,这些靶点发挥了血红结合(heme binding)、MAP激酶活性(MAP kinase activity)、ATP结合(ATP binding)、转录因子结合(transcription factor binding)、RNA聚合酶Ⅱ核心启动子近端序列特异性结合(transcriptional activator activity,RNA polymerase II core promoter proximal region sequence-specific binding)等分子功能。
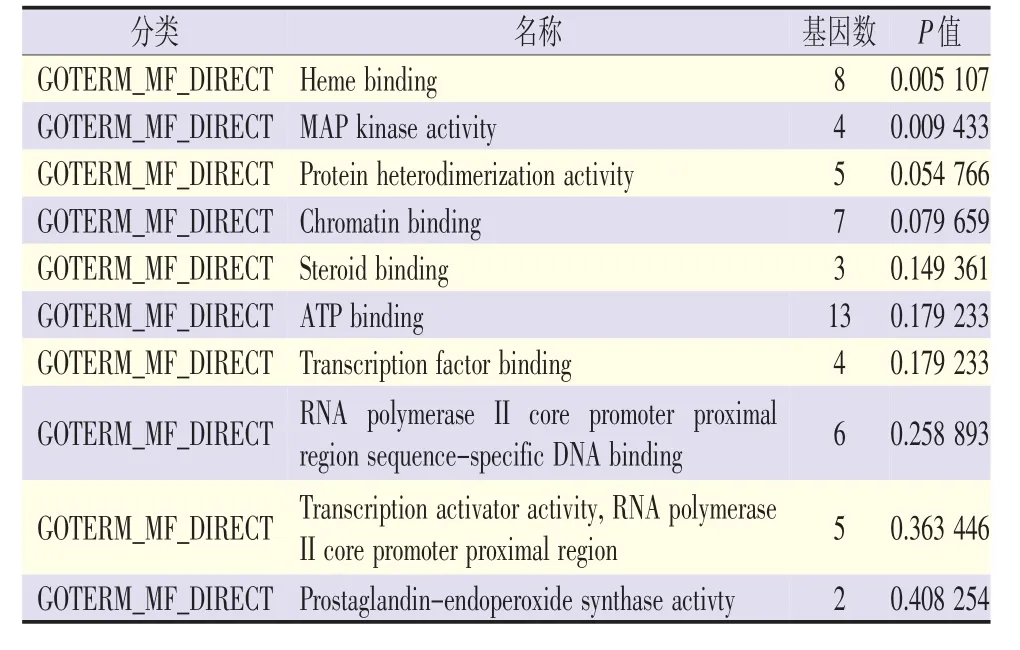
表5 补骨脂预测靶点GO分子功能富集分析
如表6所示,关键靶点KEGG富集分析中,排名靠前的信号通路主要涉及神经营养素信号通路(neurotrophinsignalingpathway)、癌症途径(pathways in cancer)、结直肠癌(colorectal cancer)、催乳素信号通路(hepatitis B)、百日咳通路(pertussis)、前列腺癌通路(prostate cancer)、胰腺癌相关信号通路(pancreatic cancer)。这提示补骨脂主要通过癌症信号传导途径及激素调节信号通路发挥作用,这些通路与细胞的存活密切相关。

表6 补骨脂成分潜在致线粒体损伤靶点的KEGG代谢通路富集分析
2.3 韦恩分析补骨脂预测靶点与线粒体损伤疾病靶点的相关性
将补骨脂活性成分的预测靶点与致线粒体损伤疾病(MD)靶点进行韦恩分析。如图2及表7所示,2个数据交集共有19个基因靶点,这些靶点主要影响细胞氧化还原、细胞对缺氧的反应、调控线粒体膜的通透性、细胞线粒体细胞色素C的释放等。这提示补骨脂活性成分的分子靶点中有19个与线粒体密切相关,因此补骨脂有损伤线粒体的潜在风险。
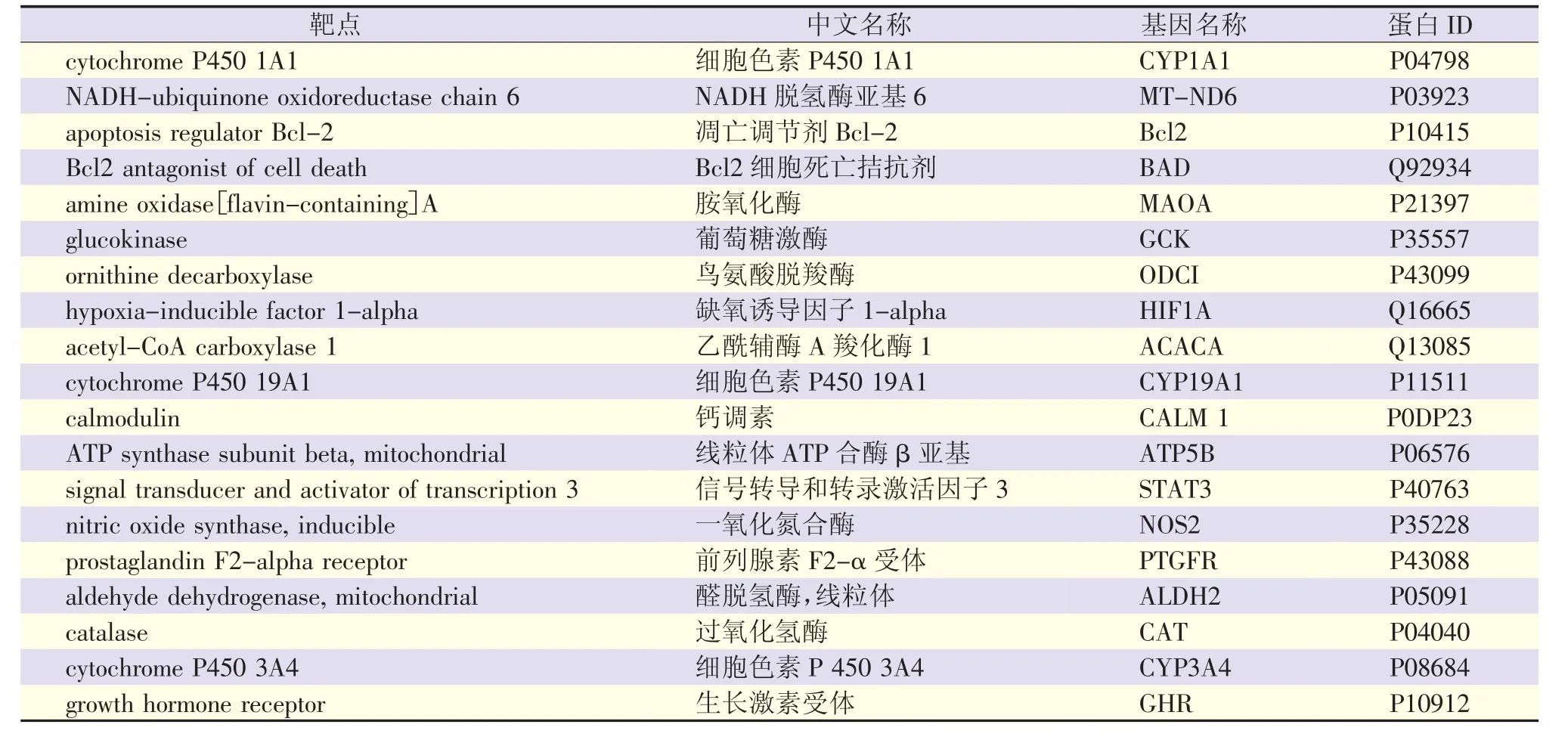
表7 预测靶点与线粒体疾病靶点的重合部分

图2 补骨脂预测靶点与线粒体损伤疾病靶点相关性分析
2.4 补骨脂素和异补骨脂素诱导HepaRG、HepG2肝细胞损伤
为了验证本研究中筛选的补骨脂活性成分的肝毒性,我们挑选了其中2个最具代表性的成分进行检测。在本研究中HepaRG人肝癌细胞具有人原代肝细胞的大多数功能,对细胞色素酶(CYP酶)活性的影响与人的原代肝细胞表现基本相同,毒性研究的结果与人原代肝细胞也基本一致[5],并且还可以在体外大量传代,是体外研究化合物和药物代谢的重要基础,是替代人原代肝细胞较好的候选对象。最新研究表明HepaRG细胞系在药物诱导的肝细胞氧化应激、线粒体损伤以及脂代谢紊乱中具有更强的特异性,与HepG2、L-02、hiHeps细胞系相比HepaRG细胞在肝毒性药物的筛选方面更有优势[6]。而在以往的肝毒性实验中HepG2的使用率更高,更为经典[7],因此我们利用HepaRG、HepG2细胞对补骨脂素和异补骨脂素的肝毒性成分进行鉴定。结果见图3、表8。补骨脂素在HepG2肝 细 胞 的IC50为110.7μmol/L,在HepaRG肝细胞的IC50为336.6μmol/L,两者的肝毒性具有显著差异;异补骨脂素在HepG2肝细胞的IC50为1.4345μmol/L,在HepaRG肝细胞的IC50为75.17μmol/L,两者的肝毒性具有显著差异。
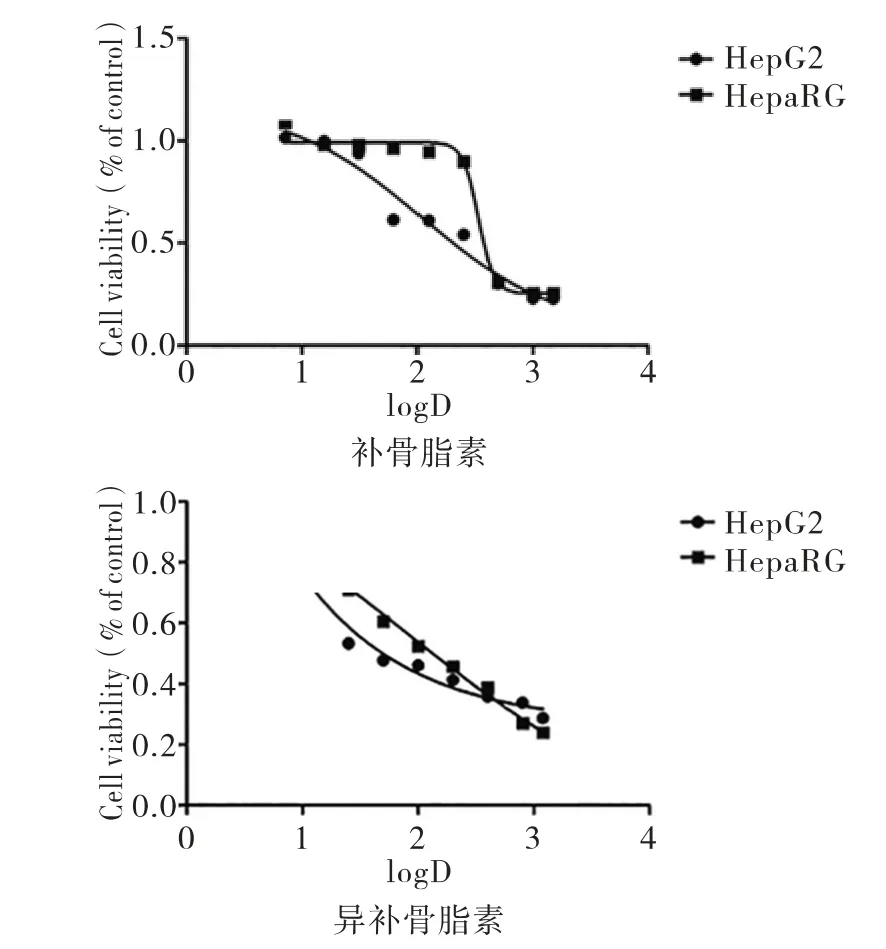
图3 作用于HepaRG、HepG2细胞的24 h毒性曲线图

表8 补骨脂素、异补骨脂素肝毒性线性方程及IC50值
3 结论
本实验通过TCMSP数据库查找补骨脂的主要成分并预测潜在的靶点,构建潜在靶点网络图。利用数据库和文献检索共预测到了9个主要成分以及58个分子靶点,并通过GO生物学过程富集分析以及KEGG代谢通路富集分析其可能的生物学过程和生理功能,发现补骨脂能够导致线粒体损伤而破坏细胞功能。同时,我们利用HepaRG、HepG2肝细胞系对补骨脂素及异补骨脂素的肝毒性作用进行了初步研究,证明其具有明显的肝毒性。
4 讨论
网络药理学是一门基于经典药理学、计算机技术、生物信息学等多学科技术交叉、融合而发展起来的新兴学科,是从分子、细胞再到组织、器官等多种水平来研究药物与人体之间相互作用及其规律和本质的一种研究方法。将实验数据和理论计算相结合,快速筛选有效的药物分子及靶点,预测药物可能存在的毒理作用及其机制,从而达到通过调控细胞内的复杂生物网络来提高药效、降低不良反应和治疗疾病的目的[8]。本实验通过网络药理学研究方法找到补骨脂损伤线粒体的靶点及通路,为后续的实验提供理论依据。
通过中医药系统药理学数据库分析平台得到补骨脂的主要活性成分,并将这些有效物质对应的潜在基因靶点输入到String网站中建立补骨脂活性成分预测靶点的相互作用网络(PPI)。由网络关系图我们发现,关系图中央的几个潜在基因相互作用更紧密。AKT1、HMOX1、BCL2L、AR、MAPK3、MAPK9等主要参与细胞的增殖与分化,对细胞起保护作用。利用DAVID数据库对节点进行GO富集及KEGG通路分析,结果发现,这些靶点参与的生物学过程都与线粒体密切相关,而肝脏的功能依赖于线粒体的代谢稳态[9]。随后我们将补骨脂活性成分的预测靶点与致线粒体损伤疾病靶点进行分析发现,在这58个目标靶点中有19个基因与线粒体损伤有关,这些靶点主要影响细胞氧化还原、细胞对缺氧的反应、调控线粒体膜的通透性、细胞线粒体细胞色素C的释放等。
线粒体损伤是药物性肝损伤的一个重要环节,线粒体能够影响整个肝细胞的正常功能。药物可以通过氧化应激、钙离子紊乱、减少生物合成、改变线粒体膜的通透性、DNA突变等方式来损伤线粒体,从而进一步损伤肝细胞[10]。除此之外,内质网应激也能引起线粒体功能失调并加剧线粒体活性氧(reactiveoxygenspecies,ROS)的产生,内质网应激与氧化应激不仅能通过各自的应激反应通路使细胞发生损伤,还可以通过线粒体途径干扰细胞的功能,并激活促凋亡等信号通路引发细胞凋亡。在补骨脂的分子靶点中,其中Bcl2-Bcl2L信号通路与线粒体凋亡密切相关。在正常情况下,机体中的CHOP蛋白含量比较低,当细胞内外各种不利因素打破细胞内环境稳态,导致发生细胞应激反应时,CHOP蛋白就会大量表达,从而激活多条细胞凋亡通路,促使细胞膜的通透性发生改变,诱发细胞内Ca2+平衡紊乱,从而激活Bcl-2基因,触发细胞线粒体途径凋亡[11]。大量文献报道,线粒体途径是细胞凋亡中较为重要的一个环节。正常情况下细胞色素C存在于线粒体内部,当凋亡信号刺激时,活化的Bcl-2蛋白家族诱导细胞色素C从线粒体中释放,该蛋白从线粒体中释放到细胞胞质中,与caspase-9酶原结合,分解并活化caspase-9,激活的caspase-9活化下游的caspase-3,引起一系列caspase级联反应,分解DNA导致凋亡反应,诱发细胞凋亡[12]。这说明补骨脂的活性成分能够损伤线粒体,由于线粒体自身缺少修复能力[13],故极其容易发生突变位点,导致线粒体在功能上有严重的损坏。
综上所述,本文利用网络药理学并结合实验验证证实,补骨脂的活性成分可以导致肝损伤,而其机制与破坏线粒体的功能密切相关。实验结果也表明其中的2个主要活性成分补骨脂素与异补骨脂素均可导致肝损伤,更好地验证了网络药理学的结果,为以后临床应用补骨脂及其含有补骨脂的中成药应该考虑对肝脏的影响,从而更好地监测病人的药物不良反应,保证病人的用药安全。
