复方丹参滴丸通过调控IRE1-TRAF2-ASK1-JNK通路降低内质网应激和自噬保护血管平滑肌细胞
2022-05-12李幸幸徐忠诚
李幸幸,刘 俊,徐忠诚,邹 晋,董 扬
(1. 浙江省金华市人民医院心血管内科,浙江 金华 321000;2. 江西省人民医院江西省心血管病研究所,江西 南昌 330006)
目前,心血管疾病是引起我国居民死亡的主要疾病,已成为社会的重要负担,严重威胁人民群众健康[1],动脉粥样硬化(atherosclerosis,AS)是引起心脑血管疾病中的重要诱因,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)发生表型转换及增殖异常,迁移和凋亡是影响AS发展的突出表现[2-3],而VSMCs的病理机制目前尚未阐明。内质网应激(endoplasmic reticulum stress,ERS)相关的凋亡途径可能导致了VSMC 增殖和凋亡异常从而在 AS 发生和发展中发挥重要作用[4-5]。此外,在AS中,血管平滑肌细胞存在血管细胞自噬样特性,适度的血管平滑肌细胞自噬可以减轻氧化应激和抑制细胞凋亡,从而诱导形成稳定斑块[6-7]。而ERS与自噬过程密切相关,可以诱导细胞发生自噬,但过度激活的自噬反应,能够促进细胞凋亡[8]。因此,细胞ERS及自噬可能是治疗AS的潜在新靶标。中医药是治疗动脉粥样硬化性心血管疾病的特色药物,中药复方是治疗AS不可或缺的重要药物之一,复方丹参滴丸是由丹参、三七、冰片3味中药组成的复方。该方主要适应症为冠心病和心绞痛,其药理作用与抑制血管平滑肌细胞增殖相关[9-10]。但其作用是否与调控内质网应激和自噬过程有关目前不得而知,故本研究欲过建立ox-LDL诱导的VSMCs增殖迁移模型,探究复方丹参滴丸对VSMCs内质网应激和自噬的影响,为复方丹参滴丸治疗动脉粥样硬化提供理论基础。
1 材料与方法
1.1 临床资料
1.1.1一般资料 选择2016年2月~2018年5月收治的50例动脉粥样硬化患者,年龄50~75岁,颈动脉狭窄<50%,患者或其家属均自愿签署知情同意书。排除合并严重糖尿病和严重心肝肾等重要器官病变者,合并凝血功能障碍者,大面积脑梗或合并语言障碍、意识障碍者,妊娠期女性及精神障碍者,合并严重的消化系统病变不能耐受药物治疗者,治疗依从性差不能坚持配合治疗者。将入组患者随机分为2组:观察组25例,男15例,女10例;年龄50~73(67.5±5.4)岁。对照组25例,男13例,女12例;年龄51~76(67.3±6.1)岁。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.1.2治疗方法 对照组采用西医治疗方案:辛伐他汀(北京四环制药有限公司,国药准字H20093221,规格:10 mg)10 mg,每晚睡前口服;阿司匹林肠溶片(山西兰花药业有限公司,国药准字H14023980,规格:0.1 g)0.1 g,每日1次口服,均连续用药3个月。观察组在对照组治疗基础上给予复方丹参滴丸(天津天士力制药集团有限公司,国药准字Z10950111,规格:27 mg)27 mg,每日3次口服,一次10丸,连续口服3个月。
1.1.3观察指标 ① 超声检测指标:使用彩色多普勒超声仪检查左右颈动脉,记录患者动脉内膜中层厚度(IMT)和斑块数目及大小,计算斑块面积,斑块面积计算方法:测量每个斑块的3条直径,选择直径最大的2条作为长、宽,相乘得出斑块面积。② 血液流变学指标:使用血液黏度计检测2组患者治疗前后全血高切黏度、全血低切黏度、血浆比黏度。③凝血功能指标:使用全自动凝血分析仪测定2组患者治疗前后血浆纤维蛋白原(FIB)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)及凝血酶时间(TT)。
1.2 材料大鼠胸大动脉平滑肌细胞株(A7r5),复方丹参滴丸(天津天士力制药集团有限公司),内质网应激抑制剂salubrinal(美国Sigma-Aldrich公司,No.324895)和ERS(tunicamycin)诱导剂衣霉素(铼博生化科技有限公司,No. LBH4274),TRizol试剂(美国Sigma公司,No. T9424);PowerUp SYBR Green Master Mix(No. A25742)(Thermo Fisher Scientific公司),新生胎牛血清,DMEM/F12、胰蛋白酶(美国Gibco公司),MTT试剂盒(No ST316)、ROS试剂盒(S0033)(上海碧云天生物技术有限公司),8OHdG试剂盒(上海博湖生物科技有限公司,BH-M99795),NO试剂盒(A012-1-2)、SOD试剂盒(A001-3-1)、MDA试剂盒(A003-1-1)(南京建成生物工程研究所),eNOS酶联免疫试剂盒(上海雅吉生物科技有限公司,YS02062B),兔抗大鼠Bip/GRP78(ab21685),ATG5(ab109490),LC3(ab232940),P62(ab207305),bcl-2(ab32124),bax(ab32503)、caspase-3(ab32351)、IRE1(ab37073))、TARF2(ab126758)、ASK1(ab45178)、p-ASK1(ab278547)、JNK(ab199380)和p-JNK(ab76572)一抗(美国Abcam公司),辣根过氧化物酶(HRP)标记的羊抗鼠/兔二抗(上海碧云天生物技术有限公司A0192/A0208),引物(上海生工生物工程有限公司),Annexin V-FITC凋亡检测试剂盒(天津三箭生物技术有限公司,AO2001-02A-G),电泳仪(美国BIO-RAD公司),PCR仪(美国ABI公司),超微量分光光度计(美国赛默飞公司)。
1.3 方法
1.3.1细胞培养 将A7r5细胞培养在含有10%胎牛血清及双抗的DMEM/F12培养基中,于37 ℃和5%CO2的环境养,定期更换新鲜培养基,待至对数生长期进行细胞传代,进行后续实验。
1.3.2分组及干预方法 将对数生长期的血管平滑肌分为对照组、ox-LDL模型组、复方丹参滴丸组,复方丹参滴丸+salubrinal组和复方丹参滴丸+tunicamycin组。ox-LDL模型组给予50 mg·L-1的ox-LDL刺激建立VSMCs增殖迁移模型,复方丹参滴丸组:在模型组基础上给予1.0 g·L-1的复方丹参滴丸浸膏处理,复方丹参滴丸+salubrinal组:在复方丹参滴丸组基础上给予50 nmol·L-1的内质网应激抑制剂salubrinal处理,复方丹参滴丸+tunicamycin组:在复方丹参滴丸组的基础上给予20 nmol·L-1的内质网应激诱导tunicamycin处理。各组均给药干预3 d。
1.3.3MTT增殖实验 各组培养3 d后取各组对数期1×103细胞接种于96孔培养板,于培养72 h后,每孔加入20 μL的5 mg·L-1MTT溶液后继续培养6 h,离心弃去MTT溶液,加入DMSO 150 μL,混匀10 min,应用酶标仪测490 nn处吸光度值,以吸光度值反映活细胞水平,实验重复3次。
1.3.4NO、SOD、MDA、8OHdG测定 利用硝酸还原酶法按照NO试剂盒说明书测定各组细胞NO含量。
1.3.5eNOS含量测定 按照eNOS酶联免疫试剂盒说明书进行操作,测定各组细胞中eNOS的含量。
1.3.6ER染色 处理的细胞用ER-tracker Blue-White DPX染料(Molecular Probes)在37 ℃黑暗中染色30分钟。
1.3.7Western blot检测蛋白表达 收集各组细胞加入RIPA裂解细胞。离心后取上清置于EP管中放入-80 ℃冰箱保存。依据BCA试剂盒使用说明检测蛋白浓度。以GAPDH作为内参,将目标蛋白通过SDS-PAGE分离。随后转至PVDF膜并常温封闭1 h后使用TBST清洗,使用Bip/GRP78、ATG5、LC3、P62、bcl-2、bax、caspase-3、IRE1、TARF2、ASK1、p-ASK1、JNK和p-JNK单克隆抗体一抗,在4 ℃冰箱孵育过夜。最后使用辣根过氧化酶二抗(1 ∶5 000)孵育并加入ECL显色液显色成像。
1.3.8流式检测细胞凋亡 对药物处理后的细胞,加入Annexin V-FITC凋亡检测试剂,使用流式细胞仪检测细胞凋亡结果。
1.3.9免疫共沉淀(CO-IP) 收集VSMCs细胞(1×108L-1),并用IP缓冲液(P0013,Beyotime)溶解,然后添加超声波处理。离心后,上清液与兔抗-IgG(1 ∶8 000)、抗-ASK1(1 ∶100)和BeyoMagTMA+G磁珠反应蛋白(P2173,Beyotime)在4 ℃下过夜。抗原抗体蛋白A+G磁珠复合物洗涤后,用SDS样品缓冲液洗脱结合蛋白。最后,我们用Western blot检测沉淀蛋白。

2 结果
2.1 两组患者临床治疗效果比较2组治疗后IMT、斑块数目、斑块面积均明显低于治疗前(P<0.05),且观察组治疗后以上检测指标均明显低于对照组(P<0.05)(Tab 1)。2组治疗后全血高切黏度、全血低切黏度、血浆比黏度均明显低于治疗前(P<0.05),且观察组治疗后以上血液流变学指标均明显低于对照组(P<0.05)(Tab 2)。

2.2 各组VSMCs细胞增殖情况使用不同浓度的复方丹参滴丸处理ox-LDL模型细胞,细胞活力检测后其LD50为5.126 g·L-1。故选用1.0 g·L-1的复方丹参滴丸与其它药物联合处理细胞,与对照组相比,ox-LDL模型组吸光度值明显增加(P<0.05),而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则明显下降,且复方丹参滴丸+salubrinal下降更为明显(P<0.05),复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸的下降(P<0.05)(Fig 1)。

Fig 1 Effects of different concentrations of Fufang Danshendripping pills on activity of vascular smooth muscle cells (A) and proliferation of vascular smooth muscle cells after different interventions
2.3 各组VSMCs NO含量比较Fig 2显示,与对照组相比,ox-LDL模型组eNOS和NO含量明显下降(P<0.05),而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则明显增加,且复方丹参滴丸+salubrinal增加更为明显(P<0.05),复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的下降(P<0.05)。

Fig 2 Comparison of eNOS and NO content of
2.4 各组VSMCs氧化应激水平如Fig 3所示,ox-LDL模型组较与对照组,其中SOD含量显著降低,而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则明显上调,且复方丹参滴丸+salubrinal显著更为上调,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的上调。与对照组相比,ox-LDL模型组MDA、8OHdG和ROS含量明显增加,而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则明显下降,且复方丹参滴丸+salubrinal下降更为明显,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的下降。
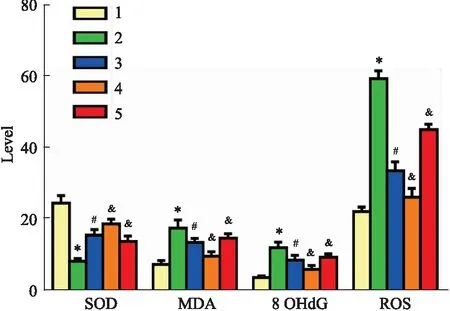
Fig 3 Oxidative stress indexes of
2.5 各组大鼠VSMCs内质网应激和自噬标志蛋白表达情况使用ER染色、LC3免疫荧光和ER应激和自噬相关蛋白的免疫印迹来验证复方丹参滴丸对VSMCs内ER应激和自噬的作用。在ox-LDL模型细胞中,活细胞的典型均匀ER染色模式发生了剧烈变化并呈现阴影,其中常驻荧光脂质易于位于质膜上,复方丹参滴丸组和复方丹参滴丸+salubrinal组则显著改善,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的改善作用(Fig 4A)。同时,与对照组相比,在ox-LDL模型细胞中,斑点LC3B绿色信号明显增加,相应自噬蛋白上调(Fig 4B)。复方丹参滴丸组和复方丹参滴丸+salubrinal组则显著降低,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的下降。Fig 4C,D显示,与对照组相比,ox-LDL模型组Bip/GRP78、ATG5、LC3、P62蛋白表达明显上调,而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则明显上调,且复方丹参滴丸+salubrinal上调更为明显,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的下降。
2.6 各组大鼠VSMCs凋亡情况比较对ox-LDL处理后及不同干预的VSMCs凋亡情况进行检测。ox-LDL模型组细胞较对照组细胞出现明显的凋亡现象,复方丹参滴丸组和复方丹参滴丸+salubrinal组则会逆转ox-LDL对VSMCs造成的凋亡,复方丹参滴丸+tunicamycin组这种逆转现象减弱(Fig 5A,B)。凋亡蛋白检测结果显示(Fig 5C,D),与对照组相比,ox-LDL模型组bcl-2明显下调,bax和caspase-3蛋白明显上调,而与ox-LDL模型组相比,复方丹参滴丸组和复方丹参滴丸+salubrinal组则bcl-2明显上调,bax和caspase-3明显下调,且复方丹参滴丸+salubrinal上调或下调更为明显,复方丹参滴丸+tunicamycin组则明显逆转了复方丹参滴丸组的上调和下调。

Fig 4 Expression of endoplasmic reticulum stress and autophagy marker proteins in VSMCs of

Fig 5 Comparison of VSMCs cell apoptosis
2.7 各组大鼠VSMCs内IRE1-TRAF2-ASK1-JNK通路激活情况为了进一步研究复方丹参滴丸与IRE1-TRAF2-ASK1-JNK通路的机制,我们进行了共刺激实验。IRE1招募TNAF2后可以激活ASK1,进而激活JNK信号通路使细胞产生凋亡和自噬[10]。如Fig 6所示,与对照组相比,ox-LDL模型组细胞内IRE1-TRAF2-ASK1-JNK通路被过度激活,在此基础上,复方丹参滴丸会降低该信号通路的激活,与salubrinal联用作用细胞后,降低作用更明显。tunicamycin会减弱复方丹参滴丸的作用。

Fig 6 Activation of
3 讨论
随着生活习惯和生活水平的改变,我国心血管疾病发病率逐年攀升[11],动脉粥样硬化是心血管疾病中最为常见的类型之一,在AS病理进程中,VSMC异常增殖、凋亡和表型改变发挥重要作用[12]。因此,抑制VSMC过度增殖和凋亡VSMC可以一定程度上实现延缓AS的作用,AS属于“胸痹”“中风”“真心痛”等疾病共同发病基础,属于本虚标实证候。中药在调节脂质代谢、抑制VSMC增殖和迁移和调节氧化应激失衡多机理实现防治AS的作用[13]。
复方丹参滴丸由丹参、三七、冰片3味中药组成。丹参为君,三七为臣,冰片引经上行,为佐使剂,诸药合用,共奏协同互补之效[14]。药理学研究表明,复方丹参滴丸中皂苷类成分具有抑制血管平滑肌细胞增殖等保护作用[15],但其作用机制并未完全阐明。故本研究拟从内质网应激和自噬这两方面阐述复方丹参滴丸对VSMCs的保护机制。本研究使用ox-LDL诱导大鼠VSMCs增殖模型[15],随后采用复方丹参滴进行干预,并为了进一步观察其对ERS直接调控作用,在复方丹参滴干预基础上分别联用ERS抑制剂和诱导剂,观察不同干预大鼠VSMC迁移、凋亡、氧化应激、ERS及自噬等影响。结果显示,ox-LDL诱导后,大鼠VSMCs增殖和凋亡明显异常,NO和eNOS水平明显下降,说明血管平滑肌的功能受损。氧化应激水平明显增加,同时ERS标志物Bip/GRP78,以及ATG5、LC3、P62过度表达,表明ox-LDL诱导后ERS和自噬过度激活,整体上呈现病理性特征,模型建立成功,而给予复方丹参滴丸后NO和eNOS明显升高,氧化应激水平明显减少,表明其改善了VSMCs血管功能,减轻了氧化应激,同时大鼠VSMCs增殖和凋亡得到明显抑制,同时Bip/GRP78,以及ATG5、LC3、P62蛋白表达均明显减轻,表明复方丹参滴丸可以明显减轻过度激活的ERS和自噬,减轻细胞凋亡和增殖异常,改善了VSMCs血管功能和氧化应激。而在给予ERS抑制剂后,上述指标均呈现更为明显的改善,表明复方丹参滴丸和ERS抑制剂发挥协同作用。但在给予ERS诱导剂后,均明显逆转了复方丹参滴丸的改善作用,呈现此消彼长的趋势。
在ERS后,细胞将激活许多适应性功能以响应蛋白质折叠的变化,未折叠蛋白的积累会刺激内质网中IRE1的自磷酸化和寡聚化。IRE1是一种跨膜蛋白,在ERS条件下维持细胞存活起着关键作用[16]。在ERS期间,IRE1招募TNAF2,TNAF2反过来激活ASK1,最后激活JNK信号通路[17],从而促进细胞凋亡或自噬。特别是,在接种JNK(c-Jun N端激酶)抑制剂或IRE1缺陷细胞的细胞中,ER应激触发的自噬受到抑制,表明IRE1/JNK级联对于刺激ER应激后的自噬是必需的[10]。当ERS的持续时间或程度达到包括自噬在内的细胞适应性机制的极限时,细胞死亡程序就会被激活。细胞凋亡是最常见的细胞死亡方式,总是伴随着高度的半胱天冬酶激活。半胱天冬酶的激活可导致自噬蛋白的裂解,从而导致自噬程序失活,其目的可能是中止其细胞保护作用并加速细胞死亡[18],故自噬状态的初级细胞保护作用未能改善细胞状态后,则会触发细胞程序性凋亡。进一步表明,复方丹参滴丸可通过调控ERS维持细胞适当自噬激活程度,减轻了氧化应激,从而抑制细胞过度增殖和凋亡,改善血管功能。为了进一步分析复方丹参滴丸与IRE1-TRAF2-ASK1-JNK通路的作用机制,我们进行了系列实验分析。我们的研究表明,ox-LDL诱导后,大鼠VSMCs内的ERS过度激活,并导致IRE1-TRAF2-ASK1-JNK通路的过度激活。给予复方丹参滴丸后,降低IRE1-TRAF2-ASK1-JNK通路的过度激活,维持细胞适当自噬激活程度,而在复方丹参滴丸与ERS抑制剂联用后,IRE1-TRAF2-ASK1-JNK通路的过度激活呈现更为明显的改善,表明复方丹参滴丸和ERS抑制剂发挥协同作用。但在复方丹参滴丸与ERS诱导剂后,均明显逆转了复方丹参滴丸的对维持IRE1-TRAF2-ASK1-JNK通路正常激活水平。
综上所述,复方丹参滴丸通过抑制IRE1-TRAF2-ASK1-JNK通路的过度激活,降低内质网应激,维持适当自噬,减轻氧化应激,抑制细胞异常增殖和凋亡,从而保护血管平滑肌细胞。但本研究并未加入自噬调控的诱导剂和抑制剂,并未观察其对调控自噬对ERS的影响,未进行相互作用的研究,这是下一步研究工作的重点,同时还需在体内动物实验进行验证,提供更坚实的实验依据。
