安石榴苷治疗抑郁症的网络药理学研究及实验验证
2022-05-12黄淑芸郭红敏柳艳萍洪宗元钟树志
许 萍,黄淑芸,郭红敏,柳艳萍,洪宗元,钟树志
(皖南医学院基础医学院,安徽 芜湖 241002)
抑郁症患病率高、治愈率低,目前其发病机制仍未完全了解,需要更安全有效的疗法。越来越多的人认识到天然产物的健康特性和将其用作功能性食品或预防医学的潜力[1-2]。石榴,亦名安石榴。《本草纲目·果部·安石榴》酸榴皮主治:“赤白痢下、久痢久泻、疔肿恶毒、肚子生疮”。药用其皮,故名石榴皮。研究表明石榴皮提取物安石榴苷(punicalagin,Pun)具有抗炎、抗氧化、抗菌、保肝抗癌、预防心脑血管疾病、改善妇女更年期综合征等多种药理功能[3]。
Pun是用于治疗神经退行性疾病的有效NF-κB抑制剂,能够改善致神经元损失的脑中神经炎症和氧化应激[4]。Pun能够激活小鼠的AMPK/PGC-1α/Nrf2级联,改善孕妇产前应激[5]。石榴提取物可改善卵巢切除小鼠绝经综合征模型的抑郁状态[6]。这些研究表明,Pun能够缓解神经疼痛并能够改善认知功能,并可能改善抑郁症。然而,Pun能否改善抑郁症状及其可能的分子机制尚未见报道。
网络药理学是使用生物信息数据库,整合疾病、药物相关的基因、蛋白质进行综合分析的一种新型的药物研发模式[7]。本研究采用网络药理学方法探讨Pun对抑郁症的作用及潜在分子机制,并进行分子对接以及动物实验验证,为进一步研究Pun治疗抑郁症的药理机制提供基础,并为新药临床应用提供证据。
1 材料与方法
1.1 网络药理学
1.1.1药物-疾病共同靶点 使用Pubchem数据库(Tab 1)获得Pun的结构,导入PharmMapper数据库,取Norm Fit预测得分>0的靶标作为药物靶点,经Uniprot数据库对靶点名称统一矫正后获得药物靶点。使用OMIM、TTD、Genecards数据库以“depressed”、“depression”、“depressive”为关键词进行检索并去重。取两者交集Venny2.1绘制韦恩图。使用Cytoscape 3.7.2软件,进行疾病-靶点-成分网络构建及分析。

1.1.2PPI网络构建及核心靶点分析 在STRING数据库中对“1.1.1”获得靶点进行检索,蛋白种属“Homo sapiens”、阈值0.4,建立蛋白互作关联图。用Cytoscap 3.7.2拓扑分析,选取基因满足度(Degree)值超过平均分的基因,使用R 3.6.0绘制条形图。
1.1.3通路和功能富集的分析 基于R软件使用Bioconductor以P<0.05,Q<0.05进行关键基因的基因生物过程(GO)及基因组百科全书(KEGG)分析。将共同靶点经R语言运行后GO分析选取生物学过程和排名前20位的KEGG通路。
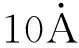
1.3 动物实验
1.3.1实验材料、试剂 实验小鼠:C57BL/6 60只,1~2月龄,雌雄各半,(22±3) g,由长沙天勤生物提供SCXK(湘)2019-0014。常规饲养,恒温(23±2) ℃,恒湿40%~60%,昼夜交替照明,自由饮水与摄食,实验前1周不处理。安石榴苷冻干粉(P0349,纯优生物有限公司);液相色谱质谱联用仪Agilent 6460 (MA,美国)。超纯水仪(Millipore, Bedford,MA,美国)。乙腈,光谱级,默克化学公司(中国上海)。其他试剂均为分析纯。
1.3.2造模分组给药 参照文献[8]的造模方法,实验遵循随机、不可预见性的原则,所有小鼠均单笼孤养,连续28 d,每天不定时随机给3种低强度刺激,包括:夹尾、禁食、禁水、热烘、震荡、倾斜、潮湿、昼夜颠倒、冰水游泳。在小鼠造模结束后和灌胃用药结束后,分别进行行为学实验的检测,检验造模及治疗成果。所有动物实验程序均根据皖南医学院伦理委员会批准的方案(YJS-2020-10-006)进行。
将造模成功的小鼠均分为4组,参考文献设定给药剂量[9],正常对照组(Normal)、模型组(Model)给与灭菌水灌胃;Pun治疗高、中、低剂量组(Pun-H、Pun-M、Pun-L)分别给予Pun 50 、25和12.5 mg·kg-1灌胃,每天1次,连续45 d。
1.3.3小鼠旷场实验 将小鼠放置于旷场箱中,每只小鼠检测时间为6 min,自由活动1 min,记录后5 min的穿越格数(以穿越底面积块数为水平运动记录穿越格数)和直立次数(为垂直运动记录小鼠前肢直立次数)。
1.3.4液相色谱-质谱法(LC-MS/MS) 检测海马中多巴胺(dopamine,DA)、5-羟色胺(5-hydroxytryptamine,5-HT)含量 小鼠处死后,取海马组织,生理盐水洗净,精密称重后加入4倍超纯水冰浴匀浆。采用Agilent C18色谱柱(2.1 × 50 mm,1.8 μm)在35 ℃下进行色谱分离。用程序溶剂混合物溶剂A(乙腈)和溶剂B(0.1%甲酸水溶液)洗脱,流速为0.3 mL·min-1: 0~4 min: 95%~0% B;4~5 min:40%~80% B;5~6 min;80%~95% B。采用MassHunter软件(Version B.06.00,Agilent Technology,MA,USA)在正电离模式下采集数据并进行分析。质谱参数:气体温度300 ℃;气流量5 L·min-1;喷雾器气体45 psi;护套气体温度250 ℃;鞘气流量11 L·min-1;毛细管电压3 500 V;碎片电压135 V;碰撞能量15 eV。

2 结果
2.1 PPI网络构建及核心靶点分析Venny2.1将获得的290个药物靶点与1 635个疾病靶点集合,得到核心靶点76个。蛋白相互作用网络图(Fig 1)可见PPI网络中节点之间关系密切,Pun与抑郁症交集基因之间有高度关联性。核心靶点(Fig 2)前10包括血清白蛋白(albumin,ALB)、丝氨酸/苏氨酸蛋白激酶1(AKT1)、半胱氨酸-天冬氨酸蛋白酶(CASP3)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、基质金属蛋白酶(MMP)9、雌激素ESR1、过氧化氢酶CAT、明胶酶A(MMP-2)、一氧化氮NOS3(nitric oxide synthase 3)、过氧化物酶体增生激活受体γPPARG。

Fig 1 Protein interaction network
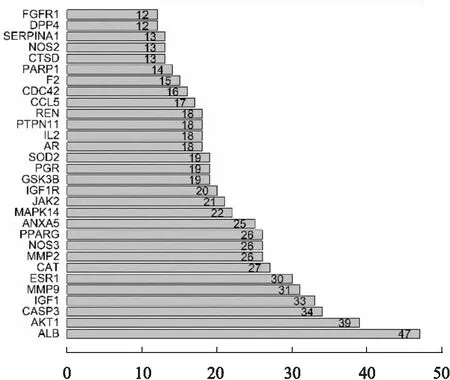
Fig 2 Ranking of core targets based on PPI topology analysis
2.2 GO 、KEGG富集分析GO结果显示(Fig 3),交集基因共富集1 127条生物学过程。Pun抗抑郁机制主要涉及对脂多糖(lipopolysaccharide,LPS)的反应、肌细胞增殖等生物学过程。R语言运行后共得到74条KEGG通路,取前20条(Fig 4)。富集靶点较多的主要信号通路有癌症中的蛋白多糖、脂质和动脉粥样硬化、糖尿病心肌病、促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAP激酶, MAPK)、磷酯酰肌醇-3激酶/蛋白激酶B(PI3K-Akt)、肾素-血管紧张素系统(renin-angiotensin system,RAS)等。

Fig 3 GO enrichment analysis
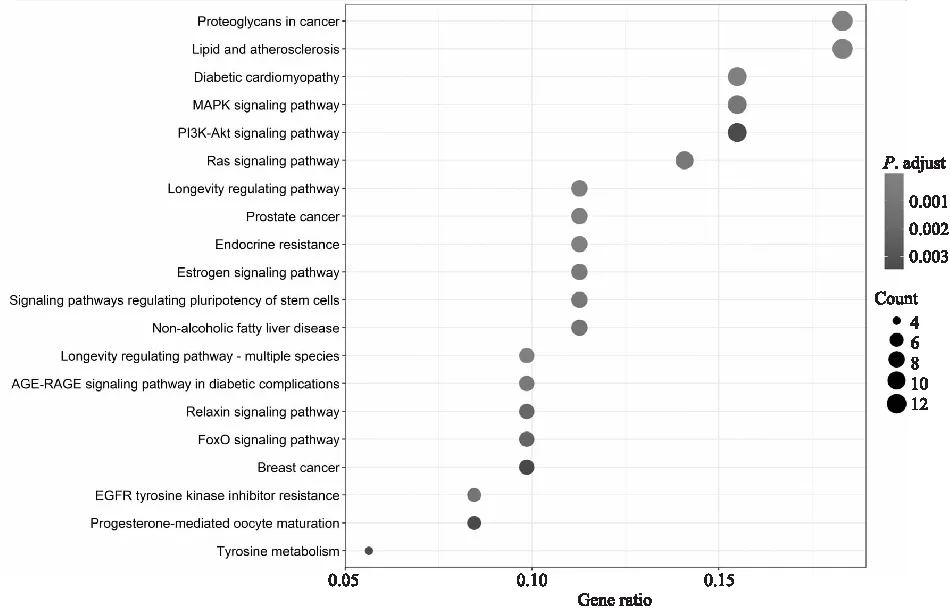
Fig 4 KEGG enrichment analysis
2.3 分子对接结果如Fig 5、6,化合物和靶点蛋白存在很好的结合作用。据结合模式可以很清晰的看到化合物与蛋白口袋相结合的氨基酸残基,如:Pun与AKT1结合的活性氨基酸残基有LYS-158、PHE-161、LYS-179、ASP-439、MET-281、LYS-276等。

Fig 5 Combination mode of Pun and AKT1

Fig 6 Combination mode of Pun and ALB
2.4 Pun对CUMS抑郁模型小鼠体质量的影响如Fig 7,造模前,造模组与Normal组没有差异,造模完成后小鼠体质量均低于Normal组(P<0.05)。给药45 d后,Pun各组小鼠体质量较Model组快速上调(P<0.05),接近Normal小鼠体质量。
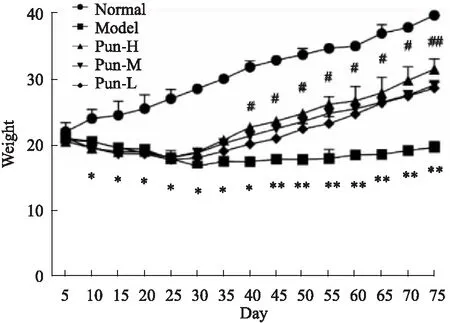
Fig 7 Body mass of mice
2.5 Pun对小鼠旷场实验的影响与Model组相比,用药组旷场实验小鼠的探索欲明显增加(P<0.05,P<0.01)(Tab 2)。
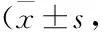
Tab 2 Open field experiment of mice n=12)
2.6 Pun对抑郁小鼠海马组织中DA、5-HT水平的影响Model组小鼠海马中递质水平比Normal组迅速下落(P<0.01)(Tab 3),而Pun治疗可以改善其水平(P<0.05,P<0.01)。

Tab 3 Levels of DA and 5-HT in mouse
3 讨论
PPI核心靶点ALB、AKT1等化合物可能是Pun治疗抑郁症的关键成分。其中ALB作为人体内重要的营养物质,目前应用于检测机体的营养状况。一项横断面研究[10]使用ALB作为营养评价检查发现了124名血液透析患者的营养状况和抑郁症之间存在密切联系。另一项研究发现[11]老人抑郁症和ALB等健康状况指标密切相关,老年抑郁症量表(GDS-15)每增加1点,健康状况不佳的风险增加20%(P<0.01)。新近研究发现[12]逍遥丸通过激活AKT1相关信号通路,改善大鼠抑郁样行为和氧化应激。
GO富集分析结果表明,Pun抗抑郁机制主要涉及对LPS诱导的炎症反应、肌细胞增殖等生物学过程。研究发现,LPS可以诱导神经炎症以及病理改变,从而引起抑郁症等疾病[13]。抑制LPS引起的神经炎症可能是Pun改善小鼠抑郁样行为的重要机制。抑郁是心肌梗死的危险因素。研究发现5-HT再摄取抑制剂能够降低抑郁所引起的心肌梗死。其作用机制与5-HT介导的平滑肌细胞增殖相关[14]。
KEGG 富集分析说明,Pun的主要活性成分可能是通过介导癌症中的蛋白多糖、脂质和动脉粥样硬化等途径治疗抑郁症。癌症中的蛋白多糖如透明质酸、硫酸乙酰肝素蛋白多糖、硫酸软骨素/硫酸皮肤素蛋白多糖等形成致密的点阵状神经周网(perineuronal nets,PNNs),调节中枢神经系统损伤后的神经活性和可塑性[15]。Pun治疗或许可以作用于PNNs,增强神经元活性和突触可塑性,促进中枢神经退行性疾病的恢复。动脉粥样硬化是一种脂质驱动的动脉免疫炎症性疾病,同时也是认知障碍的主要风险因素[16]。Pun可能通过心血管相关机制改善认知行为。除此之外,MAPK、PI3K-Akt和Ras信号通路能够介导神经营养因子、生长因子,有效降低海马神经元衰弱并促进其复苏,增加突触可塑性,发挥抗抑郁作用。
分子对接结果表明,Pun含有多个供受体,Pun能够与AKT1、ALB靶点蛋白的氨基酸的活性基团形成较强氢键相互作用,与口袋的疏水性残基形成疏水相互作用,共轭相互作用等,从而促进小分子与蛋白位点的结合,该结果验证了网络药理学筛选结果, Pun与AKT1、ALB蛋白靶点匹配好,是潜在的有治疗活性的化合物。
综上,本研究运用网络药理学,对Pun治疗抑郁症的活性成分与重要靶点进行了分析与预测,并进一步采用分子对接及动物实验对Pun的药效进行了进一步探索,初步明确了Pun的主要活性成分可能是多靶点、多途径抑制HPA轴亢进并促进脑内单胺递质分泌,避免损伤海马神经元从而发挥抗抑郁作用,为后续Pun的抗抑郁分子机制作用的深入研究思路提供了一定方向。
