TiO2光催化甲酸水溶液产氢性能研究
2022-05-11王香婷王思哲胡奋
王香婷,王思哲,胡奋
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
随着环境污染和能源危机的日益加剧,迫切需要发展可持续的能源资源。氢被认为是最有前途的能源之一[1]。太阳能光催化分解水制氢具有系统结构简单、投资少、便于规模开发的优点,是解决未来能源危机和环境污染的一条重要途径,受到了国内外学者的高度关注[2]。光解水制氢以太阳能为光源,以半导体为催化剂。在各种半导体中,二氧化钛由于其稳定的物理化学性质和特殊的光氧化能力广受欢迎,广泛应用于H2生成、CO2还原和有机污染物降解等方面[3-9]。但二氧化钛的禁带宽度较大(3.0~3.2 eV),需要在紫外光照射下才能发生光催化反应,通常通过光沉积、掺入共催化剂、掺杂和构建异质结等对二氧化钛进行改性[10-12],从而使其在可见光范围内具有较高的光催化活性。另外,因为光生电子和空穴很容易结合在一起,导致光催化反应速率较低,为了使光生电荷激发、传递和被捕获过程能有效地继续进行,在一些情况下必须使用被称为牺牲剂的空穴或电子消耗剂,通过消耗e-或h+来维持目标反应的进行[13-14],分子量较小的醇类、有机酸类、醛类是目前公认的常用有机牺牲剂[15]。矿山开采过程中产生的酸性尾矿废水,其排入水体后会导致水体中有机物如小分子有机酸、醇等含量增加,使得好氧微生物代谢增强造成水体缺氧,危及水生生物[16-17]。利用尾矿废水中的有机污染物作为牺牲剂进行光解水制氢,在产生氢气的同时使有机污染物被氧化为二氧化碳[18-22],在消除有机污染的同时获得氢气,无疑这种研究更具有实际意义。因此,本文以TiO2为光催化剂,采用光沉积法加入Pt和Pd对其进行改性,以甲酸水溶液模拟含小分子酸的废水,探讨改性后的TiO2在含甲酸废水中的产氢性能。
1 材料与方法
1.1 仪器与试剂
试剂均为分析纯,未经纯化直接使用,生产厂家为国药集团化学试剂有限公司。
采用BL-GHX-V型光催化反应器(上海比朗仪器有限公司)和GC7900气相色谱仪(上海天美科学仪器制造有限公司)进行产氢研究;SPB-3全自动空气源(北京惠普分析技术研究公司);PLSSXE300c金卤灯光源(北京泊菲莱科有限公司)。
1.2 催化剂的制备
用干燥的量筒量取1 mL钛酸四丁酯,将其溶于20 mL异丙醇中,混合均匀。在磁力搅拌下将混合液缓慢滴入到10 mL蒸馏水中,制得乳白色的凝胶,用NaOH调节pH为12,装入聚四氟乙烯反应釜,在烘箱中160℃反应12 h,冷却后过滤,水洗、醇洗各3次,干燥。放入马弗炉中,在450℃下焙烧6 h,自然冷却后得白色粉末状样品。
1.3 催化剂表征
利用X'Pert PowderX型射线衍射仪(荷兰帕纳科公司)进行物相结构分析,利用中心LEO-438VP型扫描电子显微镜(SEM)(上海材料与制造大型仪器)观察催化剂形貌,利用Nicolet380型傅里叶变换红外光谱仪(FT-IR)(美国赛默飞有限公司)分析鉴定催化剂的分子结构及其不同的官能团,利用722G型紫外可见漫反射光谱仪(UV-vis)(上海仪电分析仪器有限公司)观察催化剂光吸收性能。
1.4 光催化活性的评价
光催化反应以PLS-SXE300c金卤灯作为光源。在反应器中加0.2 g TiO2光催化剂、10 mL甲酸溶液(88%)、290 mL蒸馏水,接通冷却循环水。通入N2、H2,检漏。开启光源,待光源稳定并反应20 min后开始光催化反应。试验进行10 h,每20 min采集一次气相产物,由GC7900气相色谱仪对产物进行分析。载气为N2,从色谱读取H2峰面积,再通过标准曲线换算得到产氢量,以时间和产量绘图并计算产率。以不添加催化剂做空白试验,Pt和Pd助剂分别通过原位添加的方法加入反应器,再分别加入430μL,9.3mg/mL氯铂酸溶液和330 μL,11.8 mg/mL氯化钯溶液,Pt和Pd质量分别为0.004 g。
2 结果与讨论
2.1 X射线衍射分析
图1为催化剂的X射线衍射分析谱图。从图1可见。对照TiO2锐钛矿的标准XRD衍射图,图1中在 2θ为 25.3°,37.8°,48.0°,53.9°,62.9°处的衍射峰可归属于锐钛矿(101)、(004)、(200)、(105)及(204)晶面的衍射峰。在XRD图谱中并没有观察到其他相位的衍射峰,可以判断煅烧后的样品在XRD可分辨范围内并无其他杂质存在,因此可判断样品为锐钛矿型,用NaOH处理并未改变TiO2的晶型。

图1 催化剂的XRD图
2.2 扫描电镜分析
图2为不同放大倍数下催化剂的扫描电镜图。从图2可见,所制备的TiO2为纳米级球形颗粒、尺寸均匀。较高的比表面积为光催化反应提供了更多的反应活性位点,具有很好的光催化效率。
2.3 红外光谱分析
图3为催化剂的红外光谱图。从图3可见,用NaOH处理TiO2的红外谱图并未发生改变。图3中3 500 cm-1处的峰是催化剂表面吸附水中的O-H键的弯曲振动峰,在1 650 cm-1处的峰为催化剂表面吸附水中羟基的伸缩振动峰,在400~800 cm-1为锐钛矿TiO2中的Ti-O-Ti键的伸缩振动峰。
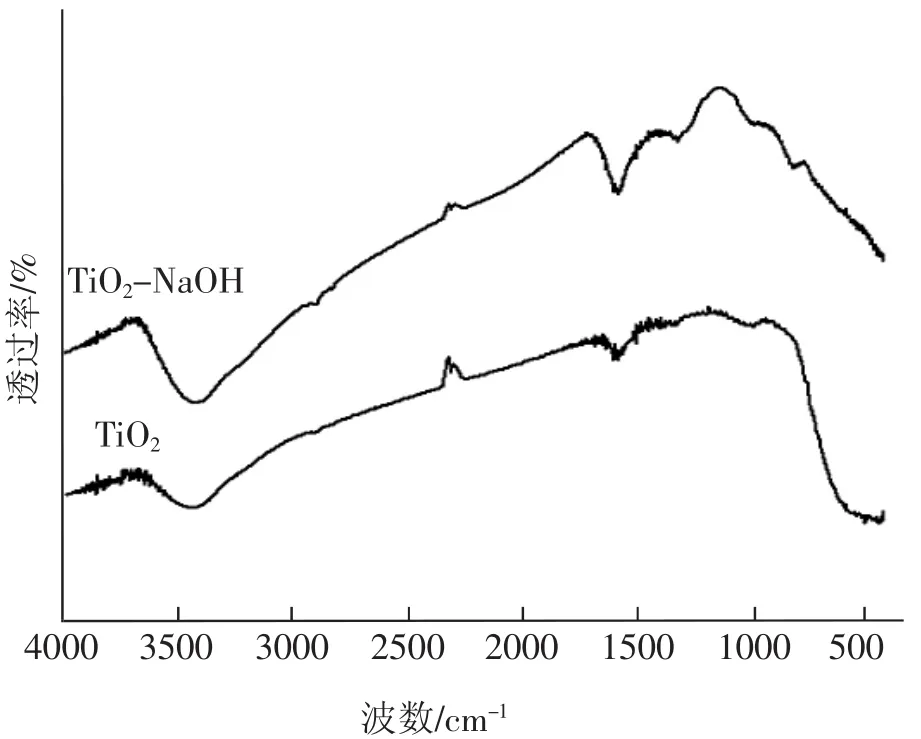
图3 催化剂的红外光谱
2.4 紫外-可见漫反射吸收光谱分析
图4为光催化剂的紫外-可见漫反射吸收光谱图。从图4可见,在紫外光区的200~350 nm,催化剂具有比较强的吸收能力,表明所制得的TiO2样品具有较好的紫外吸收特性。样品的禁带宽度利用紫外可见漫反射测量中的吸光度与波长数据作图,利用截线法做出吸收波长阈值λg(nm),禁带宽度Eg可通过公式Eg=1 240/λg计算得出。图4中TiO2估算Eg为3.06 eV,而NaOH处理的TiO2估算Eg为2.66 eV,用NaOH处理的TiO2禁带宽度有所降低,对光的吸收能力增强。

图4 催化剂的紫外可见漫反射
2.5 光催化性能分析
催化剂的产氢活性如图5所示。从图5可见,空白和TiO2为催化剂时曲线的趋势很平缓,且产氢量均不高。每小时采集的产氢量呈现出先逐渐上升达到最高点后缓慢降低的趋势,以TiO2为催化剂的产氢试验中,添加助催化剂Pt的光解水产氢活性最好。空白试验的光解水产氢速率为0.153 mmol/h。以 TiO2、Pt/TiO2、Pd/TiO2为催化剂时,光解水产氢速率分别为0.231,1.457,1.394 mmol/h。并且纯TiO2的产氢性能并不理想,加入Pt、Pd助催化剂后产氢性能大大提高,产氢量分别约是空白试验的6.304和6.043倍。图6为各使用0.004 g的Pt、Pd作催化剂与甲酸空白的产氢速率,可以看出单独使用Pt、Pd做催化剂几乎不产氢。

图5 催化剂产氢量
图6 助剂产氢量
图7为催化剂对甲酸水溶液产氢的选择性。从图7可见,Pd/TiO2的选择性最好,空白试验的选择性最差。对他们的选择性作对比可得到Pd/TiO2>Pt/TiO2>TiO2>空白。

图7 催化剂的选择性
3 结论
本研究采用水热法制备了TiO2催化剂,通过XRD、IR、UV-Vis DRS及SEM测试手段对所制备的光催化剂进行结构和形貌分析,通过光沉积法原位添加Pt、Pd助剂以提高TiO2光催化效率。本研究发现,水热法制备的TiO2光催化剂,掺杂Pt、Pd助剂可有效提高其光催化产氢活性,含甲酸废水光催化产氢速率表现为Pt/TiO2>Pd/TiO2>TiO2,分别是空白试验的 6.304,6.043,1.509倍,且Pd/TiO2对甲酸废水光催化产氢选择性最好。但是,催化剂对废水中其他有机酸的光催化产氢活性还需进一步研究。
