抑制转位蛋白在氧糖剥夺/复糖复氧模型中对BV-2细胞损伤和自噬的影响
2022-05-11玉苏甫马合木提阿布都热合曼阿卜拉苏日青卡合尔曼卡德尔成金亮麦麦提亚生麦麦提吐尔逊姜世豪买买提力艾沙汪永新成晓江
玉苏甫·马合木提,阿布都热合曼·阿卜拉,苏日青,卡合尔曼·卡德尔,成金亮,麦麦提亚生·麦麦提吐尔逊,姜世豪,买买提力·艾沙,汪永新,成晓江
(新疆医科大学第一附属医院神经外科,新疆 乌鲁木齐 830054)
脑卒中是由向大脑传送血液的血管系统引起的急性疾病,是世界三大疾病相关死因之一,脑卒中分为出血性脑卒中和缺血性脑卒中,其中缺血性脑卒中约占所有脑卒中患者的87%[1]。目前公认尽早恢复缺血区域血流是治疗脑缺血最有效的治疗方法,只有在缺血性卒中发作后4.5 h内使用阿替普酶(Alteplase)静脉溶栓或发作后6-24 h进行血管内取栓术和动脉内溶栓治疗是有效的,然而,缺血区域恢复血供甚至会进一步加剧脑缺血引起的脑缺血/再灌注损伤(cerebral ischemic reperfusion injury, CIRI)[2-3]。CIRI的发生发展机制较为复杂,据报道有多种病理生理参与了该过程,包括氧化应激、自噬、细胞凋亡、炎症和细胞坏死等,自噬在CIRI过程中发挥重要作用[4]。因此,自噬与CIRI机制的深刻研究可能为CIRI的诊治提供新靶点。
自噬作为重要的病理生理过程,在正常条件下会有规律的进行,并且自噬对于大脑的细胞稳态至关重要。在遇到应急(如营养缺乏、饥饿)或急性损伤的条件下(如创伤、缺血/再灌注等)自噬会增加,并且增加量可能与应激/损伤程度成正比;据报道,在各种类型的急性脑损伤后,包括外伤性脑损伤(traumatic brain injury, TBI)、脑卒中和癫痫发作,自噬会相应的增加,各种实验模型报道一部分有促进自噬,有部分会抑制自噬,大脑中这种自噬的增减是否代表了一种保护反应、病理过程或一种偶发的现象仍存在争议[5]。因此,自噬在CIRI中是一把双刃剑。
18 ku转位蛋白(18 ku translocator protein,TSPO)定位于细胞线粒体上的跨膜转运蛋白,是外周苯二氮受体(benzodiazepine receptor,PBR),它能够结合中枢神经系统(central nerve system, CNS)外的苯二氮类药物,在癌症、炎症、机械损伤和神经系统疾病等各种病理条件下均容易在小胶质细胞中上调[6]。研究表明,TSPO可作为靶点限制神经炎症和继发性脑损伤[7]。近期研究显示,TSPO在神经肿瘤增殖、自噬进展中发挥重要作用,但目前尚未见TSPO在脑缺血/再灌注损伤与自噬相关的研究。因此,本实验通过体外对BV2小胶质细胞采用氧糖剥夺/复糖复氧模型(oxygen-glucose deprivation/reperfusion, OGD/R)模拟CIRI模型,初步研究TSPO对CIRI的作用和机制。
1 材料与方法
1.1 细胞BV-2细胞(小鼠小胶质细胞),购买于武汉普诺赛生命科技有限公司。
1.2 主要试剂MEM培养基(32571-036)购于GIBCO公司;胎牛血清(FND500)购于ExcellBio公司;胰蛋白酶(25200-056)、双抗(15070-063)均购于GIBCO公司;PBS(ZLI-9062)购于北京中杉金桥生物公司;TSPO三保一慢病毒(LV-TSPO-RNAi)载体构建以及阴性对照病毒NCshRNA和TSPOshRNA委托上海吉凯基因公司完成;TSPO抗体(ab92291);p62(ab109012)、LC3B(ab192890)、Beclin-1(ab207612)、β-actin(ab92291)等抗体均购于美国Abcam公司;CCK-8细胞增殖检测试剂盒、细胞毒性检测试剂盒(FC101-03)购于北京全式金生物技术有限公司。
1.3 实验仪器细胞超净台(HF1200LC),台式低速离心机(DK-80),二氧化碳细胞培养箱(SmartCell HF-90),三气培养箱(HF100)均购于上海力康仪器有限公司,荧光酶标仪(VLB000D2),高速冷冻离心机(Heraeus Multifuge X1R)均购于赛默飞世尔科技公司;电泳仪(DYCZ-24DN)购于北京六一生物科技有限公司,凝胶成像系统(2500)购于上海天能科技有限公司。
1.4 方法
1.4.1细胞培养与细胞分组
1.4.1.1 实验分组 首先将BV-2小胶质细胞分为正常组(control)、模型组(OGD/R),通过观察两组细胞生存情况和乳酸脱氢酶(lactatedehydrogenase, LDH)含量明确最佳缺氧复养时间;为进一步观察TSPO在OGD/R中对BV-2小胶质细胞损伤的作用,我们采取TSPO短发夹RNA(short hairpin RNA, shRNA)抑制TSPO表达,分别以TSPOshRNA空载病毒组、NCshRNA阴性对照作为空白对照组;将BV-2小胶质细胞分为4组:正常组(control)、氧糖剥夺/复糖复氧组(OGD/R)、shRNA阴性对照组(OGD/R+NCshRNA)、TSPO短发夹RNA组(OGD/R+TSPOshRNA)。
1.4.1.2 细胞复苏、培养与传代 液氮取出的BV2小胶质细胞,37 ℃水浴快速复苏后用完全培养基培养,在完全培养基中加入10%胎牛血清,1%双抗(抗青霉素/链霉素)培养BV2小胶质细胞,BV2置于5%CO2、37 ℃适宜的培养箱中培养2 d,待细胞生长值密度为90%左右时进行传代培养。
1.4.1.3 建立OGD/R模型 BV2细胞在培养箱中培养24 h后换液,细胞长至60%后,用PBS冲洗,再加入不含血清的MEM培养基,在置入95%N2+5%O2的37 ℃饱和三气培养箱,分别培养3、6、12 h。缺氧不同时间后,更换新鲜的MEM完全培养基,置入CO2培养箱中继续培养18 h。对照组在CO2培养箱中培养相应时间,选择缺氧6 h为OGD干预时间。除正常组以外,其他三组均需要氧糖剥夺6 h,复糖复氧18 h建立OGD/R模型。
1.4.1.4 细胞转染以及沉默TSPO稳定慢病毒表达株的构建 阴性对照病毒(LV-EGFP-NC)感染在培养的小胶质细胞融合度为30%小胶质细胞,用无血清培养基依次将病毒稀释至滴度1×1011TU·L-1,1×1010TU·L-1,1×109TU·L-1,更换培养基加入病毒及相应感染增强液,感染12 h后换回正常培养基。感染约72 h荧光表达丰度较高时,用显微镜观察。感染效率80%左右,且细胞生长良好的组所对应的感染条件和MOI即可作为后续感染实验的依据。按上述感染条件使用三种LV-TSPO-RNAi感染细胞,采用qRT-qPCR筛选最佳TSPO沉默慢病毒,通过Western blot检测慢病毒转染效率。
1.4.2CCK-8法检测细胞增殖 将BV2细胞接种至96孔板中,按实验分组干预;干预完成后,弃去培养基,每孔加入100 μL配置好的10% CCK-8溶液,培养箱中孵育1 h后用酶标仪测定450 nm处的光密度(optical density, OD)值。
1.4.3ROS细胞毒性检测 取生长状态良好汇合率达90%的BV2细胞,胰酶消化细胞后,用完全培养基制备成1×108L-1单细胞悬液,接种至6孔板中(2 mL每孔,2×105每孔),37 ℃、5% CO2培养24 h 长至80%后,按实验分组进行细胞干预。干预完成后,每孔加入2 mL磷酸盐缓冲盐溶液(phosphate buffered saline, PBS)与2 μL DCFH-DA稀释液,DCFH-DA终浓度为10 μmol·L-1。置于培养箱中37 ℃孵育30 min,收集细胞,PBS洗涤2次,用PBS重悬细胞至1×109L-1,取100 μL细胞悬液加到96孔不透光白色板中,用荧光酶标仪上机检测荧光强度值。荧光检测波长设置:激发波长500 nm,发射波长525 nm。
1.4.4qRT-PCR检测细胞中各类mRNA的表达 细胞接种于96孔板中培养,按实验分组进行细胞干预完成后,弃去培养基,使用PBS缓冲液温柔清洗后,加入1 mL TRIzol提取细胞总RNA,按照cDNA逆转录试剂盒操作步骤得到cDNA,以小鼠源β-actin作为内参,采用qRT-RCR检测相关指标mRNA的相对表达量。小鼠源TSPO引物序列:前引物:5′- GCCTACTTTGTACGTGGCGAG-3′;后引物:5′- CCTCCCAGCTCTTTCCAGAC-3′。
1.4.5Western blot检测细胞各类蛋白表达 各组细胞按实验分组进行细胞干预完成后,弃去培养基,加入3 mL无菌的PBS缓冲液反复冲洗2遍,弃去PBS缓冲液,用胰酶消化细胞,操作方法同细胞传代。离心后弃去上清液留细胞沉淀,用5 mL无菌PBS洗一遍后收集细胞。加入RIPA ∶PMSF ∶广谱磷酸酶抑制剂=100 ∶1 ∶1,玻璃匀浆器冰上充分匀浆,冰浴放置60 min后,12 000 r·min-1,4 ℃,离心15 min收集上清。取上清用BCA试剂盒测量蛋白浓度。用凝胶电泳法分离各蛋白,再转膜后,使用含5%脱脂奶粉的封闭液封闭含有蛋白的聚偏二氟乙烯(polyvinylidene fluoride, PVDF)转运膜1 h。加入TSPO(1 ∶800)、LC3B(1 ∶1 000)、p62(1 ∶800)、Beclin-1(1 ∶1 500)、β-actin(1 ∶1 000)一抗4 ℃过夜,TBST缓冲液漂洗3次(5min/次),加入适当稀释的二抗山羊抗小鼠IgG H&L (HRP) (1 ∶15 000),HRP-兔抗山羊IgG、山羊抗兔IgG H&L (HRP)(1 ∶5 000),室温孵育1 h,TBST漂洗3次,5 min/次,将显色液A液和B液混合,加2 mL至膜上,用ChemiScope mini化学发光仪检测,拍照,β-actin作为内参。

2 结果
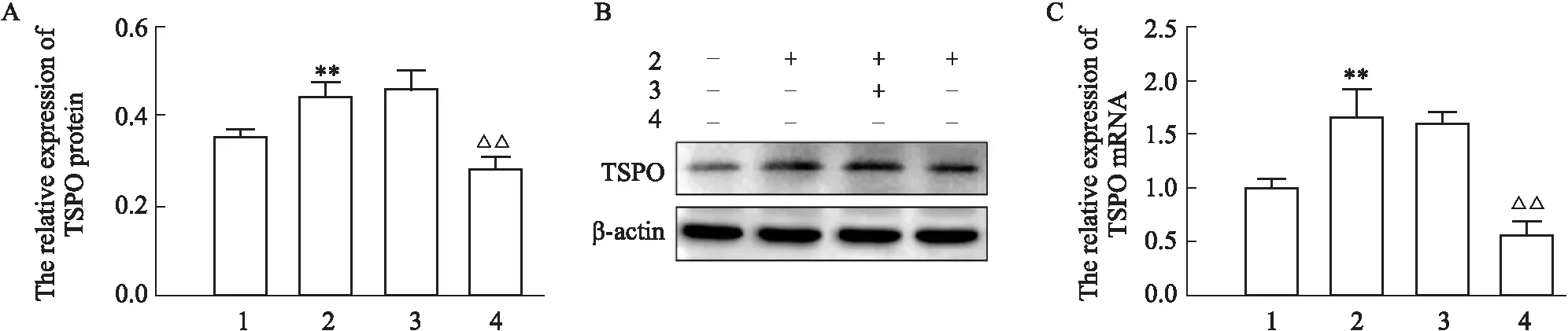
2.1 TSPO在BV2细胞OGD/R损伤模型中明显上调通过Western blot、qRT-PCR检测TSPO在BV2细胞OGD/R损伤模型中的变化(Fig 1A、1B、1C)。与Control组比较,氧糖剥夺6 h,复糖复氧18 h后,TSPO蛋白和TSPO mRNA的表达含量明显上调,并且具有统计学意义(P<0.05);OGD/R组与OGD/R+NCshRNA组之间TSPO蛋白和TSPO mRNA的表达含量差异无统计学意义;与OGD/R+NCshRNA组比较,OGD/R+TSPOshRNA组中TSPO蛋白和TSPO mRNA的表达含量明显下调,差异有统计学意义(P<0.05)。
2.2 TSPO抑制对OGD/R小胶质细胞增殖的影响CCK-8细胞增殖检测结果提示(Fig 2A),与Control组比较,OGD/R组小胶质细胞存活率明显降低,差异有统计学意义(P<0.05);与OGD/R组比较,OGD/R+NCshRNA组小胶质细胞存活率无差异;而OGD/R+TSPOshRNA组与OGD/R+NCshRNA组比较,TSPO抑制组中小胶质细胞存活率明显增高,差异有统计学意义(P<0.05)。

Fig 2 Effect of TSPO on cell viability and cytotoxicity n=3)
2.3 TSPO抑制对OGD/R小胶质细胞内ROS水平的影响小胶质细胞内活性氧(reactive oxygen stress,ROS)水平检测提示(Fig 2B),与Control组比较,OGD/R组小胶质细胞内ROS水平明显增高,差异有统计学意义(P<0.05);与OGD/R组比较,OGD/R + NCshRNA组小胶质细胞内ROS水平升高,结果差异有统计学意义(P<0.05);与OGD/R + NCshRNA组比较,OGD/R+TSPOshRNA组小胶质细胞内ROS水平降低,差异有统计学意义(P<0.05)。
2.4 TSPO抑制对OGD/R处理的BV2细胞自噬水平mRNA的影响通过qRT-PCR实验检测BV2小胶质细胞中自噬相关LC3B mRNA、Beclin-1 mRNA以及p62 mRNA的表达改变(Fig 3C)。OGD/R后,与Control组比较,OGD/R组小胶质细胞中p62 mRNA表达减少、LC3B mRNA和Beclin-1 mRNA表达明显增加,细胞自噬被激活,差异有统计学意义(P<0.05);OGD/R组与OGD/R+NCshRNA组之间各自噬水平相关mRNA表达差异无统计学意义;与OGD/R+NCshRNA组比较,OGD/R+TSPOshRNA组小胶质细胞内p62 mRNA表达明显增加,LC3B mRNA和Beclin-1 mRNA表达明显降低,差异有统计学意义(P<0.05)。结果表明,下调TSPO后,细胞自噬水平被抑制。
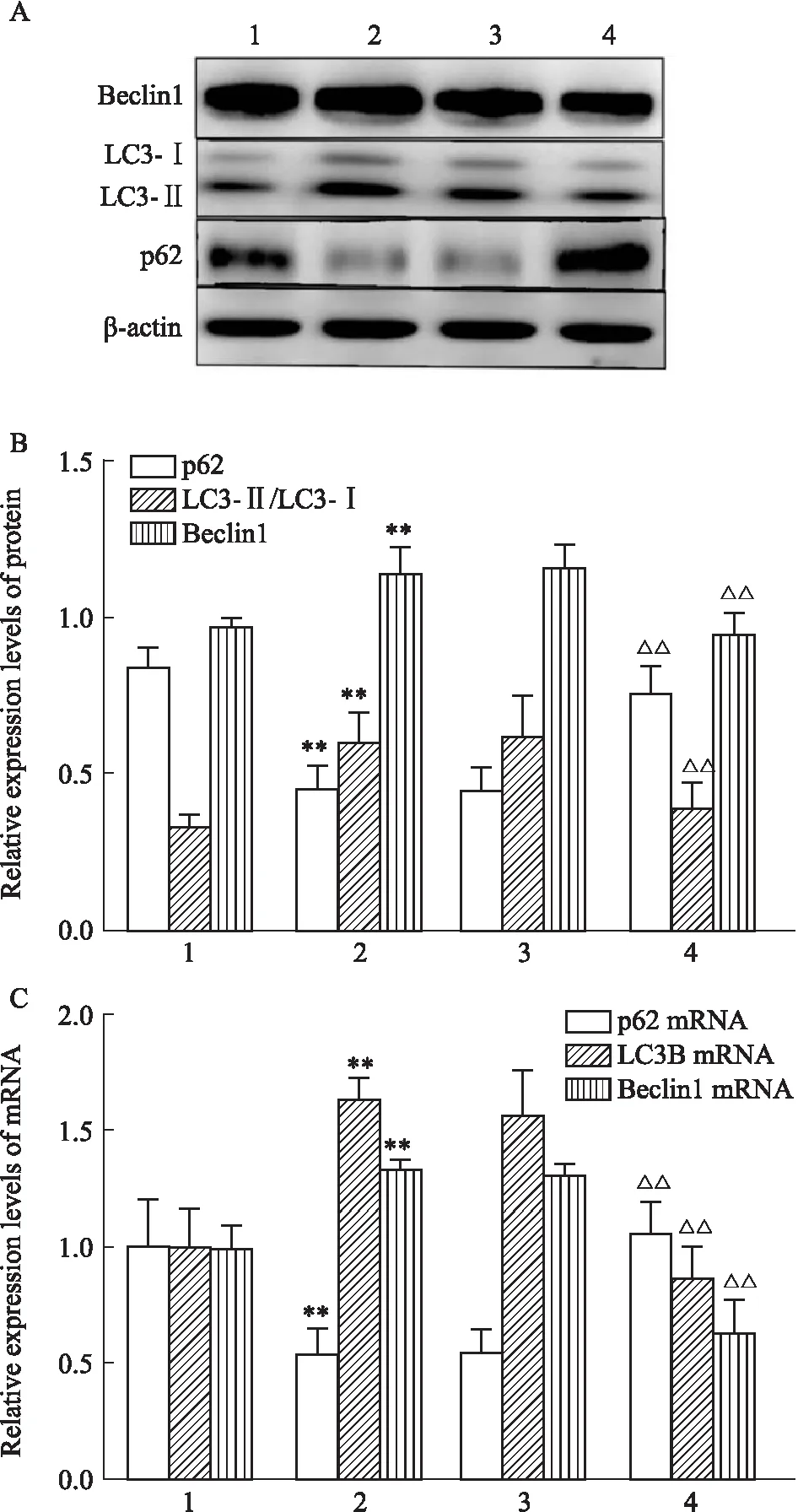
Fig 3 Effect of TSPO down-regulation on autophagy in OGD/R-treated BV2 cells n=3)
2.5 TSPO抑制对OGD/R处理的BV2细胞自噬水平蛋白的影响为探讨TSPO抑制在OGD/R后小胶质细胞损伤的机制,采用Western blot实验检测自噬水平相关蛋白LC3Ⅱ/LC3Ⅰ、Beclin-1以及p62的表达情况。结果见Fig 3A、3B所示,OGD/R后,与Control组比较,OGD/R组小胶质细胞中p62蛋白表达减少、LC3Ⅱ/LC3Ⅰ和Beclin-1蛋白表达明显增加,细胞自噬被激活,差异有统计学意义(P<0.05);与OGD/R组对比,OGD/R+NCshRNA组小胶质细胞中各个自噬水平蛋白表达差异无统计学意义;与OGD/R+NCshRNA组对比,OGD/R+TSPOshRNA组小胶质细胞中p62蛋白表达增加、LC3Ⅱ/LC3Ⅰ蛋白和Beclin-1蛋白表达明显降低,细胞自噬被抑制,差异有统计学意义(P<0.05)。
3 讨论
适当的自噬对缺血的神经组织有保护作用,而过度的自噬可能导致细胞死亡,炎症反应对缺血后神经细胞的存活和神经组织的恢复起着重要作用,在缺血性卒中的发病机制中,自噬和炎症之间存在相互作用[4]。自噬的重要作用不仅体现在如细胞生长、分化和衰老等生理过程,而且也伴随着一些病理条件发挥重要作用,例如神经系统疾病、代谢性疾病、心脑血管病等[8]。目前的证据表明,自噬在脑缺血损伤后神经保护中有双重作用;一方面,3 methyladenine (3-MA)和wortmannin (WM)抑制自噬通路的激活,促进新生大鼠神经元凋亡和坏死,增加缺血缺氧所致的脑梗死体积和神经功能缺损;相反,在缺血缺氧前使用雷帕霉素激活自噬通路可增加Akt和cAMP反应元件结合蛋白CREB的磷酸化,从而显著减少神经元死亡和脑损伤[9]。另一方面,体外和体内研究也表明,细胞过度自噬也会导致神经元死亡(自噬细胞死亡)[10]。因此,自噬在脑缺血中的作用可能取决于其作用的时间或激活/抑制的程度。
TSPO的表达在神经退行性疾病、神经炎症和精神疾病中发生改变[11]。Gatliff等[12]研究表明,TSPO通过与线粒体电压依赖性阴离子通道(voltage-dependent anion channel,VDAC1)结合,减少线粒体偶联,并促进ROS的过量产生,从而抵消了蛋白质泛素化,表明TSPO是通过自噬来调节线粒体质量的一个重要因素。在一项大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)动物实验中发现,TSPO蛋白和mRNA的表达量明显增加,并且促进了炎症反应,在使用相同方法,缺血更长时间检测到较强的TSPO+CD11b+,表明TSPO是主要表达在小胶质细胞中。小胶质细胞已被证明与中枢神经系统稳态的发展和维持有关,但在神经组织损伤时,小胶质细胞被激活并促进神经炎症和神经退行性变[13]。Nozaki等[14]发现,通过LPS刺激培养的小胶质细胞中TSPO的表达量明显增多,并且伴随着细胞炎症因子和ROS的升高。这表明TSPO可能通过介导小胶质细胞产生ROS和细胞因子从而加重损伤。Lan等[15]研究表明,TSPO的拮抗剂pk11195通过抑制小胶质细胞的活化和自噬来缓解脂多糖(lipopolysaccharide,LPS)诱导的大鼠认知功能障碍。我们研究了TSPO调节CIRI中的潜在的机制,研究表明,在OGD/R损伤的BV2细胞中,自噬被激活,并伴有TSPO上调,细胞增殖能力降低,细胞毒性增加。自噬作为能量和细胞稳态的重要降解途径,主要是作为一种防御机制,可能在应激环境下防止细胞死亡。同时,自噬在脑I/R损伤中有促生存或促死亡的作用,被认为是一把双刃剑。在OGD/R条件下,TSPO表达升高明显促进了BV2细胞中LC3-I向LC3-II的转化和Beclin1水平,p62表达水平明显降低,说明TSPO表达增加促进自噬激活;而OGD/R+TSPOshRNA组中自噬活动被抑制。由此我们推断,抑制TSPO表达可降低小胶质细胞在OGD/R中的自噬激活,减轻神经细胞损伤,从而促进神经保护作用。
在各种损伤和疾病的实验模型中,TSPO配体已被证明可以抑制小胶质细胞的激活,提高神经元的存活率,并改善再生过程[16]。已知TSPO主要表达于中枢神经系统的小胶质细胞,静息状态下小胶质细胞中TSPO的表达较低,但当小胶质细胞被激活时,其表达显著增加[17]。本研究通过shRNA抑制TSPO在小胶质细胞中的表达,并进行OGD/R处理,观察小胶质细胞的活力及损伤情况。CCK-8细胞增殖检测显示,OGD/R组细胞活力明显降低,OGD/R+TSPOshRNA组细胞活力与Control组无差异;细胞ROS检测表明,OGD/R处理细胞ROS含量明显增高,OGD/R+TSPOshRNA组ROS含量比OGD/R组低。由此可得,OGD/R对小胶质细胞有损伤作用,而TSPO抑制的OGD/R细胞中,细胞活力增加,细胞损伤程度降低,推测TSPO抑制对小胶质细胞具有保护作用,并且这保护作用可以通过抑制细胞自噬实现。
综上,抑制TSPO对OGD/R诱导的BV2小胶质细胞损伤有显著的保护作用,其细胞损伤机制可能与OGD/R上调TSPO,进一步促进自噬激活相关。TSPO有望成为干预CIRI的新靶点。但TSPO对OGD/R小胶质细胞损伤相关的自噬途径和可能的作用机制尚不明确,需进一步实验验证。
